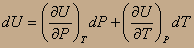Теплота и работа.
Изменения форм движения при переходе его от одного тела к другому и соответствующие превращения энергии весьма разнообразны. Формы же перехода движения и связанных с ним переходов энергии могут быть разбиты на две группы:
В первую группу входит только одна форма перехода движения путем хаотических столкновений молекул двух соприкасающихся тел, т.е. путём теплопроводности (и одновременно путём излучения). Мерой передаваемого таким способом движения является теплота.
Теплота есть форма передачи энергии путем неупорядоченного движения молекул.
Во вторую группу включаются различные формы перехода движения, общей чертой которых является перемещение масс, охватывающих очень большие числа молекул (т.е. макроскопических масс), под действием каких-либо сил. Таковы поднятие тел в поле тяготения, переход некоторого количества электричества от большего электростатического потенциала к меньшему, расширение газа, находящегося под давлением и др. Общей мерой передаваемого такими способами движения является работа.
Работа - форма передачи энергии путём упорядоченного движения молекул.
Теплота и работа характеризуют качественно и количественно две различные формы передачи энергии от данной части материального мира к другой. Нельзя говорить, что теплота и работа содержатся в теле. Они являются характеристиками процесса. Характеризуют только процесс. В статических условиях теплота и работа не существуют.
Важное положение: различие между теплотой и работой, принимаемое термодинамикой как исходное положение, и противопоставление теплоты работе имеет смысл только для тел, состоящих из множества молекул, т.к. для одной молекулы или для совокупности немногих молекул понятия теплоты и работы теряют смысл. Поэтому термодинамика рассматривает лишь тела, состоящие из большого числа молекул, т.е. так называемые макроскопические системы.
Основные понятия термодинамики
Термодинамический метод характеризуется тем, что объектом исследования является тело или группа тел, условно выделяемых из материального мира в термодинамическую систему.
Термодинамическая система - тело или совокупность тел, мысленно ограниченных от окружающих систем (тел, среды).
Система является гомогенной, если каждый параметр её имеет во всех частях системы одно и то же значение или непрерывно изменяется от точки к точке. Система является гетерогенной, если она состоит из нескольких макроскопических частей, отделенных одна от другой видимыми поверхностями раздела. Гомогенные части гетерогенной системы, отделённые от остальных частей видимыми поверхностями раздела, называются фазами. Кроме того, системы бывают открытые, закрытые и изолированные.
Открытая система - может обмениваться с окружающей средой веществом и энергией.
Закрытая система - не обменивается с окружающей средой веществом, но энергией обмениваться может.
Изолированная система - система, которая не может обмениваться с окружающей средой веществом и энергией.
Нулевой закон термодинамики
 Обычно в курсах термодинамики рассматривают три закона: первый, второй и третий - они составляют основу термодинамики. Однако сейчас всё чаще вводят в изложение термодинамики закон термического равновесия, сформулированный Фаулером в 1931 г., т.е. много позже установления основных законов. Новый закон получил название нулевого. Он сформулирован так:
Обычно в курсах термодинамики рассматривают три закона: первый, второй и третий - они составляют основу термодинамики. Однако сейчас всё чаще вводят в изложение термодинамики закон термического равновесия, сформулированный Фаулером в 1931 г., т.е. много позже установления основных законов. Новый закон получил название нулевого. Он сформулирован так:
Две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом. Это не тривиально, например, данный закон не относится к химическому равновесию. Так, NH3 (I система) и HCl (II система) могут находиться в равновесии с N2 (III система). Однако между собой они будут быстро реагировать.
Для доказательства рассмотрим три системы, способные обмениваться теплотой. Предположим, что каждая из трёх систем характеризуется некоторым числом переменных, т.е. свойств, определяющих состояние. В качестве переменных рассмотрим P и V. Если две системы могут термически взаимодействовать, то свойства каждой из них будут изменяться. Установление термического равновесия между двумя системами будет поэтому связано с взаимозависимым изменением четырёх переменных, характеризующих их состояние. Математически это соответствует функциональной связи четырех переменных. Например, для систем I и II.
F(P1,V1; P2,V2)=0 (1)
Аналогично, если системы II и III находятся в термическом равновесии:
G(P2,V2; P3,V3)=0 (2)
Cогласно нулевому закону, в равновесии должны находиться и системы I и III, т.е.
H(P1,V1;P3,V3)=0 (3)
Поскольку все переменные оказываются взаимосвязанными, соотношение (3) должно выводиться из (1) и (2). Но так как переменные P2 и V2 в выражении (3) не содержатся, то должна существовать возможность их исключения из (1) и (2). Однако из двух уравнений можно исключить только одну переменную; две переменные исключаются, если они присутствуют в комбинации как некоторые функции, например, Y(P2,V2) в уравнениях (1) и (2). Аналогично P1 и V1 должны входить в виде функции X(P1,V1). P3 и V3 - в виде функции Z(P3,V3). Поэтому уравнения (1),(2),(3) представляются в виде:
F(X,Y)=0; G(Y,Z)=0; H(X,Z)=0
(4) (5) (6)
Теперь в принципе, возможно, исключить одну из трёх переменных в каких- либо двух из этих уравнений. Например, уравнения (5) и (6) можно решить относительно Z, т.е. Z=Y(y) и Z=X(x). Следовательно, Y(y)=X(x), где X- функция P1,V1, Y – функция P2 и V2. Следовательно, должны существовать такие функции f1(P1,V1) и f2(P2,V2), что при термическом равновесии систем (I) и (II) имеет место равенство
f1(P1,V1)=f2(P2,V2)
Используем другую пару уравнений, например, (4) и (5). Получаем Y=X(x) и Y=Z(z); следовательно, X(x)=Z(z), где x - функция P1,V1; z - функция Р3 и V3. Следовательно, должны существовать такие функции f1(P1,V1) и f3(P3,V3), что при термическом равновесии
f1(P1,V1)=f3(P3,V3);
Следовательно f1(P1,V1)=f2(P2,V2)=f3(P3,V3) (7)
Равенство (7) даёт основание считать, что существует такая функция переменных свойств системы, например, Т=Т(Р,V) (8),что две любые системы, находящиеся в термическом равновесии, характеризуются одинаковыми значениями Т. Так может быть введено понятие "температура".
Следует также отметить, что нулевой закон термодинамики утверждает существование уравнения состояния, т.к. соотношение (8) формально эквивалентно уравнению F(P,V,T)=0.
 Однако чисто термодинамическое рассмотрение не в состоянии уточнить вид этой функции.
Однако чисто термодинамическое рассмотрение не в состоянии уточнить вид этой функции.
Закон Гесса
Основным в термохимии является понятие теплового эффекта. О нём недостаточно сказать, что это теплота, выделяющаяся или поглощающаяся при химической реакции. Последнее верно при соблюдении следующих условий:
1. Объём или давление постоянны (P=const и V=const)
2. Не совершается никакой работы, кроме возможной при P=const работы расширения
3. Температура продуктов реакции равна температуре исходных веществ. При этих условиях тепловой эффект становится величиной, наиболее определённой и зависящей только от характера протекающей химической реакции.
В соответствии с условием №1 в термохимии различают тепловые эффекты химических реакций при V=const Q V и при P=const Q P (это рассматривалось ранее)
QV = U 2 - U 1 = ΔU; QP = H 2 - H 1 = ΔH;
U 2 - внутренняя энергия продуктов реакции
U 1 - внутренняя энергия исходных веществ
Эти соотношения показывают, что тепловой эффект является функцией состояния системы в данных условиях.
Энтальпию можно рассматривать как некую "полную энергию", т.е. как сумму внутренней энергии U и "объёмной энергии" PV. Однако наиболее ясно физический смысл Н проявляется в соотношении QP = ΔH; разность энтальпий в двух состояниях системы равна тепловому эффекту изобарного процесса. Выведенные соотношения позволяют сформулировать основной закон термохимии - закон Гесса: тепловой эффект химической реакции при V=const или P=const не зависит от пути хода реакции, т.е. от промежуточных стадий, и определяется только родом начальных и конечных веществ и их состоянием (1836 г). Гесс установил этот закон экспериментально ещё до окончательной формулировки первого начала термодинамики.
Закон Гесса позволяет определять тепловые эффекты реакций, которые или невозможно измерить непосредственно, или по каким-либо причинам не были измерены.Закон Гесса позволяет обращаться с термохимическими уравнениями, как с алгебраическими, т.е. складывать и вычитать их, если только тепловые эффекты относятся к одинаковым условиям.Такие расчеты для теплот образования,теплот сгорания часто называют следствия из закона Гесса.
 ЭТО МАЛО И НЕСЕРЬЕЗНО. НОРМ ИНФА В МЕТОДЧКЕ ЛЕВЧЕНКОВА «1-Е НАЧАЛО ТЕРМОДИНАМИКИ.
ЭТО МАЛО И НЕСЕРЬЕЗНО. НОРМ ИНФА В МЕТОДЧКЕ ЛЕВЧЕНКОВА «1-Е НАЧАЛО ТЕРМОДИНАМИКИ.
Билеты №9,14,20.Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Приближения закона Кирхгоффа
Закон Кирхгоффа
Его вывод практически идентичен указанному в методичке, поэтому приведу тут только приближения.
Для вычисления интегралов необходимо знать зависимость С P =f(T). Поэтому формулу Кирхгоффа применяют в трёх приближениях.
В первом, наиболее грубом приближении, полагают ΔC P =0, т.е. считают равными суммарные теплоёмкости продуктов и исходных веществ. Поэтому получаем  тепловой эффект процесса не зависит от температуры.
тепловой эффект процесса не зависит от температуры.
Во втором, более точном приближении, считают Δ CP = const ≠ f (T)
Тогда получаем Δ HT = ΔCPT + ΔHy, где ΔHy - константа интегрирования
Пример: проведём расчёт во втором приближении зависимости ΔH =f(T) для реакции превращения СН4 в С2Н4: 2СН4→ С2Н4 + 2Н2
Значения ΔH обр (СН4,С2Н4) можно взять из табл., ΔH обр (Н2)=0 (простое вещество), тогда по следствию из закона Гесса:
ΔH х. p. = ΔH обр. С2H4 -2 ΔH обр. СН4 = 48300 кал/моль.
Также из таблиц находят значения стандартных теплоёмкостей при Т=298,15 К:
На основании этих данных можно записать изменение теплоёмкости:
Δ Ср=9,87+2·6,90-2·8,60=6,47кал/град
Поэтому, зная = 48300, можно рассчитать константу интегрирования ΔHJ: ΔHJ =48300-6,47·298,15=46370;
Отсюда получаем окончательно формулу второго приближения: ΔHT = 46370+6,47Т;
В третьем, наиболее точном приближении использования формулы Кирхгоффа учитывают зависимость Δ С P = f(T).
Следует заметить, что теоретический расчет теплоёмкости, особенно для газов и жидкостей,не всегда возможен и весьма трудоемок. Поэтому наиболее надёжный путь до настоящего времени состоит в использовании эмпирических формул. Экспериментальные значения теплоёмкостей при различных температурах стараются охватить степенным температурным рядом, причём в зависимости от желаемой степени точности используют ряды с различным числом членов, т.е.
С P = a + b Т+сТ2+...
Например, для Н2 и СН4:
, H 2 =6,9469-0,1999·10-3Т+0,4808·10-6Т2 (кал/град·моль)
, CH 4 =3,422+17,845·10-3Т+4,165·10-6Т2 (кал/град·моль)
Следовательно, Δ CP =Δа+ΔвТ+ΔсТ2+...
Где, например, Δа является следующей алгебраической суммой, записываемой с учётом коэффициентов химического уравнения: 
Поэтому после подстановки Δ С P = f(T) в формулу Кирхгоффа, получаем расчётную формулу третьего приближения: 
 Здесь, как и ранее, ΔHJ - постоянная, которую чаще всего определяют из известного ΔH 298.
Здесь, как и ранее, ΔHJ - постоянная, которую чаще всего определяют из известного ΔH 298.
II-е начало термодинамики
I-й Закон термодинамики устанавливает эквивалентность различных форм энергии, в частности, внутренней энергии, теплоты и работы. Если система изолирована от окружающего мира, то её внутренняя энергия остаётся неизменной. С точки зрения первого закона возможны и равновероятны любые процессы, в которых вместо претерпевшего превращения одного вида энергии появится эквивалентное количество другого вида. Так, первому закону не противоречило бы поднятие груза или закручивание какой-либо пружины за счёт внутренней энергии окружающей среды. Почему, в самом деле, камень, лежащий на земле, не может подняться на какую-то высоту за счет охлаждения окружающего воздуха? Однако не поднимается! Переход теплоты от менее нагретого тела к более нагретому означал бы лишь перераспределение энергии внутри системы и также не противоречил первому закону. Однако известно, что сосуд с водой никогда не закипит на холодной плите. Иными словами, первый закон ничего не говорит о возможности и вероятности того или иного процесса, связанного с превращением энергии или её перераспределением. Между тем, если внимательно рассмотреть возможные процессы, протекающие в окружающем нас мире, а также проводимые нами самими, окажется, что их можно разбить на две существенно различающиеся группы - самопроизвольные и несамопроизвольные процессы.
Самопроизвольные процессы ведут систему к состоянию равновесия, в котором силы, вызывающие процессы, уравновешиваются. Например, выравниваются давление, температура, концентрация и т.д.
Выводы.
Таким образом, равновесный и обратимый цикл Карно объединяет два процесса: сам собой идущий, самопроизвольный процесс перехода теплоты Q2 от нагревателя к холодильнику и сам собой не идущий, несамопроизвольный процесс превращения теплоты (Q1-Q2) в работу. Этот последний, несамопроизвольный процесс происходит за счёт объединённого с ним самопроизвольного процесса, компенсируется им. Т.о., в равновесном процессе имеет место компенсация несамопроизвольного отрицательного процесса самопроизвольным положительным.
Следовательно, единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретого тела к более нагретому (постулат Клаузиуса). Или так: единственным результатом любой совокупности процессов не может быть превращение теплоты в работу (т.е. поглощение системой теплоты из окружающей среды и отдача эквивалентной этой теплоте работы). Т.о., самопроизвольный процесс превращения работы в теплоту (путём трения), так же, как и самопроизвольный процесс теплопроводности, необратимы. Последнее утверждение может быть изменено иначе: теплота наиболее холодного тела из участвующих в круговом процессе не может служить источником работы (постулат Томсона).
Оба изложенных положения (постулаты Клаузиуса и Томсона) являются формулировками второго закона термодинамики и эквивалентны друг другу.
 Постулаты Клаузиуса и Томсона можно объединить в один, согласно которому единственным результатом цикла не может быть отрицательный процесс (сравнить с циклом Карно) - это тоже формулировка второго закона термодинамики.
Постулаты Клаузиуса и Томсона можно объединить в один, согласно которому единственным результатом цикла не может быть отрицательный процесс (сравнить с циклом Карно) - это тоже формулировка второго закона термодинамики.
Энтропия
Как классические формулировки второго закона термодинамики, так и принцип адиабатической недостижимости Каратеодори ведут к установлению важнейшего свойства системы - энтропии.
Из уравнения  следует, что
следует, что  или
или
 Отношение
Отношение  (поглощённой системой теплоты к температуре) называется приведённой теплотой. Уравнение (16) показывает, что алгебраическая сумма приведённых теплот по обратимому циклу Карно равна 0. Для бесконечно малого обратимого цикла Карно
(поглощённой системой теплоты к температуре) называется приведённой теплотой. Уравнение (16) показывает, что алгебраическая сумма приведённых теплот по обратимому циклу Карно равна 0. Для бесконечно малого обратимого цикла Карно  где
где  - элементарная приведённая теплота. Любой цикл может быть заменён совокупностью бесконечно малых циклов Карно, поэтому, для любого обратимого цикла
- элементарная приведённая теплота. Любой цикл может быть заменён совокупностью бесконечно малых циклов Карно, поэтому, для любого обратимого цикла 
 Суммируем все бесконечно малые циклы. Посколькуи
Суммируем все бесконечно малые циклы. Посколькуи  и
и  ,то
,то
 - алгебраическая сумма всех приведённых теплот по обратимому циклу. Для необратимого цикла Карно, согласно одной из теорем Карно-Клаузиуса
- алгебраическая сумма всех приведённых теплот по обратимому циклу. Для необратимого цикла Карно, согласно одной из теорем Карно-Клаузиуса  , и, следовательно,
, и, следовательно,  и для любого необратимого цикла
и для любого необратимого цикла  (17)
(17)

 Выражение (17) носит название неравенства Клаузиуса. Интеграл по контуру можно разбить на два интеграла, например,
Выражение (17) носит название неравенства Клаузиуса. Интеграл по контуру можно разбить на два интеграла, например,
или
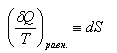 Следовательно, сумма приведённых теплот (интеграл элементарных приведённых теплот) при переходе системы равновесным путём из состояния (1) в состояние (2) не зависит от пути процесса, а только от начального (1) и конечного (2) состояний. Т.о., интеграл элементарных приведённых теплот в равновесном процессе равен приросту некоторой функции состояния системы (S):
Следовательно, сумма приведённых теплот (интеграл элементарных приведённых теплот) при переходе системы равновесным путём из состояния (1) в состояние (2) не зависит от пути процесса, а только от начального (1) и конечного (2) состояний. Т.о., интеграл элементарных приведённых теплот в равновесном процессе равен приросту некоторой функции состояния системы (S):
 а подинтегральное выражение есть дифференциал функции S:
а подинтегральное выражение есть дифференциал функции S:
Полученные выражения являются определениями функции S, которая называется энтропией.
Энтропия системы есть функция состояния системы: её изменение равно сумме приведённых теплот, поглощённых системой в равновесном процессе. Энтропия является однозначной, непрерывной и конечной функцией состояния.
Энтропия измеряется в т.н. энтропийных единицах, в тех же, что и теплоёмкость, т.е. кал/град·моль.
В общем случае для равновесных и неравновесных процессов получаем 
В том случае, когда отсутствует теплообмен между системой и окружающей средой  , т.е. система является изолированной, уравнение принимает вид
, т.е. система является изолированной, уравнение принимает вид 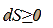
Таким образом, энтропия изолированной системы постоянна в равновесных процессах и возрастает в неравновесных. Исследуя энтропию, очевидно, можно предсказывать направление процесса. Если в изолированной системе для какого-либо процесса энтропия возрастает, то процесс возможен (может протекать самопроизвольно); если энтропия изолированной согласно расчёту должна убывать, то процесс невозможен (отрицателен). При постоянстве энтропии процесс равновесен, система бесконечно близка к равновесию.
 Признаком равновесия в изолированной системе является максимальное значение энтропии при постоянных внутренней энергии и объёме системы, т.е.
Признаком равновесия в изолированной системе является максимальное значение энтропии при постоянных внутренней энергии и объёме системы, т.е.
Здесь условие максимума рассматривается по отношению к энтропии как функции каких-либо переменных (за исключением U и V, которые постоянны по условию). Такими переменными являются, например, давление пара над жидкостью, концентрации в растворе и др.
Билеты № 7,31,34.Постулат Планка. Абсолютные значения энтропии.
Постулат Планка. Абсолютные значения энтропии
По приведённым выше уравнениям невозможно вычислить абсолютные значения энтропии системы. Такую возможность даёт новое, недоказуемое положение, не вытекающее из двух законов термодинамики, которое было сформулировано Планком:
Энтропия индивидуального кристаллического вещества при абсолютном нуле равна нулю: S0=0
Постулат Планка справедлив только для индивидуальных веществ, кристаллы которых идеально построены (в кристаллической решётке все узлы заняты молекулами или атомами, правильно чередующимися и закономерно ориентированными). Такие кристаллы называются идеально твёрдыми телами. Реальные кристаллы не являются таковыми, т.к. их кристаллическая решётка построена не идеально.
 Энтропия кристаллической решётки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.
Энтропия кристаллической решётки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.
В соответствии с постулатом Планка получаем выражение (18):
Как видно из последнего выражения, если бы теплоёмкость сохраняла конечное значение до абсолютного нуля, то при охлаждении до 0 К подынтегральная функция, а следовательно, и энтропия, должна была бы увеличиваться до бесконечности. Очевидно,S0=0 может иметь место лишь потому, что теплоёмкости кристаллических веществ стремятся, как это установлено экспериментально, к 0 при приближении Т->0K. Теплоёмкость изменяется пропорционально некоторой степени температуры выше первой (для многих кристаллических веществ – пропорционально T3)
Постулат Планка используется при термодинамическом исследовании
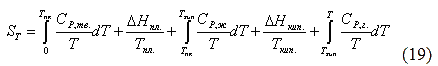 химических процессов для вычисления абсолютных значений энтропий (т.н. абсолютных энтропий) химических соединений - величин, которые имеют большое значение при расчёте химических равновесий. При этом абсолютная энтропия рассчитывается по уравнению (18). Для вычисления необходимо знать экспериментальные значения теплоёмкости, определённые до возможно более низких температур - до 10 К. Значение теплоёмкости до 0 К находят путём экстраполяции.
химических процессов для вычисления абсолютных значений энтропий (т.н. абсолютных энтропий) химических соединений - величин, которые имеют большое значение при расчёте химических равновесий. При этом абсолютная энтропия рассчитывается по уравнению (18). Для вычисления необходимо знать экспериментальные значения теплоёмкости, определённые до возможно более низких температур - до 10 К. Значение теплоёмкости до 0 К находят путём экстраполяции.
Интегральные члены уравнения (19) находят графическим интегрированием. Для этого строят кривые  и численное значение интеграла определяют по величине площади, ограниченной кривой и осью абсцисс, заключёнными между соответствующими температурами:
и численное значение интеграла определяют по величине площади, ограниченной кривой и осью абсцисс, заключёнными между соответствующими температурами:

 Энтропии веществ могут быть найдены и другим методом – путём квантово-статистического расчёта.
Энтропии веществ могут быть найдены и другим методом – путём квантово-статистического расчёта.
Билеты № 4,24,39,47. Применение первого и второго начал термодинамики к химическим системам Изохорно-изотермический и изобарно-изотермический потенциалы.
Теплота и работа.
Изменения форм движения при переходе его от одного тела к другому и соответствующие превращения энергии весьма разнообразны. Формы же перехода движения и связанных с ним переходов энергии могут быть разбиты на две группы:
В первую группу входит только одна форма перехода движения путем хаотических столкновений молекул двух соприкасающихся тел, т.е. путём теплопроводности (и одновременно путём излучения). Мерой передаваемого таким способом движения является теплота.
Теплота есть форма передачи энергии путем неупорядоченного движения молекул.
Во вторую группу включаются различные формы перехода движения, общей чертой которых является перемещение масс, охватывающих очень большие числа молекул (т.е. макроскопических масс), под действием каких-либо сил. Таковы поднятие тел в поле тяготения, переход некоторого количества электричества от большего электростатического потенциала к меньшему, расширение газа, находящегося под давлением и др. Общей мерой передаваемого такими способами движения является работа.
Работа - форма передачи энергии путём упорядоченного движения молекул.
Теплота и работа характеризуют качественно и количественно две различные формы передачи энергии от данной части материального мира к другой. Нельзя говорить, что теплота и работа содержатся в теле. Они являются характеристиками процесса. Характеризуют только процесс. В статических условиях теплота и работа не существуют.
Важное положение: различие между теплотой и работой, принимаемое термодинамикой как исходное положение, и противопоставление теплоты работе имеет смысл только для тел, состоящих из множества молекул, т.к. для одной молекулы или для совокупности немногих молекул понятия теплоты и работы теряют смысл. Поэтому термодинамика рассматривает лишь тела, состоящие из большого числа молекул, т.е. так называемые макроскопические системы.
Основные понятия термодинамики
Термодинамический метод характеризуется тем, что объектом исследования является тело или группа тел, условно выделяемых из материального мира в термодинамическую систему.
Термодинамическая система - тело или совокупность тел, мысленно ограниченных от окружающих систем (тел, среды).
Система является гомогенной, если каждый параметр её имеет во всех частях системы одно и то же значение или непрерывно изменяется от точки к точке. Система является гетерогенной, если она состоит из нескольких макроскопических частей, отделенных одна от другой видимыми поверхностями раздела. Гомогенные части гетерогенной системы, отделённые от остальных частей видимыми поверхностями раздела, называются фазами. Кроме того, системы бывают открытые, закрытые и изолированные.
Открытая система - может обмениваться с окружающей средой веществом и энергией.
Закрытая система - не обменивается с окружающей средой веществом, но энергией обмениваться может.
Изолированная система - система, которая не может обмениваться с окружающей средой веществом и энергией.
Эквивалентность теплоты и работы
Постоянное эквивалентное отношение между теплотой и работой при их взаимных переходах установлено в классических опытах Джоуля. Типичный эксперимент Джоуля заключался в следующем: падающий с известной высоты груз вращает мешалку (А=mgh), погружённую в воду, находящуюся в калориметре. (Груз и калориметр с водой составляет термодинамическую систему). Вращение лопастей мешалки в воде вызывает нагревание воды в калориметре (Q=cΔt), соответствующее повышение температуры количественно фиксируется. После того, как указанный процесс закончен, система должна быть приведена к исходному состоянию.
Это можно сделать путём мысленного опыта. Груз поднимается на исходную высоту, при этом затрачивается извне работа, которая увеличивает энергию системы. Кроме того, от калориметра отнимается (передаётся в окружающую среду) теплота путём охлаждения его до исходной температуры. Эти операции возвращают систему к исходному состоянию, т.е. все измеримые свойства системы приобретают те же значения, которые они имели в исходном состоянии. Процесс, в течение которого система изменяла, свои свойства и в конце которого вернулась к исходному состоянию, называется круговым (циклическим) процессом или просто циклом.
Единственным результатом описанного цикла является отнятие работы от среды, окружающей систему, и переход в эту среду теплоты, взятой у калориметра.
Сравнение двух величин (работы и теплоты) показывает постоянное отношение между ними, не зависящее от величины груза, размеров калориметра и конкретных количеств теплоты и работы в разных опытах.
Теплоту и работу в циклическом процессе целесообразно записать как сумму (интеграл) бесконечно малых (элементарных) теплот δQ и бесконечно малых (элементарных) работ δA, 

,где J - коэффициент пропорциональности, называемый механическим эквивалентом теплоты. Это уравнение выражает собой закон сохранения энергии для частного случая превращения работы в теплоту.
В общем случае рассмотрим следующий цикл:
В общем случае J можно опустить, выразив А и Q с помощью J в одних и тех же единицах. Но путь II можно проводить какими угодно способами

.
Можем записать, что
А 1- А 2=Q1-Q2, A1-A3=Q1-Q3, A1 –A4 =Q1 –Q4,
A1-Ai =Q1 –Qi, i=2,3,
Q1-A1=Q2 –A2, Q1-A1=Q3-A3,
Q1-A1=Q4 –A4,, следовательно,
Q1-A1 =Q2-A2 =Q3-A3 =...=Qi-Ai =const
Таким образом, величина "const" характеризует свойства системы. Эта разность зависит только от начального и конечного значений пути перехода системы из одного состояния в другое. Она не зависит от того, каким путём система переходит из одного состояния в другое. Если она характеризует состояние системы, то она является функцией состояния. Назовём её внутренней энергией U. Тогда
Q - A = const = U 2– U 1=Δ U или
Q = A +Δ U
Теплота, подведённая к системе, расходуется на работу, совершаемую системой и на изменение внутренней энергии системы (для нециклического процесса). Это одна из формулировок I -го начала термодинамики.
Приведенное выше выражение можно переписать так:
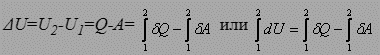
т.к. для циклического процесса  , то
, то  ,отсюда вывод:
,отсюда вывод:
В циклическом процессе внутренняя энергия системы не изменяется:  , следовательно, U=const
, следовательно, U=const
Предположим, что это условие не выполняется. Тогда, очевидно, циклический процесс можно провести так, что после того, как система вернулась к исходному состоянию, внутренняя энергия системы не приняла начального значения, а увеличилась. В этом случае повторение круговых процессов вызвало бы накопление энергии в системе. Создалась бы возможность превращения этой энергии в работу и получения таким путём работы не за счет теплоты, а из "ничего", т.к. в круговом (циклическом) процессе работа и теплота эквивалентны друг другу, что показано прямыми опытами.
Вторая формулировка первого начала термодинамики: (вероятно, не нужно, но пусть будет)
Невозможно построить вечный двигатель первого рода, дающий работу без затраты эквивалентного количества другого вида энергии.
 Полный запас внутренней энергии системы в результате циклического процесса возвращается к исходному значению, т.е. внутренняя энергия системы, находящейся в данном состоянии, имеет одно определённое значение и не зависит от того, каким изменениям система подвергалась перед тем, как прийти к данному состоянию. Иными словами, внутренняя энергия системы есть однозначная, непрерывная и конечная функция состояния системы. Физически (в отличие от разобранного выше термодинамического понятия) под внутренней энергией понимается величина, которая характеризует общий запас энергии системы, включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергию вращения электронов в атомах, энергию, заключающуюся в ядрах атомов, и другие виды энергии, но без учёта кинетической энергии тела в целом и его потенциальной энергии положения. В настоящее время пока не имеется возможности определить абсолютную величину внутренней энергии какой-нибудь системы, т.к. неизвестным остаётся значение U (при Т=0К)
Полный запас внутренней энергии системы в результате циклического процесса возвращается к исходному значению, т.е. внутренняя энергия системы, находящейся в данном состоянии, имеет одно определённое значение и не зависит от того, каким изменениям система подвергалась перед тем, как прийти к данному состоянию. Иными словами, внутренняя энергия системы есть однозначная, непрерывная и конечная функция состояния системы. Физически (в отличие от разобранного выше термодинамического понятия) под внутренней энергией понимается величина, которая характеризует общий запас энергии системы, включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергию вращения электронов в атомах, энергию, заключающуюся в ядрах атомов, и другие виды энергии, но без учёта кинетической энергии тела в целом и его потенциальной энергии положения. В настоящее время пока не имеется возможности определить абсолютную величину внутренней энергии какой-нибудь системы, т.к. неизвестным остаётся значение U (при Т=0К)
Билет № 1, 6, 17, 26,40, 44. 1. Аналитические выражения первого начала термодинамики. Калорические коэффициенты.
Ещё одна формулировка I-го начала термодинамики может быть получена из выражения 
 в применении к изолированным системам, в которых δQ=0 и δА=0; следовательно,
в применении к изолированным системам, в которых δQ=0 и δА=0; следовательно,
т.е. "Внутренняя энергия изолированной системы постоянна". Эта формулировка первого закона термодинамики есть применённое к конкретным условиям и конечным системам количественное выражение общего закона сохранения энергии, в соответствии с которым энергия не создаётся и не исчезает. Переписав Q=A+ΔU=ΔU+A в виде -ΔU=-Q+A получим, что убыль внутренней энергии в системе идёт на передачу энергии в форме тепла в окружающую среду и на совершение системой работы против внешних сил.
Вывод: поскольку внутренняя энергия системы есть функция её состояния, т.е. U=f(P,V,T), то прирост внутренней энергии при бесконечно малых изменениях параметров состояния системы есть полный дифференциал функции состояния, т.е.
 Если U=f(V,T), P=const, то
Если U=f(V,T), P=const, то
Отметим, что Q и A не являются функциями состояния, т.к. их прирост зависит от пути процесса.
Для бесконечно малого изменения первое начало термодинамики может быть записано так: 
Понятие изменения внутренней энергии как полного дифференциала позволяет вывести аналитические выражения I-го начала термодинамики.
Внутренняя энергия U есть функция состояния, т.е. U=f(P,V,T), т.е. U функционально связана с параметрами состояния. Но с другой стороны параметры состояния какой-либо фазы системы связаны между собой некоей количественной функциональной зависимостью, называемой уравнением состояния.
f'(V,P,T)=0 => V=f''(P,T); P=f'''(V,T);
Простейшими уравнениями состояния являются уравнения для газов при малых давлениях: уравнение Клапейрона-Менделеева, уравнение Ван-Дер-Ваальса.
1). U=f(P,V,T); в качестве независимых переменных (параметров состояния) выберем V и Т:
U=f'(V,T); 
Запишем первое начало термодинамики и будем подразумевать под элементарной работой δА только механическую работу расширения: δQ=dU+δA=dU+PdV; dA=PdV.


получим первое аналитическое выражение I-го начала термодинамики: δQ= ldV+CvdT
l и С v - калорические коэффициенты, от слова "калория", потому что при их умножении на приращение соответствующих параметров получаем величину теплоты. Калорические коэффициенты переводят параметры состояния системы в тепловые коэффициенты, которые для данной системы легко могут быть измерены.
 Физический смысл l и Сv
Физический смысл l и Сv
- теплота изотермического расширения тела, т.е. так называемая скрытая теплота какого-либо фазового перехода (плавление, сублимация),
с другой стороны
, где Р - внешнее давление,  - внутреннее давление, отражает силу взаимного притяжения молекул.
- внутреннее давление, отражает силу взаимного притяжения молекул. 

 - изохорная теплоёмкость
- изохорная теплоёмкость
- теплота, поглощаемая системой при постоянном объёме, затрачивается полностью на увеличение внутренней энергии системы.
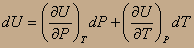
2).U=f(P,T); V=f'(P,T);


dQ=hdP+CPdT – второе аналитич



 Обычно в курсах термодинамики рассматривают три закона: первый, второй и третий - они составляют основу термодинамики. Однако сейчас всё чаще вводят в изложение термодинамики закон термического равновесия, сформулированный Фаулером в 1931 г., т.е. много позже установления основных законов. Новый закон получил название нулевого. Он сформулирован так:
Обычно в курсах термодинамики рассматривают три закона: первый, второй и третий - они составляют основу термодинамики. Однако сейчас всё чаще вводят в изложение термодинамики закон термического равновесия, сформулированный Фаулером в 1931 г., т.е. много позже установления основных законов. Новый закон получил название нулевого. Он сформулирован так: Однако чисто термодинамическое рассмотрение не в состоянии уточнить вид этой функции.
Однако чисто термодинамическое рассмотрение не в состоянии уточнить вид этой функции. ЭТО МАЛО И НЕСЕРЬЕЗНО. НОРМ ИНФА В МЕТОДЧКЕ ЛЕВЧЕНКОВА «1-Е НАЧАЛО ТЕРМОДИНАМИКИ.
ЭТО МАЛО И НЕСЕРЬЕЗНО. НОРМ ИНФА В МЕТОДЧКЕ ЛЕВЧЕНКОВА «1-Е НАЧАЛО ТЕРМОДИНАМИКИ. тепловой эффект процесса не зависит от температуры.
тепловой эффект процесса не зависит от температуры.

 Здесь, как и ранее, ΔHJ - постоянная, которую чаще всего определяют из известного ΔH 298.
Здесь, как и ранее, ΔHJ - постоянная, которую чаще всего определяют из известного ΔH 298. Постулаты Клаузиуса и Томсона можно объединить в один, согласно которому единственным результатом цикла не может быть отрицательный процесс (сравнить с циклом Карно) - это тоже формулировка второго закона термодинамики.
Постулаты Клаузиуса и Томсона можно объединить в один, согласно которому единственным результатом цикла не может быть отрицательный процесс (сравнить с циклом Карно) - это тоже формулировка второго закона термодинамики. следует, что
следует, что  или
или Отношение
Отношение  (поглощённой системой теплоты к температуре) называется приведённой теплотой. Уравнение (16) показывает, что алгебраическая сумма приведённых теплот по обратимому циклу Карно равна 0. Для бесконечно малого обратимого цикла Карно
(поглощённой системой теплоты к температуре) называется приведённой теплотой. Уравнение (16) показывает, что алгебраическая сумма приведённых теплот по обратимому циклу Карно равна 0. Для бесконечно малого обратимого цикла Карно  где
где  - элементарная приведённая теплота. Любой цикл может быть заменён совокупностью бесконечно малых циклов Карно, поэтому, для любого обратимого цикла
- элементарная приведённая теплота. Любой цикл может быть заменён совокупностью бесконечно малых циклов Карно, поэтому, для любого обратимого цикла 
 Суммируем все бесконечно малые циклы. Посколькуи
Суммируем все бесконечно малые циклы. Посколькуи  и
и  ,то
,то - алгебраическая сумма всех приведённых теплот по обратимому циклу. Для необратимого цикла Карно, согласно одной из теорем Карно-Клаузиуса
- алгебраическая сумма всех приведённых теплот по обратимому циклу. Для необратимого цикла Карно, согласно одной из теорем Карно-Клаузиуса  , и, следовательно,
, и, следовательно,  и для любого необратимого цикла
и для любого необратимого цикла  (17)
(17)
 Выражение (17) носит название неравенства Клаузиуса. Интеграл по контуру можно разбить на два интеграла, например,
Выражение (17) носит название неравенства Клаузиуса. Интеграл по контуру можно разбить на два интеграла, например,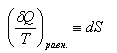 Следовательно, сумма приведённых теплот (интеграл элементарных приведённых теплот) при переходе системы равновесным путём из состояния (1) в состояние (2) не зависит от пути процесса, а только от начального (1) и конечного (2) состояний. Т.о., интеграл элементарных приведённых теплот в равновесном процессе равен приросту некоторой функции состояния системы (S):
Следовательно, сумма приведённых теплот (интеграл элементарных приведённых теплот) при переходе системы равновесным путём из состояния (1) в состояние (2) не зависит от пути процесса, а только от начального (1) и конечного (2) состояний. Т.о., интеграл элементарных приведённых теплот в равновесном процессе равен приросту некоторой функции состояния системы (S): а подинтегральное выражение есть дифференциал функции S:
а подинтегральное выражение есть дифференциал функции S:
 , т.е. система является изолированной, уравнение принимает вид
, т.е. система является изолированной, уравнение принимает вид 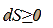
 Признаком равновесия в изолированной системе является максимальное значение энтропии при постоянных внутренней энергии и объёме системы, т.е.
Признаком равновесия в изолированной системе является максимальное значение энтропии при постоянных внутренней энергии и объёме системы, т.е. Энтропия кристаллической решётки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.
Энтропия кристаллической решётки, построенной в некоторой степени беспорядочно, больше энтропии идеально построенной кристаллической решётки. Поэтому реальные кристаллы и при 0 К обладают энтропией, большей нуля. Однако энтропии реальных хорошо образованных кристаллов индивидуальных веществ при абсолютном нуле невелики.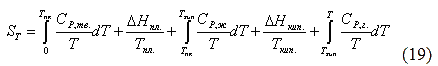 химических процессов для вычисления абсолютных значений энтропий (т.н. абсолютных энтропий) химических соединений - величин, которые имеют большое значение при расчёте химических равновесий. При этом абсолютная энтропия рассчитывается по уравнению (18). Для вычисления необходимо знать экспериментальные значения теплоёмкости, определённые до возможно более низких температур - до 10 К. Значение теплоёмкости до 0 К находят путём экстраполяции.
химических процессов для вычисления абсолютных значений энтропий (т.н. абсолютных энтропий) химических соединений - величин, которые имеют большое значение при расчёте химических равновесий. При этом абсолютная энтропия рассчитывается по уравнению (18). Для вычисления необходимо знать экспериментальные значения теплоёмкости, определённые до возможно более низких температур - до 10 К. Значение теплоёмкости до 0 К находят путём экстраполяции. и численное значение интеграла определяют по величине площади, ограниченной кривой и осью абсцисс, заключёнными между соответствующими температурами:
и численное значение интеграла определяют по величине площади, ограниченной кривой и осью абсцисс, заключёнными между соответствующими температурами:
 Энтропии веществ могут быть найдены и другим методом – путём квантово-статистического расчёта.
Энтропии веществ могут быть найдены и другим методом – путём квантово-статистического расчёта.

 .
.
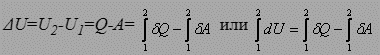
 , то
, то  ,отсюда вывод:
,отсюда вывод:  , следовательно, U=const
, следовательно, U=const Полный запас внутренней энергии системы в результате циклического процесса возвращается к исходному значению, т.е. внутренняя энергия системы, находящейся в данном состоянии, имеет одно определённое значение и не зависит от того, каким изменениям система подвергалась перед тем, как прийти к данному состоянию. Иными словами, внутренняя энергия системы есть однозначная, непрерывная и конечная функция состояния системы. Физически (в отличие от разобранного выше термодинамического понятия) под внутренней энергией понимается величина, которая характеризует общий запас энергии системы, включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергию вращения электронов в атомах, энергию, заключающуюся в ядрах атомов, и другие виды энергии, но без учёта кинетической энергии тела в целом и его потенциальной энергии положения. В настоящее время пока не имеется возможности определить абсолютную величину внутренней энергии какой-нибудь системы, т.к. неизвестным остаётся значение U (при Т=0К)
Полный запас внутренней энергии системы в результате циклического процесса возвращается к исходному значению, т.е. внутренняя энергия системы, находящейся в данном состоянии, имеет одно определённое значение и не зависит от того, каким изменениям система подвергалась перед тем, как прийти к данному состоянию. Иными словами, внутренняя энергия системы есть однозначная, непрерывная и конечная функция состояния системы. Физически (в отличие от разобранного выше термодинамического понятия) под внутренней энергией понимается величина, которая характеризует общий запас энергии системы, включая энергию поступательного и вращательного движения молекул, энергию внутримолекулярного колебательного движения атомов и атомных групп, составляющих молекулы, энергию вращения электронов в атомах, энергию, заключающуюся в ядрах атомов, и другие виды энергии, но без учёта кинетической энергии тела в целом и его потенциальной энергии положения. В настоящее время пока не имеется возможности определить абсолютную величину внутренней энергии какой-нибудь системы, т.к. неизвестным остаётся значение U (при Т=0К)
 в применении к изолированным системам, в которых δQ=0 и δА=0; следовательно,
в применении к изолированным системам, в которых δQ=0 и δА=0; следовательно, Если U=f(V,T), P=const, то
Если U=f(V,T), P=const, то



 Физический смысл l и Сv
Физический смысл l и Сv - внутреннее давление, отражает силу взаимного притяжения молекул.
- внутреннее давление, отражает силу взаимного притяжения молекул. 

 - изохорная теплоёмкость
- изохорная теплоёмкость