Молекулы могут отличаться друг от друга положением в пространстве (координаты) и запасом энергии (импульс p=mv).
Фазовое пространство. Например, состояние одноатомной молекулы, у которой число степеней свободы n=3 определяется в данный момент шестью координатами – пространственными x,y,z и тремя компонентами импульса px, py, pz. Это мгновенное состояние молекулы соответствует точке в шестимерном фазовом пространстве.
Если координаты группы молекулы Ni лежат в пределах от x до x + dx, от y до y + dy, от z до z +dz, а компоненты импульса в пределах px до px+dpx, py до py+dpy, pz до pz+dpz, то молекулы занимают фазовую ячейку объема dxdydzdpxdpydpz.
Фазовые пространства разбиваются на фазовые ячейки. Число молекул в каждой ячейке N1N2……..Nk. Состояние многоатомной молекулы с n степенями свободы определяется n пространственными координатами и n координатами импульсов. При этом мгновенное состояние молекулы характеризуется точкой в двумерном фазовом пространстве.
При рассмотрении молекул идеального газа пользуются статистикой Больцмана, согласно которой:
1. Все размещения молекул в фазовом пространстве равновероятны.
2.Данное распределение молекул по фазовым ячейкам образует данное макросостояние.
3. Перемещение молекул внутри ячейки не образует нового микросостояния.
4. Перестановка двух молекул в двух ячейках соответствует новому микросостоянию.
 Пример: если из N молекул системы, имеющей объём V, в одну половину этого объёма попадают N1, в другую N2 =N-N1 молекул, то число возможных распределений различимых молекул, отвечающих указанному суммарному распределению между двумя половинами объёма (число микросостояний, определяющих данное макросостояние, т.е. термодинамическая вероятность W) определяются формулой:
Пример: если из N молекул системы, имеющей объём V, в одну половину этого объёма попадают N1, в другую N2 =N-N1 молекул, то число возможных распределений различимых молекул, отвечающих указанному суммарному распределению между двумя половинами объёма (число микросостояний, определяющих данное макросостояние, т.е. термодинамическая вероятность W) определяются формулой:
Предположим,в системе всего 4 молекулы:Возможен только один вариант такого макросостояния.
 Возможен только один вариант такого макросостояния.
Возможен только один вариант такого макросостояния.
 Возможны 4 варианта (4 микросостояния), определяющих данное макросостояние.
Возможны 4 варианта (4 микросостояния), определяющих данное макросостояние.

Указанные числа W1, W2, W3 т.о. показывают, какой из случаев обладает большей вероятностью реализации.
Аналогичные расчёты для материальных систем, состоящих из очень большого числа молекул, показывают, что наиболее вероятно распределение молекул, а даже относительно небольшие отклонения от равномерного распределения (в значительных участках объёма) хоть и возможны, но имеют крайне малую вероятность. Так, математическая вероятность того, что в 1мм3 газа плотность (определяемая числом молекул в единице объёма) будет отличаться от средней в 1см3 этого газа на 0,01%, равна 10-60, т.е. исчезающе мала. Однако в объёме 0,2·10-12см3, отклонение плотности на 1% происходит каждые 10-9с, т.е. очень часто.
Выводы: всякие, хотя бы очень малые местные отклонения от средней величины плотности газа, бывшей до этого равномерной, являются самопроизвольными отрицательными процессами, которые, т.о. не только оказываются возможными, но и повсеместно осуществляются. Значительные отклонения от средних величин в больших системах имеют исчезающе малую вероятность, но в принципе они также возможны.
Таким образом, утверждение, по которому несамопроизвольные (отрицательные) процессы не могут быть единственным результатом совокупности процессов, оказывается нестрогим, а отрицательные процессы в макроскопических системах оказываются не невозможными, а крайне мало вероятными событиями. Второй закон термодинамики является, следовательно, не абсолютным законом природы, подобно первому закону, а статистически ограниченным законом, который соблюдается с высокой степенью точности для значительных количеств молекул и тем менее применим, чем меньше размеры системы, являющейся объектом изучения.
В работах Больцмана, Смолуховского и других учёных показан статистический характер второго закона термодинамики и количественно изучены наблюдаемые отклонения от этого закона. Результаты этих работ еще раз показали несостоятельность идеи тепловой смерти Вселенной, высказанной Клаузиусом. (Тепловая смерть)
Рассмотрим теперь связь между энтропией системы и вероятностью состояния этой системы. Исходя из изложенных выше представлений, количественной мерой неупорядоченности является термодинамическая вероятность или число микросостояний. С этой точки зрения изменения, происходящие в системе в связи с поглощением теплоты - нагревом, плавлением, испарением и т.д., также можно рассматривать, как связанные с увеличением W, т.е. увеличением числа микросостояний, соответствующих макросостоянию, например, жидкости по сравнению с кристаллом. Т.е. термодинамическая вероятность состояния W и энтропия изолированной системы S являются различными мерами стремления системы к равновесию. Обе величины возрастают при необратимых процессах, приближающих систему к равновесию, и достигают максимума при равновесном состоянии системы. Между величинами W и S имеется количественная связь. Общий вид этой связи нетрудно установить, если учесть аддитивность энтропии, которая является суммой энтропий отдельных частей равновесной системы, и мультипликативность вероятности сложного события, которая является произведением вероятностей отдельных независимых событий.
Если равновесная система с вероятностью W и энтропией S состоит из двух частей с вероятностями W1 и W2 и энтропиями S1 и S2, то S= S1+ S2; W= W1 W2;
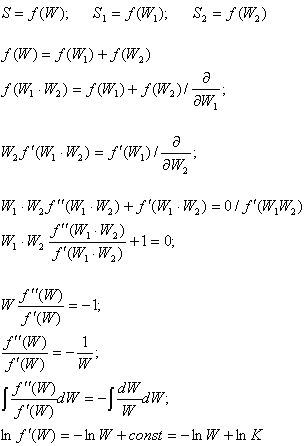 В данном случае К - это какая-то определённая константа интегрирования. Т.к. при равенстве логарифмов равны и подлогарифмические выражения, можем также записать:
В данном случае К - это какая-то определённая константа интегрирования. Т.к. при равенстве логарифмов равны и подлогарифмические выражения, можем также записать:  или, умножая на dW и ещё раз интегрируя, получаем:
или, умножая на dW и ещё раз интегрируя, получаем: 
Равенство const=0 вводится условно и называется постулатом Больцмана. Окончательно получаем, что
S=KlnW
Впервые именно в таком виде оно написано М. Планком в 1900г. Это уравнение лежит в основе статистической термодинамики.
Изложенные выше соображения об идеальном кристалле могут быть выражены на языке вероятностей через соотношение W0=1.
 Действительно, идеальный кристалл при Т=0 К может быть осуществлён только одним распределением молекул, т.к. обмен молекул местами невозможен. Следовательно, для него S0=0.
Действительно, идеальный кристалл при Т=0 К может быть осуществлён только одним распределением молекул, т.к. обмен молекул местами невозможен. Следовательно, для него S0=0.
Билеты 5,25,48.Методы расчета энтропии. НЕ УВЕРЕНА ЧТО ТО



 Пример: если из N молекул системы, имеющей объём V, в одну половину этого объёма попадают N1, в другую N2 =N-N1 молекул, то число возможных распределений различимых молекул, отвечающих указанному суммарному распределению между двумя половинами объёма (число микросостояний, определяющих данное макросостояние, т.е. термодинамическая вероятность W) определяются формулой:
Пример: если из N молекул системы, имеющей объём V, в одну половину этого объёма попадают N1, в другую N2 =N-N1 молекул, то число возможных распределений различимых молекул, отвечающих указанному суммарному распределению между двумя половинами объёма (число микросостояний, определяющих данное макросостояние, т.е. термодинамическая вероятность W) определяются формулой: Возможен только один вариант такого макросостояния.
Возможен только один вариант такого макросостояния. Возможны 4 варианта (4 микросостояния), определяющих данное макросостояние.
Возможны 4 варианта (4 микросостояния), определяющих данное макросостояние.
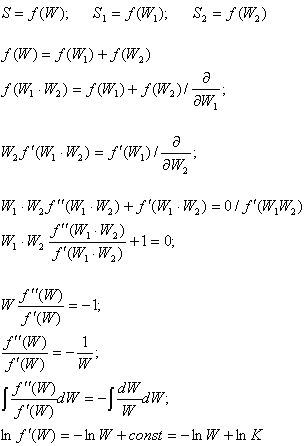 В данном случае К - это какая-то определённая константа интегрирования. Т.к. при равенстве логарифмов равны и подлогарифмические выражения, можем также записать:
В данном случае К - это какая-то определённая константа интегрирования. Т.к. при равенстве логарифмов равны и подлогарифмические выражения, можем также записать:  или, умножая на dW и ещё раз интегрируя, получаем:
или, умножая на dW и ещё раз интегрируя, получаем: 
 Действительно, идеальный кристалл при Т=0 К может быть осуществлён только одним распределением молекул, т.к. обмен молекул местами невозможен. Следовательно, для него S0=0.
Действительно, идеальный кристалл при Т=0 К может быть осуществлён только одним распределением молекул, т.к. обмен молекул местами невозможен. Следовательно, для него S0=0.
