Государственное регулирование отношений, возникающих в сфере обращения лекарственных средств, осуществляется федеральным органом исполнительной власти и органами исполнительной власти субъектов Российской Федерации, в компетенцию которых входит осуществление государственного контроля качества, эффективности, безопасности лекарственных средств, федеральным органом исполнительной власти и органами исполнительной власти субъектов Российской Федерации в сфере здравоохранения и сельского хозяйства (рисунок 15).
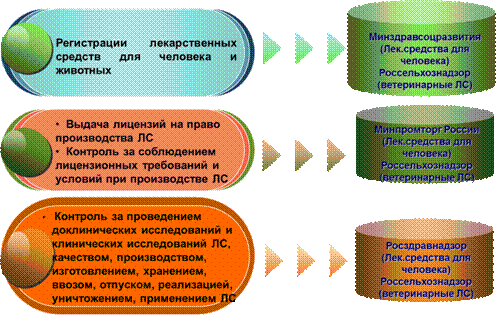
Рис. 15 - Распределение полномочий федеральных органов исполнительной власти
Производство и изготовление лекарственных средств
Производство лекарственных средств осуществляется предприятиями - производителями лекарственных средств, имеющими лицензии на производство лекарственных средств в соответствии с правилами организации производства и контроля качества лекарственных средств (GMP) – ГОСТ Р 52249-2009 (рисунок 16).

Рис. 16 - Требования, предъявляемые к производству лекарственных средств
Стандарт GMP («Good Manufacturing Practice», Надлежащая производственная практика) — система норм, правил и указаний в отношении производства лекарственных средств, медицинских устройств, изделий диагностического назначения, активных ингредиентов.
История GMP начинается с 1963 года в США, где были разработаны специальные правила, регламентирующие условия качественного и безопасного производства лекарств - стандарт GMP, в которые впоследствии вносились дополнения (в 1965, 1971, 1978, 1987, 1992 годах).
Правила GMP являются составной частью системы обеспечения качества, гарантирующей, что производство и контроль осуществляются на предприятии согласно требованиям соответствующей документации. Правила GMP позволяют свести к минимуму риск производственных ошибок, которые не могут быть устранены или предотвращены только посредством контроля качества готового продукта. Наиболее часто встречаются ошибки двух типов:
- перекрестная контаминация;
- смешивание и/или перепутывание готовых продуктов.
Правила GMP предусматривают:
- четкую регламентацию всех производственных процессов и контроля процесса для подтверждения его пригодности для выпуска готовых лекарственных средств требуемого качества;
- проведение валидации всех стадий производства, которые могут оказывать влияние на качество продуктов и всех существенных изменений в нем;
- обеспеченность производства должным образом обученным и квалифицированным персоналом, необходимыми помещениями, соответствующим оборудованием и обслуживанием, сырьем, вспомогательными, упаковочными и маркировочными материалами необходимого качества, а также хранение сырья и материалов в соответствующих условиях и надлежащая транспортировка;
- наличие написанных четко и однозначно технологических регламентов и инструкций для каждого конкретного производства;
- обучение персонала надлежащему выполнению технологических операций;
- регистрацию всех этапов производства, подтверждающую, что все требуемые по регламенту операции были выполнены, а полученные продукты по количеству и качеству соответствуют установленным требованиям. Все отклонения должны быть тщательно зарегистрированы и изучены;
- хранение текущей производственной документации (отчетов о серии, маршрутных карт и др.), включая документацию по реализации готового продукта, что делает возможным в течение определенного времени проследить прохождение каждой серии продукции, в доступной форме в определенном месте;
- хранение и реализацию готового продукта таким образом, чтобы свести к минимуму возможность риска снижения качества;
- порядок возврата при необходимости любой серии готового лекарственного средства на стадии продажи или поставки с последующим анализом причин нарушения его качества и для предупреждения повторения выявленных недостатков.
Процесс производства
Технологический процесс должен осуществляться в соответствии с технологическим регламентом с целью обеспечения выпуска готового продукта, соответствующего всем требованиям нормативной документации. Особое внимание следует уделять вопросам модернизации и совершенствования процесса производства.
Операции технологического процесса должны выполняться и контролироваться квалифицированным персоналом с использованием необходимого оборудования и приборов в специально предназначенных для этих целей помещениях.
Все виды обработки и использования сырья, вспомогательных, упаковочных и маркировочных материалов, полупродуктов и готового продукта, включая приемку, карантин, отбор и анализ проб, хранение, маркировку и упаковку, должны осуществляться и регистрироваться в соответствии с письменными инструкциями и стандартами предприятия. Любые изменения в технологическом процессе должны вводиться и регистрироваться в установленном на предприятии порядке. Любые отклонения в ходе проведения производственных операций должны регистрироваться.
Условия проведения технологического процесса должны обеспечивать:
- создание поточности технологического процесса;
- согласованность, безопасность и безаварийность работы всего технологического оборудования и оптимальную его загрузку;
- исключение или сведение к минимуму контактов работающего персонала с сырьем, вспомогательными материалами, материалами первичной упаковки и готовым продуктом в процессе обслуживания оборудования и при выполнении производственных операций;
- строгое документирование всех стадий технологического процесса, включая составление материального баланса;
- переработку образующихся отходов;
- автоматизацию и компьютеризацию технологических процессов, механизацию вспомогательных и погрузочно-разгрузочных работ.
Личная гигиена персонала
На каждом фармацевтическом предприятии должна быть составлена подробная программа по гигиене, включающая правила соблюдения персоналом личной гигиены, правила гигиены труда и правила использования и ношения технологической одежды. Эти правила должны быть понятны каждому сотруднику и точно соблюдаться.
При поступлении на работу персонал должен пройти медицинское обследование. Весь персонал, занятый непосредственно на производстве, включая временно работающих, должен проходить регулярные медицинские осмотры. Персонал, осуществляющий визуальный контроль, должен проходить регулярные осмотры врачами-окулистами.
К работе, связанной с изготовлением, контролем или хранением лекарственных средств, не должны допускаться носители патогенной микрофлоры и люди, страдающие аллергическими и кожными заболеваниями. Временно, до нормализации состояния здоровья, к работе не должны допускаться больные инфекционными заболеваниями или сотрудники, имеющие повреждения кожи различной степени.
Персонал, занятый в процессе производства лекарственных средств, должен строго соблюдать инструкции, регламентирующие состояние здоровья и требования личной гигиены.
Персонал должен ставить в известность своего руководителя о любых недомоганиях (кожные, острые респираторные и другие заболевания), способных оказать нежелательное воздействие на качество лекарственных средств.
Персонал не должен прикасаться руками к исходному сырью, вспомогательным материалам, материалам первичной упаковки, полупродуктам и, кроме того, к некоторым частям оборудования, если это не предусмотрено действующей технологической документацией.
Запрещается принимать пищу, пить, курить, а также хранить еду, курительные материалы и личные лекарства в производственных помещениях и на складах.
Все люди, входящие в производственные помещения, независимо от того, временно или постоянно они работают, а также посетители и инспектора должны строго соблюдать правила личной гигиены, включая ношение защитной одежды.
Оборудование
Общие положения
Оборудование, используемое для производства и контроля качества лекарственных средств, должно конструироваться и размещаться так, чтобы максимально облегчить его подготовку к работе, эксплуатацию и обслуживание.
Вид, размер и характеристики оборудования и контрольно-измерительных приборов должны соответствовать проводимым технологическим процессам.
Весы и измерительные приборы, используемые для изготовления лекарственных средств и контроля их качества, периодически должны подвергаться калибровке и поверке общепринятыми методами.
При производстве, упаковке, хранении, транспортировке и контроле качества продукции целесообразно использование компьютерной техники.
Конструкция оборудования
К конструкции оборудования предъявляются следующие требования:
- поверхности оборудования, соприкасающиеся с исходным сырьем, полупродуктами или готовым продуктом, должны быть гладкими и изготовленными из нетоксичного, стойкого к коррозии материала, который не реагирует с используемым сырьем или материалами и выдерживает обработку дезинфицирующими средствами и/или стерилизацию;
- все детали оборудования, контактирующие с используемыми сырьем, материалами и полупродуктами, должны быть съемными для облегчения их мойки, обработки дезинфицирующими средствами или стерилизации;
- оборудование не должно загрязняться материалами, используемыми для его эксплуатации (например, смазочными веществами) во избежание ухудшения качества и загрязнения готовых продуктов;
- все передающие устройства (транспортеры, цепные передачи, приводы трансмиссии) должны быть закрыты или отгорожены;
- бункеры, емкости и аналогичное оборудование должны быть закрыты.
Размещение оборудования
Оборудование должно быть размещено таким образом, чтобы:
- оптимизировать потоки исходного сырья, материалов и свести к минимуму перемещение персонала;
- предотвратить возможность загрязнения лекарственных средств в процессе их производства;
- предотвратить риск смешивания разных продуктов или исключения какой-либо из стадий производственного процесса;
- облегчить мойку, обработку, эксплуатацию и обслуживание оборудования.
Неисправное оборудование должно быть удалено из производственных помещений и помещений отдела контроля качества или, в крайнем случае, должно быть отделено и четко соответствующим образом промаркировано до его удаления из помещения.
Подготовка к работе и эксплуатация оборудования
Подготовку оборудования к работе следует проводить согласно инструкциям по мойке и обработке дезинфицирующими средствами или по его стерилизации.
После обработки оборудования дезинфицирующими средствами или стерилизации рабочих деталей необходимо проводить контроль качества подготовки оборудования к работе в соответствии с инструкциями. Результаты контроля качества подготовки оборудования к работе, а также результаты проведения профилактических осмотров оборудования и текущего ремонта должны быть зафиксированы в специальном журнале.
Оборудование, используемое для производства только одного вида лекарственного средства, должно очищаться таким образом, чтобы не допустить смешивания различных серий продукта.
Оборудование, используемое для производства лекарственных средств нескольких наименований, должно тщательно очищаться до полного отсутствия в промывных водах следов лекарственных веществ, входящих в состав ранее изготовленного лекарственного средства. Перед производством лекарственного средства последующего наименования оборудование должно при необходимости обрабатываться дезинфицирующими средствами или стерилизоваться.
Приспособления и материалы, используемые для обработки производственного оборудования, должны выбираться и использоваться таким образом, чтобы они сами не являлись источником загрязнения.
Документация
Документы на предприятии разделяются по типу (рисунок 17):
1) Внешние и внутренние документы:
Внешние документы издаются или утверждаются законодательными или административными органами и имеют обязательное или рекомендательное действие для предприятия и должны учитываться при разработке внутренних документов.
2) Нормативные и регистрационные документы:
Нормативные документы задают правила и требования для выполнения различных процессов и процедур и создаются до начала выполнения процедуры.
Регистрационные документы (записи) создаются на основе разработанных бланков и шаблонов (заполняемых форм) в процессе или сразу после окончания работы и отражают ход выполнения различных процедур (например, изготовление и контроль продукта и т.п.).

Рис. 17 – Типичная схема документации на фармацевтическом предприятии
Внутренняя документация должна быть тщательно разработана, составлена, проверена, утверждена и распределена. Она должна отвечать соответствующим положениям производства и реализации готового продукта.
Содержание документов должно быть однозначным и не иметь двойного толкования. Они должны быть доступными и легко контролируемыми. Копии документов должны быть четкими и разборчивыми.
Отдельные документы относительно производства каждого продукта должны регулярно пересматриваться с указанием даты пересмотра. Если документ был пересмотрен, необходимо исключить ошибочное применение старой редакции.
Основными документами, которые должны использоваться в процессе производства, являются:
- технологические регламенты;
- инструкции или СОП (стандартные операционные процедуры);
- производственные регистрационные записи;
- аналитические методики, спецификации качества и другие стандарты предприятия.
Управление качеством
Под управлением качеством (Quality Management) в фармацевтической промышленности понимают обеспечение надлежащего производства и контроля качества на всех этапах процесса производства лекарственных препаратов.
Понятия «Контроль качества» (Quality Control), «Правила правильного производства (GMP)» и «Обеспечение качества» (Quality Assurance) являются взаимосвязанными частями управления качеством.
Обеспечение качества
Обеспечение качества - это широко распространенная концепция, включающая комплекс мероприятий, которые оказывают влияние на качество готового продукта и гарантируют соответствие его требованиям нормативной документации. Система обеспечения качества включает в себя выполнение требований Правил GMP, в том числе и производственный контроль качества, а также другие требования, не включенные в них, а именно, «Правила доклинической оценки безопасности фармакологических средств» («Good Laboratory Practice» - GLP), «Правила проведения клинических испытаний» («Good Clinical Practice» - GCP).
Система обеспечения качества предназначена для того, чтобы фармацевтическое предприятие могло гарантировать, что:
- разработка, испытания и изготовление лекарственных препаратов проведены с учетом требований GLP, GCP и GMP;
- производство обеспечено утвержденными технологическими регламентами и методиками и/или инструкциями, учитывающими требования Правил GMP;
- четко определена ответственность руководящего персонала за качество готового продукта, что должно быть установлено должностными инструкциями;
- контроль качества исходного сырья, вспомогательных, упаковочных и маркировочных материалов проведены на стадиях их изготовления и/или поставки и перед применением в производстве;
- проведена регистрация всех производимых контрольных испытаний сырья, вспомогательных, упаковочных и маркировочных материалов, полупродуктов и готовых продуктов, постадийного контроля процесса производства, калибровки приборов и валидации;
- готовый продукт произведен в соответствии с утвержденными технологическими регламентами;
- реализация готового продукта осуществлена только после получения соответствующего разрешения руководителя отдела контроля качества;
- имеется документация, позволяющая контролировать условия хранения продукта в течение срока годности у производителя, а также при транспортировке и до реализации.
Фармацевтическое предприятие должно нести ответственность за качество выпускаемых им лекарственных средств и гарантировать соответствие их требованиям нормативной документации. Ответственность за производство готовых лекарственных средств необходимого качества возлагается на руководящий персонал и персонал, занятый на всех стадиях производства и контроля, что должно быть определено и зафиксировано в соответствующих нормативных документах предприятия.
Контроль качества
Контроль качества - это часть Правил GMP, посвященная отбору проб, проведению испытаний и выдаче соответствующих документов, гарантирующих, что все необходимые испытания действительно были проведены; что в производстве были использованы сырье, вспомогательные, упаковочные и маркировочные материалы требуемого качества и что готовый продукт был реализован только в том случае, если его качество отвечало требованиям соответствующей нормативной документации.
Каждое фармацевтическое предприятие должно иметь отдел контроля качества (ОКК). ОКК является самостоятельным и независимым структурным подразделением фармацевтического предприятия и возглавляется квалифицированным специалистом с достаточным стажем работы. В своей работе ОКК руководствуется государственными и отраслевыми документами, регламентирующими его деятельность.
Система контроля качества (объекты контроля, контрольные операции и их последовательность, техническое оснащение, методы, средства механизации, автоматизации и компьютеризации контрольных операций) являются неотъемлемой частью производственного процесса.
Библиография
1. Федеральный закон от 12 апреля 2010 г. № 61-ФЗ «Об обращении лекарственных средств».
2. Федеральный закон от 14 мая 1993 г. № 4979-I «О ветеринарии».
3. Федеральный закон «О техническом регулировании» № 184-ФЗ от 27 декабря 2002 г.
4. ГОСТ Р 52249-2009 Правила организации производства и контроля качества лекарственных средств.
5. Государственная Фармакопея Х, ХI, XII.
6. Правила бактериологического исследования кормов, Москва, Утв. Главветупром Министерства сельского хозяйства СССР 10.06.75.
7. НД № 13-5-2/1062 «Ветеринарные препараты. Показатели качества. Требования и нормы», утверждены Начальником Департамента ветеринарии Минсельхозпрода России В.М. Авиловым 17.10.97.
8. GMP: система обеспечения качества и стандарты производства лекарственных средств. Методическое пособие. - Москва 2007.-343 с.
9. Постановление Правительства РФ от 06.07.2012 № 686 «Об утверждении Положения о лицензировании производства лекарственных средств».
10. Нифантьев О.Е., Мешковский А.П., Нифантьев Е.О.. Аббревиатуры, термины и определения в сфере обращения лекарственных средств: Словарь-справочник. – Москва, 2001г. – 252 с.
11. Ляпунова Н.А., Загория В.А., Георгиевского В.П., Безуглой Е.П. Надлежащая производственная практика лекарственных средств. – Киев, 2001 – 472 с.
12. Нифантьев О.Е. Надлежащая производственная практика. В вопросах и ответах. Самоинспекция.- Москва, 2003 – 145 с.
13. Нифантьев О.Е. Надлежащая производственная практика. В вопросах и ответах. Обучение персонала.- Москва 2002 – 160 с.
14. Береговых В.В., Иващенко Н.В., Рудакова И.П., Пятигорская Н.В., Мешковский А.П., Ляпунов Н.А. Управление качеством в фармацевтической промышленности. – Москва, 2004 – 267 с.
15. Береговых В.В., Мешковский А.П. Нормирование фармацевтического производства. Обеспечение качества продукции. – М.: «Ремедиум», 2001 – 527 с.









