| Существование дискретных энергетических уровней атома подтверждается опытом Франка и Герца. Немецкие ученые Джеймс Франк и Густав Герц за экспериментальные исследования дискретности энергетических уровней получили Нобелевскую премию в 1925 г.
В опытах использовалась трубка (рис. 6.9), заполненная парами ртути при давлении р ≈ 1 мм рт. ст. и три электрода: катод, сетка и анод.
Электроны ускорялись разностью потенциалов U между катодом и сеткой. Эту разность потенциалов можно было изменять с помощью потенциометра П. Между сеткой и анодом тормозящее поле 0,5 В (метод задерживающих потенциалов).
Определялась зависимость тока через гальванометр Г от разности потенциалов между катодом и сеткой U. В эксперименте была получена зависимость, изображенная на рис. 6.10. Здесь U = 4,86 В – соответствует первому потенциалу возбуждения
Согласно боровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергии соответствующих стационарных состояний атома.
Из опыта следует, что при увеличении ускоряющего потенциала вплоть до 4,86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь. Дальнейшие максимумы наблюдаются при и.
Ближайшим к основному, невозбужденному состоянию атома ртути является возбужденное состояние, отстоящее по шкале энергий на 4,86 В. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения. При = 4,86 эВ энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального состояния в возбужденное. Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящий потенциал и достигнуть анода. Этим и объясняется резкое падение анодного тока при = 4,86 эВ. При значениях энергии, кратных 4,86, электроны могут испытывать с атомами ртути 2, 3, … неупругих соударения. При этом они полностью теряют свою энергию и не достигают анода, т.е. наблюдается резкое падение анодного тока.
Таким образом, опыт показал, что электроны передают свою энергию атомам ртути порциями, причем 4,86 эВ – наименьшая возможная порция, которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала проверку экспериментом.
Атомы ртути, получившие при соударении с электронами энергию, переходят в возбужденное состояние и должны вернуться в основное, излучая при этом, согласно второму постулату Бора, квант света с частотой. По известному значению можно вычислить длину волны светового кванта:. Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с, что действительно обнаружилось в опытах.
Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора и сделали большой вклад в развитие атомной физики.
|







 Подставляя уравнение для скорости электрона на орбите в предыдущее, получим:
Подставляя уравнение для скорости электрона на орбите в предыдущее, получим: 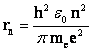 , где n=1,2,3...
, где n=1,2,3...

 или rn~n2.
или rn~n2.


 Знак "-" говорит о том, что между электроном и ядром действуют силы притяжения.
Знак "-" говорит о том, что между электроном и ядром действуют силы притяжения.

 Таким образом, мы пришли к формуле Бальмера,
где
Таким образом, мы пришли к формуле Бальмера,
где  - постоянная Ридберга.
- постоянная Ридберга.
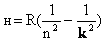



 где rn - радиус n-ой орбиты; v n—скорость электрона на этой орбите; me — масса электрона, п— целое число - номер орбиты или главное квантовое число.
где rn - радиус n-ой орбиты; v n—скорость электрона на этой орбите; me — масса электрона, п— целое число - номер орбиты или главное квантовое число.


 , где п— любое целое число >2, т. е. п= 3, 4, 5 и т.д.
, где п— любое целое число >2, т. е. п= 3, 4, 5 и т.д.
 ,
где п— любое целое число >3, т. е. п=, 4, 5 и т.д.
,
где п— любое целое число >3, т. е. п=, 4, 5 и т.д.
 , где п— любое целое число >1, т. е. п=2, 3, 4, 5 и т.д.
, где п— любое целое число >1, т. е. п=2, 3, 4, 5 и т.д.


 , получим:
, получим: 



