При электролизе водных растворов солей в состав электролита входят, кроме молекул соли, молекулы растворителя – воды, от частичной диссоциации которой в электролите находятся ионы водорода и ионы гидроксила. Выбор электродных реакций в этом случае проводят по определенным правилам. 
Из числа возможных анодных процессов в первую очередь идет процесс с наиболее отрицательным потенциалом. На аноде не окисляются ионы 

 поэтому в их присутствии на нерастворимом аноде идет процесс окисления воды по уравнению:
поэтому в их присутствии на нерастворимом аноде идет процесс окисления воды по уравнению:

При наличии в растворе наряду с  – группой ионов галогенов: ионов хлора, брома и йода, в первую очередь на аноде окисляются простые бескислородные анионы йод, бром, хлор. Их потенциал ниже потенциала окисления иона гидроксила и окисления воды.
– группой ионов галогенов: ионов хлора, брома и йода, в первую очередь на аноде окисляются простые бескислородные анионы йод, бром, хлор. Их потенциал ниже потенциала окисления иона гидроксила и окисления воды.
Из числа возможных катодных процессов в первую очередь идет процесс с наиболее положительным потенциалом. Для катодного восстановления при электролизе водных растворов солей все элементы таблицы стандартных потенциалов можно разделить на три группы:
а) От лития до алюминия. При электролизе из водных растворов на катоде будет выделяться только водород, и проходить реакция:

Металл выделяться не будет, так как потенциал водорода будет более положительным, чем потенциал металл;
б) От титана до водорода. В этом случае электролиза солей этих металлов будет выделяться и металл, и водород, так как их потенциалы близки:

в) Металлы, стоящие ниже водорода. Так как их потенциал более положительный, чем потенциал водорода, то на катоде будет выделяться только металл:

Законы электролиза Фарадея
Между количеством превращенного при электролизе вещества и количеством прошедшего через электролит, электричества существует связь, которая выражена в двух законах Фарадея.
Первый закон Фарадея.

где m – масса превращенного вещества, г;  – химический эквивалент вещества, г/моль; I – сила тока, А; t – время, сек; F – число Фарадея, равное 96500 кулонов или 26,8 а×час.
– химический эквивалент вещества, г/моль; I – сила тока, А; t – время, сек; F – число Фарадея, равное 96500 кулонов или 26,8 а×час.
Второй закон Фарадея. Массы прореагировавших на электродах веществ, при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.

где  – массы веществ, выделившихся на электродах;
– массы веществ, выделившихся на электродах;  – их химические эквиваленты.
– их химические эквиваленты.
Выход по току
Выход вещества по току – это отношение фактически полученного при электролизе количества вещества к теоретическим рассчитанному количеству его:

где  – масса вещества, практически полученная при электролизе, г;
– масса вещества, практически полученная при электролизе, г;  – масса вещества, теоретически рассчитанная по формуле, г.
– масса вещества, теоретически рассчитанная по формуле, г.
Пример 1.
Напишите уравнение процессов, протекающих на графитовых электродах при электролизе водного раствора сернокислого олова.
Ионный состав электролита:
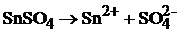
 .
.
Графитовый анод является нерастворимым, поэтому он не будет  участвовать в анодной электродной реакции.
участвовать в анодной электродной реакции. 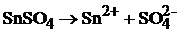
Распределение ионов по электродам будет следующим: к аноду перемещаются анионы 
 и
и  от диссоциации воды. Так как
от диссоциации воды. Так как  на аноде не окисляются, то будет идти выделение кислорода за счет электрохимического окисления воды:
на аноде не окисляются, то будет идти выделение кислорода за счет электрохимического окисления воды:

К катоду будут перемещаться  и
и  . По таблице стандартных потенциалов находим значения потенциалов этих ионов:
. По таблице стандартных потенциалов находим значения потенциалов этих ионов:
 ,
,
 (в нейтральной среде).
(в нейтральной среде).
На катоде, так как потенциалы олова и водорода имеют близкие значения (вторая группа окислителей), будет происходить процесс выделения и олова, и водорода:










 поэтому в их присутствии на нерастворимом аноде идет процесс окисления воды по уравнению:
поэтому в их присутствии на нерастворимом аноде идет процесс окисления воды по уравнению:
 – группой ионов галогенов: ионов хлора, брома и йода, в первую очередь на аноде окисляются простые бескислородные анионы йод, бром, хлор. Их потенциал ниже потенциала окисления иона гидроксила и окисления воды.
– группой ионов галогенов: ионов хлора, брома и йода, в первую очередь на аноде окисляются простые бескислородные анионы йод, бром, хлор. Их потенциал ниже потенциала окисления иона гидроксила и окисления воды.



 – химический эквивалент вещества, г/моль; I – сила тока, А; t – время, сек; F – число Фарадея, равное 96500 кулонов или 26,8 а×час.
– химический эквивалент вещества, г/моль; I – сила тока, А; t – время, сек; F – число Фарадея, равное 96500 кулонов или 26,8 а×час.
 – массы веществ, выделившихся на электродах;
– массы веществ, выделившихся на электродах;  – их химические эквиваленты.
– их химические эквиваленты.
 – масса вещества, практически полученная при электролизе, г;
– масса вещества, практически полученная при электролизе, г;  – масса вещества, теоретически рассчитанная по формуле, г.
– масса вещества, теоретически рассчитанная по формуле, г.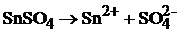
 .
. и
и 
 и
и  . По таблице стандартных потенциалов находим значения потенциалов этих ионов:
. По таблице стандартных потенциалов находим значения потенциалов этих ионов: ,
, (в нейтральной среде).
(в нейтральной среде).




