При записи кинетического уравнения реакции для газообразных систем вместо концентрации (С) пишут давление (Р) реагентов, так как изменение давления в системе аналогично изменению концентрации. Увеличение давления в системе вызывает уменьшение объема системы во столько же раз, при этом концентрация реагентов в единице объема увеличивается так же. При уменьшении давления происходит увеличение объема системы, при этом концентрации в единице объема уменьшится соответственно.
Примеры и решения задач.
Пример 1.
Скорость какой реакции больше, если за единицу времени в единице объема образовалось в результате первой реакции 9г водяного пара, в результате второй реакции – 3,65г хлористого водорода?
Скорость реакции измеряется количеством молей вещества, которое образуется в единице объема за единицу времени. Молярная масса воды  молярная масса хлористого водорода
молярная масса хлористого водорода  тогда скорость первой реакции,
тогда скорость первой реакции,
 моль/л×с,
моль/л×с,
а скорость второй реакции
будет  моль/л.
моль/л.
Скорость образования водяных паров больше, так как число молей образования водяного пара больше, чем число молей образования хлористого водорода.
Пример 2.
Реакция между веществами А и В выражается уравнением: А+2В®С. Начальная концентрация вещества А равна 0,3 моль/л, а вещества В–0,5 моль/л. Константа скорости равна 0,4. Определить скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшается на 0,1 моль/л.
Концентрация вещества А уменьшилась на 0,1 моль/л. Следовательно, исходя из уравнения реакции, концентрация вещества В уменьшилась на 0,2 моль/л, так как перед веществом В стоит коэффициент 2. Тогда концентрация вещества А через некоторое время станет равной 0,3-0,1=0,2 моль/л, а концентрация В – 0,5-0,2=0,3 моль/л.
Определяем скорость реакции:
 моль/л×с
моль/л×с
Пример 3.
Как изменится скорость реакции:  если увеличить концентрацию NO в 3 раза? Согласно закону действующих масс запишем выражение для скорости реакции:
если увеличить концентрацию NO в 3 раза? Согласно закону действующих масс запишем выражение для скорости реакции:
 .
.
При увеличении концентрации NO в 3 раза скорость реакции будет:

Скорость реакции увеличится в 9 раз.
Пример 4.
Определите, как изменится скорость реакции,  если увеличить давление в системе в 2 раза.
если увеличить давление в системе в 2 раза.
Увеличение давления в системе в 2 раза вызовет уменьшение объема системы в 2 раза, при этом концентрации реагирующих веществ возрастут в 2 раза.
Согласно закону действующих масс запишем начальную скорость реакции  и при увеличении давления в 2 раза:
и при увеличении давления в 2 раза:

Тогда
 ,
,  .
.
Скорость реакции увеличится в 8 раз.
Пример 5.
Рассчитайте исходные концентрации веществ А и В в системе А+3В=2С, если равновесные концентрации веществ А равна 0,1 моль/л, веществ В равна 0,2 моль/л, вещества С–0,7 моль/л.
Находим концентрацию вещества А, израсходованную на реакцию, составляя пропорцию по уравнению реакции:
2 моль/л С получено из 1 моль/л А,
0,7 моль/л С ®х моль /л × А.
 моль/л А.
моль/л А.
Следовательно, исходная концентрация вещества А равна: 

 = 0,1 + 0,35 = 0,45 моль/л.
= 0,1 + 0,35 = 0,45 моль/л.
Находим концентрацию вещества В, израсходованную на реакцию.
Составляем пропорцию по уравнению реакции:
2 моль/л С получено из 3 моль/л В
0,7 моль/л С ® х моль/л В
х=  моль/л А.
моль/л А.
Тогда исходная концентрация вещества В равна:

 моль/л.
моль/л.
Пример 6.
При температуре 400 С образовалось 0,5 моль/л вещества А. Сколько моль/л А образуется, если повысить температуру до 800 С? Температурный коэффициент реакции равен 2.
По правилу Вант-Гоффа запишем выражение скорости реакции при 800 С:
 .
.
Подставив в уравнение данные задачи, получим:

При 800 С образуется 8 моль/л вещества А.
Пример 7.
Рассчитайте изменение константы скорости реакции, имеющей энергию активации 191 кДж/моль, при увеличении температуры от 330 до 400 К.
Запишем уравнение Аррениуса для условия задачи:

где R – универсальная газовая постоянная, равная 8,32 Дж/к(К×моль).


откуда изменение константы скорости будет:
 .
.
Контрольные задания
61. Скорость химической реакции
2NO(г) + O2(г) = 2NO2(г)
при концентрациях реагирующих веществ [NO]=0,3 моль/л и [O2]=0,15 моль/л составила 1,2·10-3 моль/(л·с). Найдите значение константы скорости реакции.
62. На сколько градусов следует повысить температуру системы, чтобы скорость протекания в ней реакции возросла в 30 раз (=2,5)?
63. Во сколько раз следует увеличить концентрацию оксида углерода в системе
2СО = СО2+ С,
чтобы скорость реакции увеличилась в 4 раза?
64. Во сколько раз следует увеличить давление, чтобы скорость реакции образования NО2по реакции
2NO + O2= 2NO2
возросла в 1000 раз?
65. Реакция идет согласно уравнению
2NO(г) + Cl2(г) = 2NOCl(г).
Концентрации исходных веществ до начала реакции составляли: [NO]=0,4 моль/л; [Cl2]=0,3 моль/л. Во сколько раз изменится скорость реакции по сравнению с первоначальной в тот момент, когда успеет прореагировать половина оксида азота?
66. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40, если =3,2?
67. Напишите выражение для скорости химической реакции, протекающей в гомогенной системе по уравнению
А+2В=АВ2
и определите, во сколько раз увеличится скорость этой реакции, если:
а) концентрация А уменьшится в 2 раза;
б) концентрация А увеличится в 2 раза;
в) концентрация В увеличится в 2 раза;
г) концентрация обоих веществ увеличится в 2 раза.
68. Во сколько раз следует увеличить концентрацию водорода в системе
N2 + 3H2= 2NН3,
чтобы скорость реакции возросла в 100 раз?
69. Вычислите температурный коэффициент скорости реакции, если константа скорости ее при 100 С составляет 0,0006, а при 150 С 0,072.
70. Реакция между оксидом азота (II) и хлором протекает по уравнению
2NO + Cl2= 2NOCl.
Как изменится скорость реакции при увеличении:
а) концентрации оксида азота в 2 раза;
б) концентрации хлора в 2 раза;
в) концентрации обоих веществ в 2 раза?
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Примеры решения задач
Химическим равновесием называется такое состояние системы, при котором скорости прямой и обратной химических реакций равны, и концентрации реагирующих веществ не изменяются с течением времени.
Количественной характеристикой химического равновесия является константа равновесия. Константа равновесия при постоянной температуре равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов, и является величиной постоянной.
В общем случае для гомогенной реакции mA+ nB«pC+qD
константа равновесия равна:
 .
.
Это уравнение выражаем законом действующих масс для обратимой реакции.
При изменении внешних условий происходит смещение химического равновесия, выражающееся в изменении равновесных концентраций исходных веществ и продуктов реакции. Направление смещения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
Химическое равновесие можно сместить влиянием изменения концентрации реагирующих веществ, температуры, давления.
При увеличении концентрации исходных веществ равновесие сместится в соответствии с принципом Ле-Шателье в сторону продуктов реакции, а при увеличении концентраций продуктов – в сторону исходных веществ.
При изменении температуры (ее увеличении) равновесие смещается в сторону эндотермической реакции (D H > 0), идущей с поглощением тепла, т.е. увеличивается скорость прямой реакции, и равновесие смещается в сторону продуктов реакции. В случае экзотермической реакции (D H > 0), при увеличении температуры увеличится скорость обратной реакции, которая будет обеспечивать поглощение тепла, и равновесие сместится в сторону исходных веществ.
Если в реакции участвуют вещества в газообразном состоянии, то химическое равновесие можно сместить изменением давления. Увеличение давления равносильно увеличено концентрации реагирующих веществ. При увеличении давления равновесие смещается в сторону реакции с меньшим числом молей газообразных веществ, а при уменьшении давления – в сторону реакции с большим числом молей газообразных веществ.
Пример 1.
Рассчитайте исходные концентрации вещества А и В в гомогенной системе А+3В«2С, если равновесные концентрации А=0,1 моль/л, В=0,2 моль/л, С= 0,7 моль/л.
Известно, что исходная концентрация вещества равна сумме равновесной и концентрации, ушедшей на реакцию, т.е. прореагировавшей:

Чтобы найти  надо знать, сколько вещества А прореагировало.
надо знать, сколько вещества А прореагировало.
Рассчитываем  , составляя пропорцию по уравнению реакций:
, составляя пропорцию по уравнению реакций:
2моль/л С получено из 1 моль/л А
0,7 моль/л С ––––––––х моль/л А,
х= (0,7×1)/2= 0,35 моль/л
Тогда:

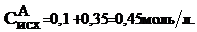
Рассчитываем исходную концентрацию вещества В:

Для нахождения  составим пропорцию:
составим пропорцию:
2 моль/л С получено из 3моль/л В
0,7 моль/л С –––––––––––––х моль/л В
х = (0,7×3)/2 = 1,05 моль/л
Тогда исходная концентрация В равна:

Пример 2.
Рассчитайте равновесные концентрации веществ в системе А+В «С+Д при условии, что исходные концентрации веществ: А=1 моль/л, В= 5 моль/л. Константа равновесия равна 1.
Предположим, что к моменту равновесия вещества А прореагировало х молей. Исходя из уравнения реакции, равновесные концентрации будут:
 ;
; 
 ;
;  ;
;  ,
,
так как по уравнению реакции вещества В ушло на реакции столько же, сколько прореагировало вещества А.
Подставляем значения равновесных концентраций в константу равновесия и находим х.

Тогда: 




Пример 3.
В системе установилось равновесие: 2АВ+В2 «2АВ; D H > 0.
В каком направлении сместится равновесие при уменьшении температуры?
Данная прямая реакция является эндотермической, т.е. идет с поглощением тепла, поэтому при уменьшении температуры в системе, равновесие в соответствии с принципом Ле-Шателье сместится влево, в сторону обратной реакции, которая является экзотермической.
Пример 4.
Равновесие системы А + В «АВ установилось при следующих концентрациях веществ: С(А)=С(В)=C(АВ)=0,01моль/л. Рассчитайте константу равновесия и исходные концентрации веществ.
Константа равновесия равна:
 .
.
Рассчитываем исходные концентрации веществ:
 .
.
По уравнению реакции:
 = 0,01 моль/л,
= 0,01 моль/л,
 = 0,01моль/л.
= 0,01моль/л.
Тогда:
 0,02 моль/л
0,02 моль/л
 0,02 моль/л.
0,02 моль/л.
Контрольные задания
71. Константа равновесия гомогенной системы 
N2+ 3H2  2NH3
2NH3
при температуре 400 С равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 моль/л и 0,08 моль/л. Вычислите равновесную и начальную концентрации азота.
72. Исходные концентрации оксида азота (II) и хлора в системе
2NO + Cl2  2NOCl
2NOCl
составляют соответственно 0,5 моль/л и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 оксида азота (II).
73. При некоторой температуре равновесные концентрации реагентов обратимой химической реакции
2А(г)+В(г)  2С(г)
2С(г)
составили [А]=0,04 моль/л, [В]=0,06 моль/л, [C]=0,02 моль/л. Вычислите константу равновесия и исходные концентрации веществ А и В.
74. При некоторой температуре равновесные концентрации в системе
2SO2+ O2  2SO3
2SO3
составляли соответственно: [SO2] = 0,04 моль/л, [O2] = 0,06 моль/л,
[SO3]=0,02 моль/л. Вычислите константу равновесия и исходные кон-
центрации оксида серы (IV) и кислорода.
75. При состоянии равновесия системы
N2+ 3H2  2NH3,
2NH3,
концентрации участвующих веществ были: [N2] = 0,3 моль/л; [H2] = =0,9 моль/л; [NH3] = 0,4 моль/л. Рассчитайте, как изменятся скорости прямой и обратной реакции, если давление увеличится в 5 раз. В каком направлении сместится равновесие?
76. Вычислите константу равновесия обратимой реакции
2SO2(г) + O2(г)  2SO3(г),
2SO3(г),
если равновесная концентрация [SO3]=0,04 моль/л, а исходные концен-трации веществ [SO2]=1 моль/л, [O2]=0,8 моль/л.
77. Равновесие системы
CO + Cl2  COCl2,
COCl2,
установилось при следующих концентрациях реагирующих веществ: [СО] = =[Сl2] = [COCl2] = 0,001 моль/л. Определите константу равновесия и исходные концентрации окиси углерода и хлора.
78. Исходные концентрации оксида углерода (II) и паров воды равны и составляют 0,03 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2в системе
CO + H2O  CO2+ H2,
CO2+ H2,
если равновесная концентрация СО2оказалась равной 0,01 моль/л. Вычислите константу равновесия.
79. Определите равновесную концентрацию водорода в системе
2HJ  H2+ J2,
H2+ J2,
если исходная концентрация HJ составляла 0,05 моль/л, а константа равновесия К=0,02.
80. Константа равновесия системы
СО + Н2О  СО2+ Н2
СО2+ Н2
при некоторой температуре равна 1. Вычислите процентный состав смеси в состоянии равновесия, если начальные концентрации СО и Н2О составляют по 1 моль/л.





 молярная масса хлористого водорода
молярная масса хлористого водорода  тогда скорость первой реакции,
тогда скорость первой реакции, моль/л×с,
моль/л×с, моль/л.
моль/л. моль/л×с
моль/л×с если увеличить концентрацию NO в 3 раза? Согласно закону действующих масс запишем выражение для скорости реакции:
если увеличить концентрацию NO в 3 раза? Согласно закону действующих масс запишем выражение для скорости реакции: .
.
 если увеличить давление в системе в 2 раза.
если увеличить давление в системе в 2 раза. и при увеличении давления в 2 раза:
и при увеличении давления в 2 раза:
 ,
,  .
. моль/л А.
моль/л А.

 = 0,1 + 0,35 = 0,45 моль/л.
= 0,1 + 0,35 = 0,45 моль/л. моль/л А.
моль/л А.
 моль/л.
моль/л. .
.



 .
. .
.
 надо знать, сколько вещества А прореагировало.
надо знать, сколько вещества А прореагировало. , составляя пропорцию по уравнению реакций:
, составляя пропорцию по уравнению реакций:
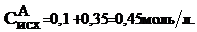

 составим пропорцию:
составим пропорцию:
 ;
;  ;
;  ;
; 




 .
. .
. = 0,01 моль/л,
= 0,01 моль/л, = 0,01моль/л.
= 0,01моль/л. 0,02 моль/л
0,02 моль/л 2NH3
2NH3

