Реакция происходит в кислой среде.
Пример.Составьте уравнение окислительно-восстановительной реакции ионно-электронным методом, если схема реакции имеет вид K2Cr2O7 + HCl + KNO2 → CrCl3 + KNO3 + KCl + H2O.
1). Запишем схему реакции в ионной форме, отметим частицы, образованные одинаковыми элементами, которые изменились в ходе реакции:
2K+ + Cr2O7 2- + H+ +Clˉ + K+ + NO2 - → Cr3+ + 3Clˉ + K+ + NO3ˉ + K+ +Clˉ + H2O
Вспомогательное действие. Нахождение частиц, изменившихся в ходе реакции, можно провести, анализируя степени окисления элементов:
+6 +3 +3 +5
K2 Cr2 O7 + HCl + K N O2 → Cr Cl3 + K N O3 + KCl + H2O
По указанным элементам можно найти ионы, изменившие свой состав в реакции.
2). Составим с найденными частицами полуреакции окисления и восстановления, уравняем число центральных атомов (это Cr и N)
Cr2O72- → 2Cr3+
NO2ˉ → NO3;
3). В реакции, кроме солей K2Cr2O7 и KNO2, участвует кислота HCl. Для уравнивания числа атомов кислорода используем правило для кислой среды и, подбирая коэффициенты перед Н+ и H2O, уравниваем число атомов водорода и кислорода:
Cr2O72- + 14Н+ → 2Cr3+ + 7H2O
NO2ˉ + H2O → NO3ˉ + 2Н+;
Определим заряды в каждой части полуреакций
+12 +6
Cr2O72- + 14Н+ → 2Cr3+ + 7H2O
-1 +1
NO2ˉ + H2O → NO3ˉ + 2Н+,
и для их уравнивания запишем число принятых и отданных электронов:
Cr2O72- + 14Н+ + 6ē → 2Cr3+ + 7H2O
NO2ˉ + H2O – 2ē → NO3ˉ + 2Н+.
Примечание. Число и направление передаваемых электронов в полуреакциях, составленных на основании электронного и ионно-электронного методов, должны совпадать.
4). Обозначим в полуреакциях процессы (ок-е и восс-е) и вещества (ок-ль и восс-ль):
ок-ль Cr2O72-+14Н++6ē→2Cr3++7H2O восс-е
восс-ль NO2ˉ+H2O–2ē→NO3ˉ+2Н+ ок-е
5). Для выполнения правила электронного баланса найдем множители:
Cr2O72-+14Н++6ē→2Cr3++7H2O × 1
NO2ˉ+H2O–2ē→NO3ˉ+2Н+ × 3,
вспомогательное действие (его можно опустить): запишем полуреакции с учетом найденных множителей:
Cr2O72- + 14Н+ + 6ē → 2Cr3+ + 7H2O
3NO2ˉ + 3H2O – 6ē → 3NO3ˉ + 6Н+
6). С учетом найденных множителей алгебраически сложим обе полуреакции и преобразуем
Cr2O72- + 14Н+ + 6ē + 3NO2ˉ + 3H2O – 6ē → 2Cr3+ + 7H2O + 3NO3ˉ + 6Н+
Уравнение Cr2O72- + 8 Н+ + 3NO2ˉ → 2Cr3+ + 3NO3ˉ + 4H2O
называется сокращенным ионным уравнением данной окислительно-восстановительной реакции. Это уравнение содержит информацию о реакции среды: ее определяют частицы Н+ – указатель кислой среды, а
коэффициенты в нем являются, соответственно, коэффициентами молекулярного уравнения.
7). Перенесем полученные коэффициенты в заданную схему реакции
и уравняем частицы, не изменившиеся в ходе реакции, в следующей последовательности:
а) атомы металлов, б) кислотные остатки, в) атомы водорода, г) в последнюю очередь – атомы кислорода:
K2Cr2O7 + 8HCl + 3KNO2 → 2CrCl3 + 3KNO3 + 2KCl + 4H2O.
Реакция происходит в нейтральной среде.
Пример. Составьте уравнение окислительно-восстановительной реакции ионно-электронным методом, если схема реакции имеет вид
As + NaClO + H2O →Н3AsO4 + NaCl.
Реакция происходит в нейтральной среде с образованием кислоты. Для составления такого типа реакций используется такая же последовательность действий, как для кислой среды:
1). As + Na+ + ClO- + H2O → H3AsO4 + Na+ + Cl-.
(H2O и Н3AsO4 – слабые электролиты, сохраняются в молекулярной форме)
2). As → H3AsO4 3) As + 4H2O - 5е → H3AsO4 + 5H+
ClO- → Cl-; ClO- + 2H+ + 2е → Cl + H2O
4). вос-ль As + 4H2O - 5е → H3AsO4 + 5H+ ок-е
ок-ль ClO- + 2H+ + 2е → Cl + H2O вос-е
5). вос-ль As + 4H2O - 5е → H3AsO4 + 5H+ ок-е ´2
ок-ль ClO- + 2H+ + 2е → Cl + H2O вос-е ´5
вспомогательное действие:
2As + 8H2O - 10е → 2H3AsO4 + 10H+
5ClO- + 10H+ + 10е → 5Cl + 5H2O
6). 2As + 8H2O - 10е + 5ClO- + 10H+ +10е → 2H3AsO4 + 10H+ + 5Cl +5H2O
7). 2As + 3H2O + 5ClO- → 2H3AsO4 + 5Cl
8). 2As + 5NaClO + 3H2O → 2Н3AsO4 + 5NaCl.
Реакция происходит в щелочной среде.
Пример. Составьте уравнение окислительно-восстановительной реакции ионно-электронным методом, если схема процесса имеет вид:
NaNO3 +MnO2 + KOH ® K2MnO4 + NaNO2
1). Ионная форма схемы реакции:
Na+ + NO3- + MnO2 + K+ + OH- ® 2K+ + MnO4 2- + Na+ + NO2 –
2). NO3- ® NO2 - 3). NO3- + H2O + 2e ® NO2 - + 2OH-
MnO2 ® MnO42- MnO2 + 4OH- -2e ® MnO42- + 2H2O
4). ок-ль NO3- + H2O + 2e ® NO2 - + 2OH- вос-е
вос-ль MnO2 + 4OH- -2e ® MnO42- + 2H2O ок-е
5). ок-ль NO3- + H2O + 2e ® NO2 - + 2OH- вос-е ´ 1
вос-ль MnO2 + 4OH- -2e ® MnO42- + 2H2O ок-е ´ 1
6). NO3- + H2O + 2е + MnO2 + 4OH- -2e ® NO2 - + 2OH- + MnO42- + 2H2O
7). NO3- + MnO2 + 2OH- ® NO2 - + MnO42- + H2O
8). NaNO3 +MnO2 + 2KOH ® K2MnO4 + NaNO2 + H2O.
Реакция происходит в нейтральной среде с образованием гидроксидов.
Пример. Составьте уравнение окислительно-восстановительной реакции ионно-электронным методом, если схема процесса имеет вид:
K2Cr2O7 + Na2S + H2O ® Cr(OH)3 + S
Для составления такого типа реакций используется такая же последовательность действий, как для щелочной среды.
1). Ионная форма схемы реакции:
2K+ + Cr2O72- + 2Na+ + S2- + H2O ® Cr(OH)3 + S
2). Cr2O72-® Cr(OH)3 3). Cr2O72- + 7H2O + 6e ® 2Cr(OH)3 + 8OH-
S2- ® S S2- -2e ® S
4). ок-ль Cr2O72- + 7H2O + 6e ® 2Cr(OH)3 + 8OH- вос-е
вос-ль S2- -2e ® S ок-е
5). ок-ль Cr2O72- + 7H2O + 6e ® 2Cr(OH)3 + 8OH- вос-е ´ 1
вос-ль S2- -2e ® S ок-е ´ 3
6). Cr2O72- + 7H2O + 6e + 3S2- -6e ® 2Cr(OH)3 + 8OH- + 3S
7). Cr2O72- + 7H2O + 3S2- ® 2Cr(OH)3 + 8OH- + 3S - здесь 8OH- -ионов распределились в соответствии с числом атомов калия и натрия
(2KOH + 6NaOH) в молекулярном уравнении:
8). K2Cr2O7 + 3Na2S + 7H2O ® 2Cr(OH)3 + 3S + 2KOH + 6NaOH.
Контрольные задания
131. а) Определите степени окисления элементов в соединениях
КMnO4, K2MnO4, MnO2, MnSO4, Mn(OH)2
б) На основании электронных уравнений расставьте коэффици-
енты в уравнениях реакций, идущих по схемам:
KMnO4+ Р + H2SO4 H3PO4+ K2SO4+ MnSO4
KOH + Cl2 KCl + KOCl + H2O
132 **. a) FeO, FeCl3, Fe2O3, K2FeO4
б) NaNO2+ PbO2+ H2SO4 NaNO3+ PbSO4+ H2O
J2+ H2S HJ + S
133 **. a) CrO, Cr2O3, K2CrO4, K2Cr2O7
б) Sn + HNO3 Sn(NO3)2+ NH4NO3+ H2O
H2S + H2SO4 S + SO2+ H2O
134 **. a) HCL, HClO, HClO2, HCLO3, HClO4
б) SO2+ KMnO4+ H2O K2SO4+ MnSO4+ H2SO4
PbO2+ HCl Cl2+ PbCl2+ H2O
135 *. a) NO, NH3, HNO2, KNO3
б) Bi + HNO3 Bi(NO3)3+ NO + H2O
KClO3+ HCl KCl + Cl2+ H2O
136 *. a) PH3, P2O3, H3PO4, P2O5
б) KMnO4+ NO + H2SO4 HNO3+ MnSO4+ K2SO4+
+ KNO3+ H2O
J2+ Br2+ H2O HJO3+ HBr
137 *. a) H2S, SO2, SO3, K2SO3, Na2SO4
б) Sn + H2SO4 Sn(SO4)2+ SO2+ H2O
Cl2+ KBr + KOH KBrO3+ KCl + H2O
138 *. a) HBr, HBrO, HBrO3, AlBr3
б) Mn(NO3)2+ KClO3+ H2O MnO2+ HNO3+ KCl
Сr2O3+ KOH + KNO3 K2CrO4+ KNO2+ H2O
139 *. a) J2, KJ, HJO, NaJO3
б) KMnO4+ K2S + H2O MnO2+ KOH + S
Fe + HNO3 Fe(NO3)3+ NO + H2O
140 *. a) N2, N2O3, NO, HNO2, Cu(NO3)2
б) FeSO4+ H2SO4+ HNO3 Fe2(SO4)3+ NO + H2O
SO2+ Cl2+ H2O H2SO4+ HСl
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Примеры решения задач
Гальванические элементы – это устройство, в которых происходит самопроизвольно переход химической энергии окислительно – восстановительной реакции в электрическую энергию.
Он представляет собой два металлических электрода, опущенные в растворы собственных солей, которые соединены между собой полупроницаемой перегородкой. При замыкании внешней цепи через измерительный прибор, последний покажет напряжение между электродами.
Электрод – это система: металл – раствор электролита. При погружении металла в раствор собственных ионов начинается сложное взаимодействие металла с компонентами раствора. Наиболее важной реакцией, протекающей на электроде, является взаимодействие поверхностных ион –атомов металла, находящихся в узлах кристаллической решетки, с полярными молекулами воды, ориентированными у поверхности электрода. В результате взаимодействия гидратированные ионы металла переходят в раствор, оставляя в металле электроны, заряд которых не скомпенсирован положительно заряженными ионами металла. В результате этого металл становится заряженным отрицательно, а раствор – положительно.
Между металлом и раствором возникает разность потенциалов, получившая название электродного потенциала. При некотором определенном значении электродного потенциала устанавливается равновесие:
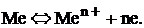 (1)
(1)
Данное равновесие характерно для металлического электрода, полученного погружением металла в раствор своей соли.
Помимо металлических электродов существуют и газовые электроды, в которых металл не принимает участия в образовании двойного электрического слоя, а играет роль токоотвода.
В газовых электродах в образовании потенциала принимает участие газ и его ионы из раствора электролита.
Так для водородного электрода при некотором значении электродного потенциала устанавливается равновесие между молекулами и ионами водорода:
 (2)
(2)
Для кислородного электрода при некотором значении электродного потенциала устанавливается равновесие между молекулами кислорода и ионами гидроксила:
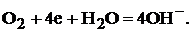 (3)
(3)
Ионы 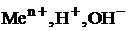 и называются потенциалопределяющими для металлического, водородного, кислородного электродов соответственно.
и называются потенциалопределяющими для металлического, водородного, кислородного электродов соответственно.
Величина электродного потенциала металлических электродов определяется природой металла, температурой, концентрацией ионов металла в растворе и давлением (для газовых электродов).
Стандартный электродный потенциал,  – это потенциал, который устанавливается на электроде при стандартных условиях: температура
– это потенциал, который устанавливается на электроде при стандартных условиях: температура 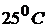 и концентрации потенциалопределяющих ионов 1 моль/л, давление 101,3 кПа (для газовых электродов). Значения стандартных электродных потенциалов приведены в приложении.
и концентрации потенциалопределяющих ионов 1 моль/л, давление 101,3 кПа (для газовых электродов). Значения стандартных электродных потенциалов приведены в приложении.
Равновесный электродный потенциал,  – это потенциал, который возникает на электроде при данных условиях, которые могут отличаться от стандартных.
– это потенциал, который возникает на электроде при данных условиях, которые могут отличаться от стандартных.
Зависимость величины электродного потенциала металлического электрода от активной концентрации потенциалопределяющих ионов при  выражается уравнением Нернста.
выражается уравнением Нернста.
 (4)
(4)
где 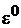 – стандартный электродный потенциал,
– стандартный электродный потенциал, 

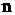 – число электронов, участвующих в электродной реакции;
– число электронов, участвующих в электродной реакции; 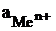 активная концентрация потенциалопределяющих ионов, моль/л.
активная концентрация потенциалопределяющих ионов, моль/л.
Для водородного и кислородного электродов их равновесные потенциалы можно рассчитать по уравнениям (5),(6) соответственно:
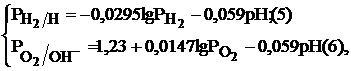
где  – стандартные электродные потенциалы водородного и кислородного электродов;
– стандартные электродные потенциалы водородного и кислородного электродов;  – парциальные давления водорода и кислорода;
– парциальные давления водорода и кислорода;  – активности в растворе ионов водорода, гидроксила и воды, моль/л.
– активности в растворе ионов водорода, гидроксила и воды, моль/л.
В гальванических элементах при разомкнутой цепи на электродах устанавливается равновесие, характеризуемое величиной равновесного электродного потенциала. При замыкании цепи равновесие на электродах нарушается и на электроде, потенциал которого более отрицателен, пойдет процесс окисления, а на другом электроде, потенциал которого более положителен,– процесс присоединения электронов – восстановление. Электрод, на котором идет окисление, называют анодом: этот электрод имеет знак минус. Электрод, на котором идет восстановление, называют катодом; он имеет знак плюс.
Важнейшей характеристикой гальванических элементов является электродвижущаяся сила – E (ЭДС). ЭДС – это максимальная разность потенциалов, которая устанавливается на электродах при разомкнутой цепи
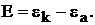 (7)
(7)
В работающем гальваническом элементе измеряют не ЭДС, ф напряжение – U. Напряжение гальванического элемента всегда меньше ЭДС из-за омических потерь и поляризации гальванического элемента,  которая равна сумме катодной и анодной поляризаций.
которая равна сумме катодной и анодной поляризаций.
Электродвижущую силу гальванического элемента, кроме формулы (7) можно рассчитать по уравнению (8), если известны активности потенциалопределяющих ионов восстановителя и окислителя:
E = E0+(0,059/n)×(lg a (окисл)/ lg a (восст)) (5)
где  – стандартная ЭДС гальванического элемента;
– стандартная ЭДС гальванического элемента; 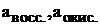 – активные концентрации восстановителя и окислителя.
– активные концентрации восстановителя и окислителя.
Значение ЭДС можно вычислить по уравнению (6), если известны термодинамические характеристики токообразующей реакции:
 (9)
(9)
где 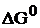 – стандартное значение энергии Гиббса токообразующей реакции, кДж/моль;
– стандартное значение энергии Гиббса токообразующей реакции, кДж/моль; 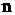 – число электронов, участвующих в электрохимическом процессе;
– число электронов, участвующих в электрохимическом процессе;  – число Фарадея, равное 96500 Дж/(моль×В).
– число Фарадея, равное 96500 Дж/(моль×В).
Изменение энергии Гиббса для любой химической реакции, в том числе и электрохимической, рассчитывают по следствию из закона Гесса, как разность между стандартной энергией Гиббса продуктов реакции и энергией Гиббса исходных веществ.





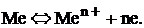 (1)
(1) (2)
(2)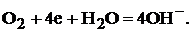 (3)
(3)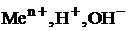 и называются потенциалопределяющими для металлического, водородного, кислородного электродов соответственно.
и называются потенциалопределяющими для металлического, водородного, кислородного электродов соответственно. – это потенциал, который устанавливается на электроде при стандартных условиях: температура
– это потенциал, который устанавливается на электроде при стандартных условиях: температура 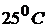 и концентрации потенциалопределяющих ионов 1 моль/л, давление 101,3 кПа (для газовых электродов). Значения стандартных электродных потенциалов приведены в приложении.
и концентрации потенциалопределяющих ионов 1 моль/л, давление 101,3 кПа (для газовых электродов). Значения стандартных электродных потенциалов приведены в приложении. – это потенциал, который возникает на электроде при данных условиях, которые могут отличаться от стандартных.
– это потенциал, который возникает на электроде при данных условиях, которые могут отличаться от стандартных. выражается уравнением Нернста.
выражается уравнением Нернста. (4)
(4)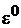 – стандартный электродный потенциал,
– стандартный электродный потенциал, 

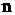 – число электронов, участвующих в электродной реакции;
– число электронов, участвующих в электродной реакции; 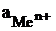 активная концентрация потенциалопределяющих ионов, моль/л.
активная концентрация потенциалопределяющих ионов, моль/л.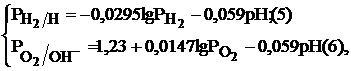
 – стандартные электродные потенциалы водородного и кислородного электродов;
– стандартные электродные потенциалы водородного и кислородного электродов;  – парциальные давления водорода и кислорода;
– парциальные давления водорода и кислорода;  – активности в растворе ионов водорода, гидроксила и воды, моль/л.
– активности в растворе ионов водорода, гидроксила и воды, моль/л.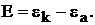 (7)
(7) которая равна сумме катодной и анодной поляризаций.
которая равна сумме катодной и анодной поляризаций. – стандартная ЭДС гальванического элемента;
– стандартная ЭДС гальванического элемента; 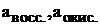 – активные концентрации восстановителя и окислителя.
– активные концентрации восстановителя и окислителя. (9)
(9)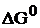 – стандартное значение энергии Гиббса токообразующей реакции, кДж/моль;
– стандартное значение энергии Гиббса токообразующей реакции, кДж/моль;  – число Фарадея, равное 96500 Дж/(моль×В).
– число Фарадея, равное 96500 Дж/(моль×В).


