Медные участки становятся катодными. На меди будет протекать процесс восстановления окислителя, которым в данном случае будут молекулы  , а не ионы
, а не ионы  , так как потенциал восстановления в нейтральной среде кислорода будет
, так как потенциал восстановления в нейтральной среде кислорода будет  а ионов водорода
а ионов водорода  и
и  >
>  а
а  <
< 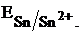
К(+) 
Одним из методов защиты от коррозии являются металлические защитные покрытия. Их можно разделить на анодные и катодные покрытия.
К катодным покрытиям относятся покрытие металлами, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла. В качестве катодных покрытий для железа  можно использовать никель
можно использовать никель  , медь
, медь  , серебро
, серебро  золото
золото 
 .
.
При механическом повреждении такого покрытия железа служит анодом и растворяется, а катодом становится металл покрытия, на котором протекает процесс восстановления окислителя внешней среды (выделение водорода или поглощения кислорода).
При анодном покрытии основного металла (железо или сталь) покрывают металлом с более отрицательным потенциалом, например цинком 
 хромом
хромом  При нарушении такого покрытия основной металл становится катодом коррозионного элемента, на котором идет процесс восстановления окислителя (выделение водорода или поглощения кислорода), а металл покрытия – анодом, на котором идет процесс его окисления (растворения).
При нарушении такого покрытия основной металл становится катодом коррозионного элемента, на котором идет процесс восстановления окислителя (выделение водорода или поглощения кислорода), а металл покрытия – анодом, на котором идет процесс его окисления (растворения).
Пример 1.
Какие процессы будут протекать при коррозии бериллия в контакте с цинком при рН 7 во влажном воздухе. Составьте уравнения анодного и катодного процесса.
В данном случае будет протекать электрохимическая коррозия. Так как потенциал бериллия  более отрицательный, чем потенциал цинка
более отрицательный, чем потенциал цинка  , то на бериллии будет протекать процесс анодного окисления металла:
, то на бериллии будет протекать процесс анодного окисления металла:  A(–) Be–2e®Be2+ а на цинке, который будет катодным участком, будет происходить восстановление окислителей: молекул
A(–) Be–2e®Be2+ а на цинке, который будет катодным участком, будет происходить восстановление окислителей: молекул  воздуха и ионов
воздуха и ионов  , так как их потенциалы в нейтральной среде положительнее, чем потенциал окисляющегося металла – бериллия:
, так как их потенциалы в нейтральной среде положительнее, чем потенциал окисляющегося металла – бериллия: 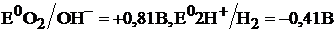 .
.
Следовательно, на цинке будут протекать процессы:
К (+) 
Пример 2.
Какие процессы протекают при коррозии луженой меди в нейтральной среде?
Процесс электрохимической коррозии меди, покрытой оловом, будет протекать следующим образом. Потенциал олово,  а потенциал меди,
а потенциал меди,  поэтому при нарушении покрытая олово становится анодом, как его потенциал более отрицательнее, и на нем будет протекать процесс окисления олова:
поэтому при нарушении покрытая олово становится анодом, как его потенциал более отрицательнее, и на нем будет протекать процесс окисления олова:

Контрольные задания
171. Опишите процесс ржавления железа во влажной атмосфере. К какому типу коррозии - химической или электрохимической - относится этот процесс? Напишите уравнения соответствующих реакций.
172. Опишите сущность процесса электрохимической коррозии. По-чему в инертной атмосфере процесс коррозии протекает значительно медленнее, чем на воздухе?
173 *. Катодным или анодным является свинцовое покрытие на железе? Составьте уравнения анодного и катодного процессов коррозии таких изделий при нарушении целостности покрытия во влажном воздухе.
174. Охарактеризуйте анодный и катодный процессы при электро-химической коррозии. Какую роль играет атмосферный кислород в процессах коррозии?
175 *. Объясните сущность процесса коррозии железа, покрытого цинком. Напишите соответствующие уравнения реакций.
176 *. Для пищевых консервов применяют посуду из листового железа, покрытого оловом. Будет ли это покрытие электрохимической защитой при повреждении слоя олова? Дайте мотивированный ответ.
177. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Дайте мотивированный ответ.
178 *. Опишите процесс атмосферной коррозии железа, покрытого слоем никеля, при нарушении целостности покрытия. Приведите электрон-ные уравнения анодного и катодного процессов.
179 *. Железное изделие покрыли кадмием. Анодным или катодным является это покрытие? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия во влажном воздухе и в соляной кислоте.
180. В чем заключается сущность протекторной защиты металлов от коррозии?
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Примеры решения задач
В реакциях Co Cl3 + 6 N H3 = [Co(NH3) 6]Cl3 и 2KCI + PtCI2 = K2[PtCI4] сложные соединения [Co(NH3) 6]Cl3 и K2[PtCI4] называются комплексными соединениями.
Такие соединения образуются, если исходные молекулы могут проявлять «дополнительную» валентность за счет образования ковалентной связи по донорно-акцепторному типу. Для этого одна из молекул должна содержать атом со свободными орбиталями, а другая молекула - иметь атом с неподеленной парой валентных электронов.
Состав комплексных соединений. Согласно координационной теории А.Вернера в комплексных соединениях различают внутреннюю и внешнюю сферы. Внутренняя сфера (комплексный ион или комплекс), как правило, выделяется в квадратные скобки, и состоит из комплексообразователя (атома или иона) и окружающих его лигандов:
комплексообразователь лиганды


[ Co (NH3 )6]CI3


внутренняя сфера внешняя сфера
Комплексообразователями служат атомы или ионы, имеющие вакантные валентные орбитали. Наиболее распространенными комплексообразователями служат атомы или ионы d – элементов.
Лигандами могут быть молекулы или ионы, предоставляющие неподеленные пары валентных электронов для координации с комплексообразователем.
Число координируемых лигандов определяется координационным числом комплексообразователя и дентатностью лигандов. Координационное число равно общему числу σ-связей между комплексообразователем и лигандами, оно определяется числом свободных (вакантных) атомных орбиталей комплексообразователя, которые он предоставляет для донорных пар электронов лигандов.
Правило:
координационное число комплексообразователя равно его удвоенной степени окисления.
Дентатность лиганда – это число всех σ-связей, которые лиганд может образовать с комплексообразователем; эта величина оределяется как число донорных пар электронов, которые лиганд может предоставить для взаимодействия с центральным атомом. По этой характеристике различают моно-, ди- и поли-дентатные лиганды. Например, этилендиамин H2N-CH2-CH2-NH2, ионы SO42-, CO32- - бидентатные лиганды. Следует учитывать, что лиганды не всегда проявляют свою максимальную дентатность.
В случае монодентатных лигандов (какими являются в рассматриваемых примерах молекулы аммиака: NH3 и хлорид-ионы CI-) индекс, указывающий на число лигандов, совпадает с координационным числом комплексообразователя. Примеры других лигандов и их названия приведены далее в таблице.
Определение заряда комплексного иона (внутренней сферы). Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов, или равен заряду внешней сферы, взятому с обратным знаком (правило электронейтральности). В соединении [Co(NH3) 6]Cl3 внешнюю сферу образуют три иона хлора (CI-) с общим зарядом внешней сферы 3-, тогда по правилу электронейтральности внутренняя сфера имеет заряд 3+: [Co(NH3)6]3+.
В комплексном соединении K2[PtCI4] внешнюю сферу образуют два иона калия (К+), общий заряд которых равен 2+, тогда заряд внутренней сферы будет 2-: [PtCI4]2-.
Определение заряда комплексообразователя.
Термины «заряд комплексообразователя» и «степень окисления комплексообразователя» здесь тождественные.
В комплексе [Co(NH3)6]3+ лигандами являются электронейтральные молекулы, следовательно, заряд комплекса (3+) определяется зарядом комплексообразователя - Co3+.
В комплексе [PtCI4]2- заряд внутренней сферы (2-) равен алгебраической сумме зарядов комплексообразователя и лигандов: -2 = х + 4×(-1); заряд комплексообразователя (степень окисления) х = +2, т.е. центром координации в этом комплексе является Pt2+.
Катионы или анионы за пределами внутренней сферы, связанные с ней электростатическими силами ион – ионного взаимодействия, образуют внешнюю сферу комплексного соединения.
Номенклатура комплексных соединений.
Название соединений определяется типом комплексного соединения в зависимости от заряда внутренней сферы: например:
[Co(NH3)6]Cl3 – относится к катионным комплексным соединениям, т.к. внутренняя сфера (комплекс) [Co(NH3)6]3+ является катионом;
K2[PtCI4] – анионное комплексное соединение, внутренняя сфера [PtCI4]2- является анионом;
[Pt(NH3)2CI2]0 и [Ni(CO)4]0 относятся к электронейтральным комплексным соединениям, они не содержат внешней сферы, т.к. внутренняя сфера - с нулевым зарядом.
Общие правила и особенности в названии комплексных соединений.
Общие правила:
1) во всех типах комплексных соединений сначала называют анионную, затем – катионную часть соединения;
2) во внутренней сфере всех типов комплексов число лигандов указывается с помощью греческих числительных: ди, три, тетра, пента, гекса и т.д.;
2а) если во внутренней сфере комплекса находятся разные лиганды (это смешанные или разнолигандные комплексы), указываются сначала числа и названия отрицательно заряженных лигандов с прибавлением окончания -о (Cl ˉ - хлоро, OH ˉ - гидроксо, SO42ˉ - сульфато и т.п. (см. таблицу), затем указывают числа и названия нейтральных лигандов, причем вода называется аква, а аммиак – амин;
2б) последним во внутреннейсфере называют комплексообразователь.
Особенность: Название комплексообразователя определяется тем, входит ли он в комплексный катион (1), комплексный анион (2) или нейтральный комплекс (3).
(1). Комплексообразователь - в комплексном катионе.
После названия всех лигандов во внутренней сфере комплекса дается русское название элемента- комплексообразователя в родительном падеже. Если элемент проявляет различную степень окисления, она указывается после его названия в скобках цифрами. Используется также номенклатура с указанием для комплексообразователя не степени окисления, а его валентности (римскими цифрами).
Пример. Назовите комплексное соединение [Pt(NH3)3Cl]Cl.
а). Определим заряд внутренней сферы по правилу: заряд внутренней сферы равен по величине, но противоположен по знаку заряду внешней сферы; заряд внешней сферы (его определяет ион хлора Cl-) равен -1, следовательно, внутренняя сфера имеет заряд +1 ([Pt(NH3)3Cl]+) и это - комплексный катион.
б). Вычислим степень окисления комплексообразователя (это платина), поскольку в названии соединения должна указываться его степень окисления. Обозначим ее через х и вычислим из уравнения электронейтральности (алгебраическая сумма степеней окисления всех атомов элементов в молекуле равна нулю): х×1 +0×3 + (-1)×2=0; х = +2, т.е. Pt(2+).
в). Название соединения начинаем с аниона – хлорид.
г). Далее называем катион [Pt(NH3)3Cl]+ - это комплексный катион, который содержит разные лиганды – и молекулы (NH3), и ионы (Cl-), поэтому называем в первую очередь заряженные лиганды, прибавляя окончание – о -, т.е. – хлоро, затем называем лиганды-молекулы (это аммиак NH3), их 3, для этого используем греческое числительное и название лиганда – триаммин, далее называем по-русски в родительном падеже комплексообразователь с указанием его степени окисления – платины(2+);
д). Объединив последовательно названия (даны жирным курсивом), получим название комплексного соединения [Pt(NH3)3Cl]Cl - хлорид хлоротриамминплатины(2+).
Примеры соединений с комплексными катионами и их названия:
1) [V(NH3)5NО2]Br2 - бромид нитрит о пента амминванадия(3+);
2) [Cr(NH3)4СО3]CI - хлорид карбонат о тетра амминхрома(3+);
3) [Cu(NH3)4](ClO4)2 – перхлорат тетра амминмеди(2+);
4) [Ru(NH3)5Br]SO4 – сульфат бром о пента амминрутения(3+);
5) [Co(H2O)4Br2]ClO4 – перхлорат ди бром о тетра аквакобальта(3+).
Таблица. Формулы и названия отрицательно заряженных лигандов
| F ˉ
| -
| фторо-
| CO32ˉ
| -
| карбонато-
|
| OH ˉ
| -
| гидроксо-
| С2O42ˉ
| -
| оксалато-
|
| NO2ˉ
| -
| нитро-(или нитрито-)
| CN ˉ
| -
| циано-
|
| Cl ˉ
| -
| хлоро-
| CNS ˉ
| -
| тиоцианато-
|
| Br ˉ
| -
| бромо-
| PO43ˉ
| -
| фосфато-
|
| J ˉ
| -
| иодо-
| H ˉ
| -
| гидридо-
|
(2). Комплексообразователь - в комплексном анионе.
После названия лигандов называют комплексообразователь; используется латинское название элемента, к нему прибавляется суффикс –ат (отличительный признак комплекса анионного типа) и указывается в скобках валентность или степень окисления комплексообразователя. Затем называют катион внешней сферы в родительном падеже. Индекс, указывающий на число катионов в соединении, определяется валентностью комплексного аниона и в названии не отображается.
Пример. Назовите комплексное соединение (NH4)2[Pt(OH)2Cl4].
а). Определим заряд внутренней сферы, он равен по величине, но противоположен по знаку заряду внешней сферы; заряд внешней сферы (его определяют ионы аммония NH4+) равен +2, следовательно, внутренняя сфера имеет заряд -2 и это - комплексный анион [Pt(OH)2Cl4]2-.
б). Степень окисления комплексообразователя (это платина) (обозначим через х) вычислим из уравнения электронейтральности: (+1)×2 + х×1 +(-1)×2 + (-1)×4=0; х = +4, т.е. Pt(4+).
в). Название соединения начинаем с аниона - ([Pt(OH)2Cl4]2- (комплексный анион), который содержит разные лиганды-ионы: (ОH-) и (Cl-), поэтому к названию лигандов прибавляем кончание – о -, а их количество обозначаем числительными: - тетрахлородигидроксо -, далее называем комплексообразователь, используя латинское название элемента, к нему прибавляем суффикс –ат (отличительный признак комплекса анионного типа) и указываем в скобках валентность или степень окисления комплексообразователя - платинат (4+).
г). Последним называем катион в родительном падеже – аммония.
д). Объединив последовательно названия (даны жирным курсивом), получим название комплексного соединения (NH4)2[Pt(OH)2Cl4] - тетрахлородигидроксоплатинат(4+) аммония.
Примеры соединений с комплексными анионами и их названия:
1) Mg[Al(OH)F3]2 – три фтор о гидроксоалюмин ат (3+) магния;
2) К2[Cu(NH3)2(S2O3)2] - ди тиосульфат о ди амминкупр ат (2+) калия;
3) К2[HgJ4] – тетра иод о меркур ат (2+) калия.
(3). Комплексообразователь – в нейтральном комплексе.
После названия всех лигандов последним называют комплексообразователь в именительном падеже, а степень его окисления не указывают, так как она определяется электронейтральностью комплекса.
Примеры нейтральных комплексов и их названия:
1) [Pt(NH3)(H2O)Сl2] – ди хлор о акваамминплатина;
2) [Co(NH3)3Br3] – три бром о три амминкобальта;
3) [Co(NH3)3Cl3] – трихлоротриамминкобальт.
Таким образом, сложная часть названия всех типов комплексных соединений всегда соответствует внутреннный сфере комплекса.
Поведение комплексных соединений в растворах. Равновесия в растворах комплексных соединений. Рассмотрим поведение в растворе комплексного соединения хлорида диамминсеребра [Ag(NH3)2]Cl.
Ионы внешней сферы (CI-) связаны с комплексным ионом в основном силами электростатического взаимодействия (ионной связью), поэтому в растворе, подобно ионам сильных электролитов, происходит практически полный распад комплексного соединения на комплекс и внешнюю сферу - это внешнесферная или первичная диссоциация комплексных солей:
[Ag(NH3)2]Cl ® [Ag(NH3)2]+ + Cl- - первичная диссоциация.
Лиганды во внутренней сфере комплекса связаны с комплексообразователем донорно-акцепторными ковалентными связями; их отщепление (отрыв) от комплексообразователя протекает в большинстве случаев в незначительной степени, как у слабых электролитов, поэтому носит обратимый характер. Обратимый распад внутренней сферы - это вторичная диссоциация комплексного соединения:
[Ag(NH3)2]+ «Ag+ + 2NH3 - вторичная диссоциация.
В результате этого процесса устанавливается равновесие между комплексной частицей, центральным ионом и лигандами. Она протекает ступенчато с последовательным отщеплением лигандов.
Константа равновесия процесса вторичной диссоциации называется константой нестойкости комплексного иона:
Кнест. = [Ag +]×[NH3]2/[Ag(NH3)2+] = 6,8×10-8.
Она служит мерой устойчивости внутренней сферы: чем устойчивее комплексный ион, тем меньше его константа нестойкости, тем меньше концентрация ионов, образующихся при диссоциации комплекса. Значения констант нестойкости комплексов являются табличными величинами.
Константы нестойкости, выраженные через концентрации ионов и молекул, называются концентрационными. Константы нестойкости, выраженные через активности ионов и молекул, не зависят от состава и ионной силы раствора. Например, для комплекса в общем виде МеХn (уравнение диссоциации МеХn «Ме + nХ) константа нестойкости имеет вид:
Кнест. = aМе×an Х/a МеХn.
При решении задач в случае достаточно разбавленных растворов допускается использование концентрационных констант, полагая, что коэффициенты активности компонентов системы практически равны единице.
Приведенное уравнение вторичной диссоциации – это суммарная реакция ступенчатого процесса диссоциации комплекса с последовательным отщеплением лигандов:
[Ag(NH3)2]+ «[Ag(NH3)]+ + NH3, Кнест.1 = [Ag(NH3)+]×[NH3]/[Ag(NH3)2+]
[Ag(NH3)]+ «Ag+ + NH3, Кнест.2 = [Ag +]×[NH3]/[Ag(NH3)+]
[Ag(NH3)2]+ «Ag+ + 2NH3, Кнест. = [Ag +]×[NH3]2/[Ag(NH3)2+] = Кнест.1× Кнест.2,
где Кнест.1 и Кнест.2 – ступенчатые константы нестойкости комплекса.
Общая константа нестойкости комплекса равна произведению ступенчатых констант нестойкости.
Из приведенных уравнений ступенчатой диссоциации комплекса следует, что в растворе могут присутствовать продукты промежуточной диссоциации; при избыточной концентрации лиганда, благодаря обратимости этих процессов, равновесие реакций сдвигается в сторону исходных веществ и в растворе, в основном, присутствует недиссоциировнный комплекс.
Для характеристики прочности комплекса, кроме константы нестойкости комплекса, используется обратная ей величина – константа устойчивости комплекса bуст. = 1/ Кнест. . bуст. также является справочной величиной.
Контрольные задания
181. Для приведенного комплексного соединения укажите название, степень окисления (заряд) иона-комплексообразователя, координационное число. Напишите уравнения электролитической диссоциации этого соединения и выражение для константы нестойкости комплекса [PtCI2(H2O)(NH3)3]Cl 2, [PdCl(H2O)(NH3)2]Cl.
182*. [Cd(NH3)3H2O]SO4 , [Cu(NH3) 4](NO3)2.
183*. K2[CuCI2(H2O)(NH3)](NO3)2, [Cu(NH3)4]SO4.
184*. Na[Zn(CN)3(H2O)], [Co(NH3)4(H2O)]Cl3.
185*. Ba[Fe(CN)5(H2O)], [Ag(NH3)2]Cl.
186*. (NH4)[PdCI3(H2O)], [CoCN(NH3)4(H2O)]Br2.
187*. Na3[MnF6], [CoSO4(NH3)5]NO3.
188*. [Ti F2(H2O)4]SO4, K[Co(NO2)4(NH3)2.
189*. [V(CN)(H2O)5]Cl 2, K3[Fe(CN)6].
190*. [Pb(NH3)2Cl 2], [PtCl(NH3)3]Cl.
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Примеры решения задач
Для получения высокомолекулярных соединений существует два основных способа: полимеризация и поликонденсация.
Полимеризация – реакция соединения молекул мономера, протекающая за счет разрыва кратных связей.
Полимеризацию можно изобразить общей схемой:

где R – заместитель, например, R = H, – СН3, Сl, С6Н5 и др.
n – степень полимеризации.
Полимеризация алкадиенов с сопряженными двойными связями (алкадиены-1,3) протекает за счет раскрытия двойных связей в положениях 1,4 или 1,2, например:

Наиболее ценные полимеры (каучуки) получаются при стереорегулярной полимеризации в 1,4-положение в присутствии катализаторов Циглера-Натта [Al(C2H5)3 + ТiCl4]:

Для улучшения свойств каучуков полимеризацию бутадиена-1,3 и изопрена проводят совместно со стиролом, акрилонитрилом, изобутиленом. Такие реакции называются сополимеризациями. Например,
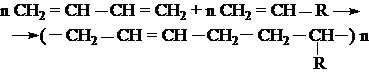
где R =  – (бутадиен – стирольный каучук),
– (бутадиен – стирольный каучук),
R = -C º N (бутадиен – нитрильный каучук).
Поликонденсация – реакция образования макромолекул из ди или полифункциональных соединений, сопровождающаяся отщеплением низкомолекулярных продуктов (воды, аммиака, хлорида водорода и др.).
Поликонденсация, в которой участвует только один мономер, называется гомополиконденсацией. Например,
nНО – (СН2)6 – СООН  (n-1)Н2О + Н – [–О – (СН2)6 –СО –]n – ОН
(n-1)Н2О + Н – [–О – (СН2)6 –СО –]n – ОН
7-гидроксигептановая полимер
кислота (мономер)
В результате гомополиконденсации 6-аминогексановой кислоты
(e-аминокапроновой кислоты) получается полимер капрон.
Поликонденсация, в которой участвуют два мономера, содержащие различные функциональные группы, называется гетерополиконденсацией. Например поликонденсация между двухосновными кислотами и двухатомными спиртами приводит к получению полиэфиров:
nНООС – R – COOH + nHO – R¢– OH [– OC – R – COOR¢– O –]n + (2n-1) H2O
В результате гетерополиконденсации адипиновой кислоты и гексаметилендиамина получается полиамид (нейлон)
Пример 1.
Сколько структурных звеньев (n) входит в макромолекулу полихлорвинила с молекулярной массой 350000?
Дано:
M m полимера = 350000
Определить количество структурных звеньев – (n).
Решение:
1. Схема реакции:

2. Находим молекулярную массу элементарного звена 
сложением атомных масс элементов, входящих в его состав – 62,5.
3. Находим (n). Делим молекулярную массу элементарного звена: 3500: 62,5 = 5600
Ответ: n = 5600
Пример 2.
Напишите схему образования димера и тримера изобутилена под действием серной кислоты с учетом механизма этой реакции (катионной полимеризации).
Решение:

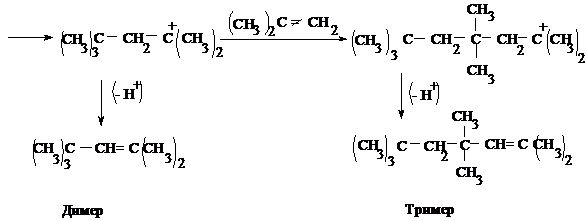

Такой процесс полимеризации наблюдал впервые А.М. Бутлеров при действии на изобутилен серной кислоты.
Обрыв цепи в данном случае происходит в результате отщепления протона (Н+).
Реакция идет в присутствии воды, которая захватывает протон, образуя катион гидроксония
 .
.
Контрольные задания
191. Какие полимеры называют термопластичными, термореактивными?
192. Составьте уравнение реакции сополимеризации стирола
C6H5–CH=CH2и бутадиена СH2=CH–CH=СH2. Какими свойствами обладает продукт сополимеризации и где он используется?
193. Составьте уравнения реакции полимеризации пропилена
СH2=СH–CH3и изобутилена H2C=C–CH3.
|
CH3
194. Напишите уравнение реакции поликонденсации адипиновой кислоты HOOC(СH2)4COOH и гексаметилендиамина NH2(СH2)6NH2. Какой продукт образуется, какими свойствами обладает и где он применяется?
195. Какие углеводороды называются диеновыми? Приведите при-меры. Какой общей формулой выражают состав диеновых углеводородов? Составьте схему полимеризации одного из диеновых углеводородов.
196. Какие соединения называют аминами? Составьте схему поли-конденсации адипиновой кислоты и гексаметилендиамина. Как называют полимер, образующийся в результате этой реакции?
197. Рассчитайте молекулярную массу полихлорвинила, если степень полимеризации равна 200. Напишите уравнение реакции полимеризации хлорвинила.
198. Какие соединения называют аминокислотами? Напишите фор-мулу простейшей аминокислоты. Составьте схему поликонденсации аминокапроновой кислоты. Как называют полимер, образующийся в ре-зультате этой реакции?
199. Напишите уравнения реакций получения капрона из аминока-проновой кислоты NH2(CH2)5COOH и найлона из адипиновой кислоты COOH(CH2)4COOH и гексаметилендиамина NH2(CH2)6NH2.
200. Как называются углеводороды, представителем которых является изопрен? Составьте схему сополимеризации изопрена и изобутилена.
ПРАВИЛА ВЫПОЛНЕНИЯ И ОФОРМЛЕНИЯ
КОНТРОЛЬНОЙ РАБОТЫ *
При выполнении контрольной работы необходимо строго придержи-ваться указанных ниже правил. Работа, выполненная без соблюдения этих правил, не зачитывается и возвращается студенту для переработки.
1. Контрольная работа должна быть выполнена в отдельной тетради в клетку чернилами любого цвета, кроме красного. Необходимо оставлять поля шириной 4-5 см для замечаний рецензента.
2. В заголовке работы на обложке тетради должны быть ясно написаны фамилия студента, его инициалы, учебный номер (шифр), название дисциплины; здесь же следует указать название учебного заведения, дату отсылки работы в институт и адрес студента. В конце работы следует проставить дату ее выполнения и расписаться.
3. В работу должны быть включены все задачи, указанные в задании строго по положенному варианту. Контрольные работы, содержащие не все задачи задания, а также задачи не своего варианта, не зачитываются.
4. Решения задач надо располагать в порядке номеров, указанных в заданиях, сохраняя номера задач.
_____________________
* Приведены в соответствии с типовым методическим пособием для
студентов-заочников инженерно-технических специальностей
5. Перед решением каждой задачи надо полностью выписать ее условие. В том случае, если несколько задач, из которых студент выбирает задачи своего варианта, имеют общую формулировку, следует, переписывая условие задачи, заменить общие данные конкретными, взятыми из соответствующего номера.
6. Решения задач следует излагать, подробно и аккуратно объясняя и мотивируя все действия по ходу решения и делая необходимые рисунки.
7. После получения незачтенной работы студент должен исправить все отмеченные рецензентом ошибки и недочеты и выполнить все рекомендации рецензента.
Если рецензент предлагает внести в решения задач те или иные исправления или дополнения и прислать их для повторной проверки, то это следует сделать в короткий срок.
В случае незачета работы и отсутствия прямого указания рецензента на то, что студент может ограничиться представлением исправленных решений отдельных задач, вся работа должна быть выполнена заново.
При высылаемых исправлениях должна обязательно находиться прорецензированная работа. Поэтому рекомендуется при выполнении контрольной работы оставлять в конце тетради несколько чистых листов для всех дополнений и исправлений в соответствии с указаниями рецензента. Вносить исправления в сам текст работы после ее рецензирования запрещается.
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНОЙ РАБОТЫ
| Номер
варианта
| Номера задач, относящихся к данной контрольной работе
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 1,
| 11,
| 22,
| 34,
| 45,
| 58,
| 70,
| 76,
| 87,
| 99,
|
| 103,
| 118,
| 123,
| 135,
| 142,
| 160,
| 164,
| 175,
| 183,
|
|
|
| 2,
| 12,
| 23,
| 35,
| 46,
| 59,
| 61,
| 77,
| 86,
| 91,
|
| 104,
| 119,
| 124,
| 134,
| 143,
| 159,
| 165,
| 174,
| 184,
|
|
|
| 3,
| 13,
| 24,
| 36,
| 47,
| 60,
| 62,
| 78,
| 85,
| 92,
|
| 105,
| 120,
| 125,
| 133,
| 144,
| 158,
| 166,
| 173,
| 185,
|
|
|
| 4,
| 14,
| 25,
| 37,
| 48,
| 59,
| 63,
| 79,
| 84,
| 93,
|
| 106,
| 111,
| 126,
| 132,
| 145,
| 157,
| 167,
| 172,
| 186,
|
|
|
| 5,
| 15,
| 26,
| 38,
| 49,
| 58,
| 64,
| 80,
| 83,
| 94,
|
| 107,
| 112,
| 127,
| 131,
| 146,
| 156,
| 168,
| 171,
| 187,
|
|
|
| 6,
| 16,
| 27,
| 39,
| 50,
| 57,
| 65,
| 71,
| 82,
| 95,
|
| 108,
| 113,
| 128,
| 140,
| 148,
| 155,
| 169,
| 180,
| 188,
|
|
|
| 7,
| 17,
| 28,
| 40,
| 41,
| 56,
| 66,
| 72,
| 81,
| 96,
|
| 109,
| 114,
| 129,
| 139,
| 150,
| 154,
| 170,
| 179,
| 189,
|
|
|
| 8,
| 18,
| 29,
| 31,
| 42,
| 55,
| 67,
| 73,
| 90,
| 97,
|
| 110,
| 115,
| 130,
| 138,
| 141,
| 153,
| 161,
| 178,
| 190,
|
|
|
| 9,
| 19,
| 30,
| 32,
| 43,
| 54,
| 68,
| 74,
| 89,
| 98,
|
| 101,
| 117,
| 121,
| 137,
| 142,
| 152,
| 162,
| 177,
| 181,
|
|
|
| 10,
| 20,
| 21,
| 33,
| 44,
| 53,
| 69,
| 75,
| 88,
| 99,
|
| 102,
| 118,
| 122,
| 136,
| 143,
| 151,
| 163,
| 176,
| 182,
|
|
|
| 1,
| 12,
| 23,
| 35,
| 45,
| 52,
| 70,
| 76,
| 87,
| 100,
|
| 103,
| 119,
| 123,
| 135,
| 144,
| 153,
| 164,
| 175,
| 183,
|
|
|
| 2,
| 13,
| 24,
| 36,
| 46,
| 51,
| 61,
| 77,
| 86,
| 91,
|
| 104,
| 120,
| 124,
| 134,
| 145,
| 155,
| 165,
| 174,
| 184,
|
|
|
| 3,
| 14,
| 25,
| 37,
| 47,
| 52,
| 62,
| 78,
| 85,
| 92,
|
| 105,
| 111,
| 125,
| 133,
| 146,
| 157,
| 166,
| 173,
| 185,
|
|
|
| 4,
| 15,
| 26,
| 38,
| 48,
| 53,
| 65,
| 79,
| 84,
| 93,
|
| 106,
| 112,
| 126,
| 132,
| 147,
| 159,
| 167,
| 172,
| 186,
|
|
|
| 5,
| 16,
| 27,
| 39,
| 49,
| 54,
| 66,
| 80,
| 83,
| 94,
|
| 107,
| 113,
| 127,
| 131,
| 148,
| 152,
| 168,
| 171,
| 187,
|
|
|
| 6,
| 17,
| 28,
| 40,
| 50,
| 55,
| 67,
| 79,
| 82,
| 95,
|
| 108,
| 114,
| 128,
| 139,
| 149,
| 154,
| 169,
| 172,
| 188,
|
|
|
| 7,
| 18,
| 29,
| 31,
| 41,
| 56,
| 68,
| 78,
| 81,
| 96,
|
| 109,
| 115,
| 129,
| 138,
| 150,
| 156,
| 170,
| 173,
| 189,
|
|
|
| 8,
| 19,
| 30,
| 32,
| 42,
| 57,
| 69,
| 77,
| 82,
| 97,
|
| 110,
| 116,
| 130,
| 137,
| 149,
| 158,
| 169,
| 174,
| 190,
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 9,
| 20,
| 21,
| 33,
| 43,
| 58,
| 70,
| 76,
| 83,
| 98,
|
| 101,
| 117,
| 129,
| 136,
| 148,
| 160,
| 168,
| 175,
| 189,
|
|
|
| 10,
| 11,
| 22,
| 34,
| 44,
| 59,
| 61,
| 75,
| 84,
| 99,
|
| 102,
| 118,
| 128,
| 135,
| 147,
| 151,
| 167,
| 176,
| 188,
|
|
|
| 1,
| 13,
| 25,
| 35,
| 45,
| 60,
| 62,
| 74,
| 85,
| 100,
|
| 103,
| 119,
| 127,
| 134,
| 146,
| 152,
| 166,
| 177,
| 187,
|
|





 , а не ионы
, а не ионы  , так как потенциал восстановления в нейтральной среде кислорода будет
, так как потенциал восстановления в нейтральной среде кислорода будет  а ионов водорода
а ионов водорода  и
и  >
>  а
а  <
< 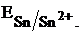

 можно использовать никель
можно использовать никель  , медь
, медь  , серебро
, серебро  золото
золото 
 .
.
 При нарушении такого покрытия основной металл становится катодом коррозионного элемента, на котором идет процесс восстановления окислителя (выделение водорода или поглощения кислорода), а металл покрытия – анодом, на котором идет процесс его окисления (растворения).
При нарушении такого покрытия основной металл становится катодом коррозионного элемента, на котором идет процесс восстановления окислителя (выделение водорода или поглощения кислорода), а металл покрытия – анодом, на котором идет процесс его окисления (растворения). более отрицательный, чем потенциал цинка
более отрицательный, чем потенциал цинка 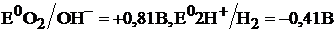 .
.
 а потенциал меди,
а потенциал меди,  поэтому при нарушении покрытая олово становится анодом, как его потенциал более отрицательнее, и на нем будет протекать процесс окисления олова:
поэтому при нарушении покрытая олово становится анодом, как его потенциал более отрицательнее, и на нем будет протекать процесс окисления олова:






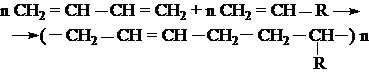
 – (бутадиен – стирольный каучук),
– (бутадиен – стирольный каучук), (n-1)Н2О + Н – [–О – (СН2)6 –СО –]n – ОН
(n-1)Н2О + Н – [–О – (СН2)6 –СО –]n – ОН


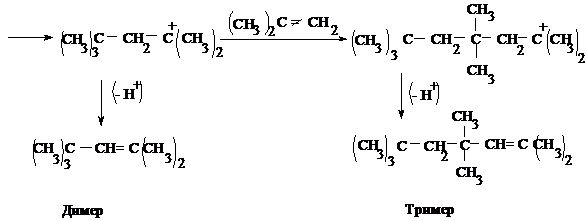

 .
.


