Абсолютное значение разности потенциалов на границе двух фаз разной природы металл│электролит измерить нельзя, однако можно измерить электродвижущую силу (ЭДС, ЕГЭ) гальванического элемента, которая определяется
разностью электродных потенциалов полуэлементов составляющих редокс – систему
Если электродный потенциал одного из электродов,
выбранного эталонным, принять за нуль, то электродный потенциал другого будет равен ЭДС этого гальванического элемента.
Таким эталонным электродом был выбран водородный электрод в стандартных условиях.
Его устройство таково: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль × л–1, обдувается струей газообразного водорода под давлением 1,013×105Па.
Платиновая чернь адсорбирует водород, который электрохимически взаимодействует с раствором по уравнению:
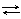 H2(газ) 2H+ + 2
H2(газ) 2H+ + 2 
Таким образом, стандартный электродный потенциал 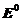 (вольт, В) – численно равен ЭДС гальванического элемента, содержащего в качестве электрода сравнения стандартный водородный электрод, а в качестве другого электрода − измеряемый электрод при активностях всех реагентов окислительно-восстановительного процесса, равных 1 моль/л, и температуре 298 К
(вольт, В) – численно равен ЭДС гальванического элемента, содержащего в качестве электрода сравнения стандартный водородный электрод, а в качестве другого электрода − измеряемый электрод при активностях всех реагентов окислительно-восстановительного процесса, равных 1 моль/л, и температуре 298 К
(–) Pt, H2 |2H+ ||Mn+ |M (+).
При измерении стандартных электродных потенциалов редокс-систем водородный электрод сравнения всегда занимает место анода (восстановителя), измеряемые электроды − место катода (окислителя).
Электрод сравнения Измеряемый электрод
(–) Pt, H2 |2H+ ||о.ф.о.|в.ф.о. (+), т.е.
На исследуемом электроде (катоде) происходит полуреакция восстановления: о.ф.о + nē → в.ф.о.
Измеренные таким образом стандартные электродные потенциалы Е0о.ф.о./в.ф.о. отражают катодную реакцию и характеризуют окислительную способность (присоединять ē) измеряемого электрода. Полученные экспериментальные значения имеют знаки плюс (например, Е Си2+/Си = + 0,34 В) и минус (E0Zn2+/Zn = -0,76 B).
Знак (-) говорит о том, что данный электрод не проявляет по отношению к водородному электроду окислительных свойств и, стало быть, в приведенном примере пара Zn│Zn2+ фактически является анодом (восстановителем). В общем случае электрод с относительно более положительным значением стандартного электродного потенциала является окислителем по отношению к электроду с менее положительным значением Е 0, и в гальваническом элементе он будет играть роль катода (раздел 7.5.).
Чем больше электродный потенциал, тем сильнее выражены окислительные свойства данной электродной пары.
Чем больше разница в электродных потенциалах катода и анода, тем выше ЭДС (ЕГЭ): ЕГЭ = Е кат – Е ан
Все стандартные электродные потенциалы сведены в таблицы и содержат в себе катодные реакции.
Значения некоторых стандартных электродных потенциалов в порядке их возрастания, представлены в табл. 7.1.
Уравнение Нернста
Поскольку реальные растворы электролитов могут иметь самые разные концентрации и активности, влияющие на электродный потенциал, необходимо это учитывать при работе в нестандартных условиях. Зависимость электродного
потенциала от активностей ионов в растворе и от температуры описывается уравнением Нернста.
Выведем эту зависимость на примере гальванического элемента, состоящего из стандартного водородного и медного электрода с произвольной концентрацией Сu2+.
(–) Pt, H2 |2H+ ||Cu2+ |Cu (+).
Реакции на аноде и катоде:
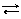
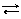 (-): H2(газ) - 2
(-): H2(газ) - 2  2H+ (+): Сu2++ 2 ē Cu
2H+ (+): Сu2++ 2 ē Cu
Т а б л и ц а 7.1
Стандартные электродные потенциалы, E0, B
| Окисленная форма
| + n
| Восстановленная форма
| E0, B
|
| Na+
| 1
| Na
| –2,71
|
| Zn2+
| 2
| Zn
| –0,76
|
| Cr3+
| 3
| Cr
| –0,74
|
| Fe(OH)3
| 1
| Fe(OH)2 + OH–
| –0,53
|
| Fe2+
| 2
| Fe
| –0,44
|
| Cd2+
| 2
| Cd
| –0,40
|
| PbSO4
| 2
| Pb +SO42–
| –0,359
|
| Co2+
| 2
| Co
| –0,29
|
| Ni2+
| 2
| Ni
| –0,23
|
| Sn2+
| 2
| Sn
| –0,14
|
| Pb2+
| 2
| Pb
| –0,13
|
| 2H+
| 2 
| H2
| 0,00
|
| NO3-+H2O
| 2
| NO2-+2OН-
| +0,01
|
| Ti4+
| 1
| Ti3+
| +0,04
|
| Sn4+
| 2
| Sn2+
| +0,15
|
| SO42-+2H+
| 2
| SO32-+H2O
| +0,17
|
| Cu2+
| 2
| Cu
| +0,34
|
| [Fe(CN)6]3-
| 1
| [Fe(CN)6]4-
| +0,358
|
| Ni(OH)3
| 1
| Ni(OH)2 +OH–
| +0,49
|
| I2
| 2ē
| 2I-
| +0,54
|
| MnO4-
| 1
| MnO42-
| +0,56
|
| MnO4-+2H2O
| 3
| MnO2+4OH-
| +0,60
|
| Fe3+
| 1
| Fe2+
| +0,77
|
| Ag
| 1
| Ag+
| +0,80
|
| NO3-+4H+
| 3
| NO+2H2O
| +0,96
|
| Br2
| 2
| 2Br-
| +1,07
|
| Cl2
| 2
| 2Cl-
| +1,36
|
| Cr2O72-+14H+
| 6
| 2Cr3++7H2O
| +1,37
|
| MnO4-+8H+
| 5
| Mn2++4H2O
| +1,51
|
| H2O2+2H+
| 2
| 2H2O
| +1,77
|
| PbO2+SO42-+4H+
| 2
| PbSO4+2H2O
| 1,685
|
Для суммарной токообразующей реакции:
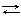 Сu2+ + H2 Cu + 2H+ запишем уравнение изотермы Вант-Гоффа
Сu2+ + H2 Cu + 2H+ запишем уравнение изотермы Вант-Гоффа 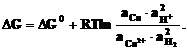 (7.1)
(7.1)
Энергиия Гиббса (DG) токообразующей реакции cвязана с ЭДС ГЭ формулой: DG = – nFE,
где F - число Фарадея1), равное 96500 Кл/моль;
n - число (моль) электронов, участвующих в электрохимическом процессе.
Вывод этой зависимости основан на следующих положениях:
1. ХИТ обычно работают в изобарно-изотермических условиях (т. е. при постоянных давлении р и температуре Т). Для этих условий максимально возможная работа, которая может быть получена в системе при обратимом протекании химической реакции Аmax, равна уменьшению свободной энергии (энергии Гиббса, ΔG) системы для этой реакции:
Аmax = -∆G (7.2)
2. С другой стороны, максимальная работа, которую можно получить от гальванического элемента, AГЭmax равна произведению ЭДС элемента ЕГЭ на количество электричества qГЭ:
AГЭmax = ЕГЭ∙qГЭ (7.3)
По объединенному закону Фарадея при электрохимическом превращении вещества через систему протекает количество электричества, равное произведению числа молей электронов n на число Фарадея F, т,е.
q = n∙F (7.4)
Приравнивая максимальную работу химической реакции (7.2) и максимальную электрическую работу (7.3) с учетом (7.4)), получим нужную формулу: DG = – nFE.
Подставим в уравнение (7.1) вместо DG равную величину (– nFE) и разделим обе части на (– nF).
Далее введём в уравнение численные значения F, R и T=298K и перейдём от натуральных логарифмов к десятичным. С учётом того, что для стандартного водородного электрода активности ионов H+ и газа H2 равны 1, а 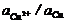 =
=  , .получим удобную для расчётов общепринятую форму уравнения Нернста для отдельного электрода, отражающего зависимость электродного потенциала от концентраций (активностей) реагентов.
, .получим удобную для расчётов общепринятую форму уравнения Нернста для отдельного электрода, отражающего зависимость электродного потенциала от концентраций (активностей) реагентов.
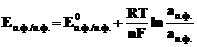 , (7.5)
, (7.5)
Принятая запись Eо.ф./в.ф. соответствует условиям, при которых определялись стандартные электродные потенциалы, т.е. катодной реакции: о.ф. → в.ф. (Сu2+ → Cu).
Активность твердого вещества принимается равной единице, поэтому в случае рассматриваемого нами металлического медного электрода уравнение Нернста упрощается:
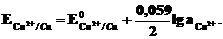
Вещества, входящие под знак логарифма, являются потенциалопределяющими, а электрод считается обратимым по отношению к соответствующему иону.
Так, в медном электроде катионы Сu2+ будут потенциалопределяющими, а электрод обратим по отношению к катиону.
Подведём некоторые итоги:
− уравнение Нернста для отдельного электрода условились писать для процесса восстановления (+ nē) независимо от того, в какую сторону сдвинуто равновесие, то есть под знаком логарифма в уравнении Нернста в числителе стоит окисленная форма реагента, в знаменателе – восстановленная.
− в дробном индексе при E и E0 над чертой ставится окисленная форма реагента, под чертой – восстановленная.
− активности твердых веществ в уравнение Нернста не входят.
Типы электродов
Многочисленные ХИТ могут быть составлены из двух электродов (полуэлементов, электродных пар). По типу потенциалопределяющей реакции (окислительно-восстанови-тельного электродного процесса) электроды делят на первого и второго рода - электроды с электрохимической реакцией) и ионоселективные - без электрохимической реакции.
К электродам первого рода относятся электроды, в уравнение Нернста которых под знак логарифма входят активности веществ, участвующих в электродном процессе. Потенциал таких электродов меняется с изменением концентрации реагентов.
Электродами первого рода являются:
1. Электроды, состоящие из элементарного вещества, находящегося в контакте с раствором, содержащим его собственные ионы.
а) Металлический электрод – металл, погруженный в раствор своей соли М½Мn+, например, цинковый и медный электроды:
 Zn½Zn2+ Zn Zn2+ + 2
Zn½Zn2+ Zn Zn2+ + 2 
 Cu½Cu2+ Cu Cu2+ + 2
Cu½Cu2+ Cu Cu2+ + 2  .
.
Металлический электрод обратим по отношению к катиону. Его электродный потенциал
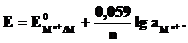
б) Газовый электрод в качестве одного из компонентов электродной пары содержит газ (H2, Cl2 и др.), адсорбированный на химически инертном проводнике первого рода (обычно платина, покрытая платиновой чернью). При контакте адсорбированного газа с раствором собственных ионов устанавливается равновесие. Для хлорного и водородного электродов это равновесие можно представить уравнениями:
Cl2 + 2  = 2Cl-; 2H+ + 2
= 2Cl-; 2H+ + 2  = H2.
= H2.
Соответствующие им уравнения Нернста имеют вид:
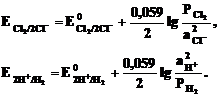
Очевидно, что их электродный потенциал зависит от давления в газовой фазе и активности (концентрации) ионов в растворе. Если давление водорода в газовой фазе поддерживать постоянным и равным 101,325кПа последнее уравнение преобразуется в:

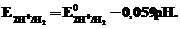
2. Редокс-электроды состоят из инертного по отношению к данному электролиту проводника первого рода (платина, графит и т.д.), погруженного в раствор, в котором находятся одновременно окисленная и восстановленная формы потенциалопределяющего вещества. Такой инертный проводник способствует передаче электронов от восстановителя к окислителю через внешнюю сеть.
Примером редокс-электродов с ионами в различных степенях окисления являются
Pt│ Sn4+, Sn2+; Pt│ Fe3+, Fe2+
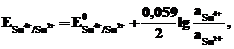
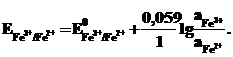
Электроды второго рода представляют собой металлические пластины, покрытые слоем труднорастворимой соли того же металла и опущенные в раствор, содержащий анион этой соли. Его потенциал будет определяться активностью аниона в растворе. Типичным представителемэлектродов второго рода является широко используемый хлорсеребряный электрод.
Хлорсеребряный электрод (ХСЭ) Ag│AgCl½Cl- представляет собой серебряный проводник, покрытый твердым AgCl, который погружен в насыщенный раствор KСl.
Серебро электрохимически взаимодействует со своим ионом:
 Ag+ +
Ag+ +  Ag.
Ag.
Уравнение Нернста для этого процесса
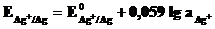 . (7.3)
. (7.3)
Однако в присутствии КCl активность ионов серебра ничтожно мала, но поскольку она связана с легко задаваемой в данной системе активностью ионов Cl -через произведение растворимости хлорида серебра (ПР AgCl = aAg+∙aCl-), то её можно представить в виде:
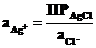 .
.
Подставим это выражение в (7.3):
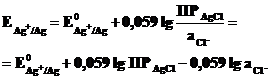
Обозначив 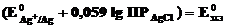 ,
,
получим уравнение Нернста для хлорсеребряного электрода
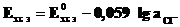 .
.
Потенциалопределяющими здесь являются ионы хлора, а электродный процесс может быть представлен уравнением:
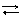 AgClтв +
AgClтв +  Ag + Cl-.
Ag + Cl-.
В уравнение Нернста для электродов 2 рода под знак логарифма входят концентрации веществ, не участвующих в электродном процессе (не меняют степень окисления).
Электроды второго рода обратимы по отношению к аниону, активность которого в растворе можно поддерживать постоянной, что в свою очередь приводит к постоянству электродного потенциала и даёт возможность использовать эти электроды в качестве электродов сравнения.
Если гальванический элемент составлен из электродов второго рода, он обладает высокой стабильностью, его ЭДС не меняется многие годы
Стеклянный электрод для определения концентрации H+ (рН) относится к ионоселективным(мембранным) электродам и состоит из стеклянного тонкостенного шарика (мембраны), припаянного к стеклянной трубке. В шарик налит раствор HCl (внутренний раствор, 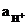 = 0,1 моль×л–1), в который опущен хлорсеребряный электрод. При погружении стеклянного электрода в раствор с измеряемой концентрацией H+ (внешний раствор) между мембраной и исследуемым раствором происходят процессы ионного обмена, приводящие к возникновению разности потенциалов.
= 0,1 моль×л–1), в который опущен хлорсеребряный электрод. При погружении стеклянного электрода в раствор с измеряемой концентрацией H+ (внешний раствор) между мембраной и исследуемым раствором происходят процессы ионного обмена, приводящие к возникновению разности потенциалов.
| Потенциал стеклянного электрода Ag│AgCl│Cl-, Н+равен
|
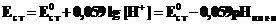 .
.



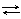 H2(газ) 2H+ + 2
H2(газ) 2H+ + 2 
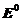 (вольт, В) – численно равен ЭДС гальванического элемента, содержащего в качестве электрода сравнения стандартный водородный электрод, а в качестве другого электрода − измеряемый электрод при активностях всех реагентов окислительно-восстановительного процесса, равных 1 моль/л, и температуре 298 К
(вольт, В) – численно равен ЭДС гальванического элемента, содержащего в качестве электрода сравнения стандартный водородный электрод, а в качестве другого электрода − измеряемый электрод при активностях всех реагентов окислительно-восстановительного процесса, равных 1 моль/л, и температуре 298 К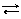
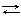 Сu2+ + H2 Cu + 2H+ запишем уравнение изотермы Вант-Гоффа
Сu2+ + H2 Cu + 2H+ запишем уравнение изотермы Вант-Гоффа 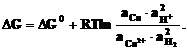 (7.1)
(7.1)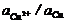 =
=  , .получим удобную для расчётов общепринятую форму уравнения Нернста для отдельного электрода, отражающего зависимость электродного потенциала от концентраций (активностей) реагентов.
, .получим удобную для расчётов общепринятую форму уравнения Нернста для отдельного электрода, отражающего зависимость электродного потенциала от концентраций (активностей) реагентов.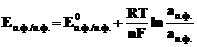 , (7.5)
, (7.5)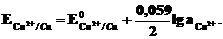
 Zn½Zn2+ Zn Zn2+ + 2
Zn½Zn2+ Zn Zn2+ + 2  Cu½Cu2+ Cu Cu2+ + 2
Cu½Cu2+ Cu Cu2+ + 2 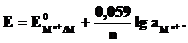
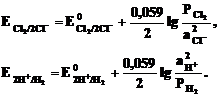

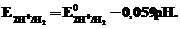
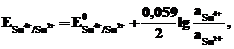
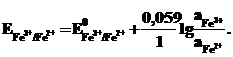
 Ag+ +
Ag+ + 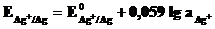 . (7.3)
. (7.3)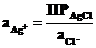 .
.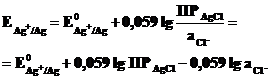
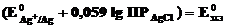 ,
,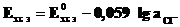 .
.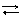 AgClтв +
AgClтв + 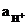 = 0,1 моль×л–1), в который опущен хлорсеребряный электрод. При погружении стеклянного электрода в раствор с измеряемой концентрацией H+ (внешний раствор) между мембраной и исследуемым раствором происходят процессы ионного обмена, приводящие к возникновению разности потенциалов.
= 0,1 моль×л–1), в который опущен хлорсеребряный электрод. При погружении стеклянного электрода в раствор с измеряемой концентрацией H+ (внешний раствор) между мембраной и исследуемым раствором происходят процессы ионного обмена, приводящие к возникновению разности потенциалов.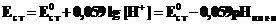 .
.


