Поскольку сильные электролиты диссоциируют практически полностью, можно было бы ожидать, что для них изотонический коэффициент равен количеству ионов (или поляризованных атомов) в формульной единице (молекуле). Однако, в действительности этот коэффициент всегда меньше определённого по формуле. Например, изотонический коэффициент для 0,05-моляльного раствора NaCl равен 1,9 вместо 2,0, для раствора сульфата магния той же концентрации и вовсе − 1,3). Это объясняет теория сильных электролитов: передвижение ионов в растворе затруднено образовавшейся оболочкой сольватации. К тому же, ионы взаимодействуют и между собой: разноимённо заряженные − притягиваются, а одноимённо заряженные — отталкиваются. Силы взаимного притяжения приводят к образованию групп ионов, перемещающихся по раствору совместно. Такие группы называют ионными ассоциатами или ионными па́рами. Соответственно, раствор ведёт себя так, будто содержит меньше частиц, чем на самом деле. Это сказывается, в частности, на его электропроводности.
Экспериментально определенные свойства растворов (Dtкип., Dtзам., p,), зависящие от общего числа частиц растворенного вещества, оказываются меньше рассчитанных в предположении полной диссоциации
Законы Рауля и Вант-Гоффа для таких растворов не выполняются.
Для учета межионных и межмолекулярных взаимодействий в растворе вводят понятие эффективной концентрации – активности (а),которая связана с аналитической концентрацией (С) соотношением
а = g × С, где g – коэффициент активности.
Активность – это мера реального поведения вещества в растворе. Коэффициент активности – характеризует степень отклонения свойств реального раствора от идеального и сложным образом зависит от концентрации.
В концентрированных растворах сильных электролитов он может быть > 1. Так, в 0,5н растворах NaOH, КОН, HCl, H2SO4 g соответственно равен 1,060; 1, 67; 2,38; 2,08.
В разбавленных растворах электролитовкоэффициент активности < 1 и приближается к 1 бесконечно разбавленных (табл. 6.2.).
Коэффициент активности зависит не только от концентрации данного электролита, но и от присутствия других ионов в растворе – ионной силы растворов J (табл. 6.3). Последняя определяется по формуле,
 ,
,
где Ci – концентрация ионов, образующих раствор, моль×л–1; моль×кг–1; Zi – их заряды.
Для водных растворов с J < 0,01 коэффициент активности может быть определен по формуле
 ,
,
а для растворов с 0,01< J<0,5 по формуле:
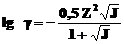 .
.
Таблица 6.2
Значения коэффициентов активности при различных концентрациях электролитов в водных растворах при температуре 20 0С
| Электролит
| Формула
| Коэффициенты активности, g
|
|
| С, моль×л–1
| 0,001
| 0,005
| 0,01
| 0,1
| 0,5
| 1,00
| 2,00
|
| Азотная кислота
| HNO3
| 0,97
| 0,94
| 0,90
| 0,79
| 0,72
| 0,724
| 0,781
|
| Серная кислота
| H2SO4
| 0,83
| 0,70
| 0,54
| 0,27
| 0,16
| 0,137
| 0,132
|
| Cоляная кислота
| HCl
| 0,97
| 0,94
| 0,90
| 0,80
| 0,77
| 0,81
| 1,01
|
| Гидроксид калия
| KOH
| 0,97
| 0,94
| 0,90
| 0,79
| 0,732
| 0,756
| 0,888
|
| Хлорид калия
| KCl
| 0,97
| 0,94
| 0,90
| 0,77
| 0,65
| 0,61
| 0,58
|
| Хлорид меди
| CuCl2
| 0,89
| 0,81
| 0,71
| 0,52
| 0,43
| 0,419
| 0,468
|
| Сульфат меди
| CuSO4
| 0,74
| 0,58
| 0,41
| 0,16
| 0,05
| 0,042
| –
|
| Хлорид натрия
| NaCl
| 0,97
| 0,94
| 0,90
| 0,78
| 0,68
| 0,654
| 0,665
|
| Сульфат цинка
| ZnSO4
| 0,70
| 0,54
| 0,39
| 0,15
| 0,06
| 0,05
| 0,04
|
Следовательно, средний коэффициент активности в разбавленных растворах электролитов зависит только от ионной силы и не зависит от природы ионов, находящихся в растворе.
Таблица 6.3
Коэффициент активности ионов в водных растворах с различной ионной силой.
 Заряд Заряд
| Коэффициенты активности g при J
|
| иона J
|
| 0,001
| 0,002
| 0,005
| 0,01
| 0,05
| 0,1
| 0,2
| 0,5
|
|
|
| 0,97
| 0,95
| 0,93
| 0,90
| 0,81
| 0,76
| 0,70
| 0,62
|
|
|
| 0,87
| 0,81
| 0,74
| 0,66
| 0,44
| 0,33
| 0,24
| 0,15
|
|
|
| 0,73
| 0,63
| 0,51
| 0,39
| 0,15
| 0,08
| 0,04
| 0,014
|
Введение понятия активности позволяет, не выясняя сложной картины взаимодействия частиц в реальных растворах, оценить эффективность этого взаимодействия и использовать применительно к ним законы идеальных растворов и уравнения термодинамики.
 Константа равновесия сильного электролита АВ А+ +В–, вычисленная по активности веществ, называется термодинамической константой Кт в отличие от концентрационной (аналитической) константы К, вычисляемой по концентрациям и может быть записана так:
Константа равновесия сильного электролита АВ А+ +В–, вычисленная по активности веществ, называется термодинамической константой Кт в отличие от концентрационной (аналитической) константы К, вычисляемой по концентрациям и может быть записана так:
 ,
,
где АВ – ионная пара, ассоциат сильного электролита (не молекула!).
Термодинамическая и концентрационная константы связаны соотношением:
 ,
,
т.е. при приближении g ® 1 значения Кт и К сближаются и становятся одинаковыми в бесконечно разбавленных растворах.
Активность и коэффициент активности можно определить различными способами: по электропроводности раствора, по осмотическому давлению, по понижению температуры замерзания и др.



 ,
, ,
,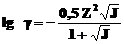 .
. Заряд
Заряд
 Константа равновесия сильного электролита АВ А+ +В–, вычисленная по активности веществ, называется термодинамической константой Кт в отличие от концентрационной (аналитической) константы К, вычисляемой по концентрациям и может быть записана так:
Константа равновесия сильного электролита АВ А+ +В–, вычисленная по активности веществ, называется термодинамической константой Кт в отличие от концентрационной (аналитической) константы К, вычисляемой по концентрациям и может быть записана так: ,
, ,
,


