а) Массовая доля W – отношение массы растворенного вещества к массе раствора.
Если массовая доля выражена в процентах, ее называют массовыми (весовыми) процентами или просто процентной концентрацией.
Процентная концентрация W показывает, сколько граммов растворенного вещества содержится в 100 г раствора.
 % 1
% 1
mВ – масса растворенного вещества, г;
v – объём раствора, мл;
dр – плотность раствора, г∙мл–1;
mр –масса раствора, г.
б) Объёмная доля φ – отношение объёма растворенного вещества к объёму раствора. Выраженная в процентах, она называется объёмными процентами (градусами).
 %
%
в) Мольная доля ХВ – отношение числа молей вещества В к сумме молей всех веществ, составляющих раствор. Мольная доля, выраженная в процентах, называется мольными процентами.
 %
%
II. Размерные концентрации
а ) Моляльная концентрация Сm определяется числом молей nB растворенного вещества в 1 кг растворителя.
 моль · кг–1
моль · кг–1
mB – масса растворенного вещества, г;
mA – масса растворителя, кг;
МВ – молярная масса растворенного вещества, г · моль–1.
б) Молярная концентрация СМ (молярность) определяется числом молей nB растворенного вещества, содержащихся в 1 литре раствора.
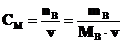 моль·л–1.
моль·л–1.
Растворы, содержащие 1; 0,1; 0,01 … моль растворенного вещества в 1 л раствора, называются соответственно одномолярными, децимолярными, сантимолярными и т.д. и записываются сокращенно 1 М раствор NaOH; 0,1 M раствор NaOH …
в ) Молярная концентрация эквивалента Сэ, называемая также нормальной концентрацией, или нормальностью раствора Сн, определяется количеством эквивалентов n Э растворенного вещества, содержащимся в 1 л раствора.
 моль·л–1
моль·л–1
Раствор, содержащий в 1 л один моль эквивалентов вещества, называется однонормальным 1н; 0,1 моль эквивалентов – децинормальным 0,1н и т.д. Равные объёмы растворов одинаковой нормальности содержат равные эквивалентные количества растворенных веществ.
Используя эквивалентные концентрации, закон эквивалентов (с. 134) nЭ1 = nЭ2 = … можно записать в виде:
Cн(1)·v1 = Cн (1)v(2).
Нормальность и молярность связаны соотношением:
 ;
;  ,
,
т.е. нормальность раствора при Z = 1 равна молярности.
г) Титр раствора по веществу В (ТВ ) определяется массой вещества В, содержащейся в 1 мл раствора.
 г·мл–1.
г·мл–1.
Из определения титра по веществу В для концентраций, выраженных соответственно в массовых %, молярностях и нормальностях можно записать
 г·мл–1
г·мл–1
и использовать это равенство при переводе концентраций из одной размерности в другую.
В химической практике часто приходится готовить растворы заданной концентрации разбавлением более концентрированных (исходных) растворов. Поскольку при разбавлении меняются концентрация и объём раствора (V1, V2, V3…) а масса растворенного вещества остается постоянной (m = T · v = const), будет справедливо равенство:
 ,
,
пользуясь которым можно производить необходимые расчеты при разбавлении растворов заданных концентраций W1, CM, СЭ(Н) соответственно).
Примеры решения задач
1. Рассчитайте титр, молярность, нормальность, моляльность и мольную долю 20% раствора соляной кислоты (d = 1,10 г · мл–1).
Решение:
а)  г · мл–1
г · мл–1
б) 
 моль · л–1
моль · л–1
в)  поскольку
поскольку  ЭHCl = MHCl
ЭHCl = MHCl
г) Мольная доля из определения равна:

или 11 мол.%
д) Так как в 80 г воды содержится 20 г НСl, то моляльная концентрация равна:
 моль · кг–1
моль · кг–1
2. На нейтрализацию 25 мл раствора серной кислоты израсходовано 10 мл 0,1н раствора гидроксида натрия. Вычислите нормальность и титр раствора Н2SO4.
Решение:
а) Исходя из закона эквивалентов (с.) nЭ1 = nЭ2 = …, можно записать:
Cн(Н2SO4) · v Н2SO4= Cн(NaOH) · v NaOH
Cн (Н2SO4)  моль · л–1
моль · л–1
б)  г · мл–1.
г · мл–1.
3. Какой объём 98% раствора серной кислоты (d = 1,84 г · мл–1) необходимо взять, чтобы приготовить 2л 35% раствора плотностью 1,26 г · мл–1 для заполнения свинцового аккумулятора?
Решение:

 мл,
мл,
т.е. для получения 2 л раствора Н2SO4 заданной концентрации надо 489 мл исходного раствора осторожно при помешивании прилить к 1511 мл дистиллированной воды (посуда термостойкая).
4.Какова нормальность раствора серной кислоты, полученного разбавлением 10 мл 98% раствора (d = 1,84 г · мл–1) до 1 литра?
Решение:

 г · моль–1
г · моль–1
 моль·л–1
моль·л–1
Вопросы для самопроверки
1. Дайте определение моля, молярной массы.
2. Дайте определение эквивалента. Как связаны между собой моль (молярная масса) и эквивалент (эквивалентная масса)?
3. Как можно выразить титр через процентную, молярную концентрации? Как связаны между собой эквивалентная (нормальность) и молярная (молярность) концентрации?
4. Имеется 0,2 М раствор K2СrO4. Какова его нормальная (эквивалентная) концентрация в реакции
СrO42– + 3ē + 8 H+ → Cr3+ + 4 H2O?
5. Используя формулы для титра, определите:
нормальность 18% раствора HCl (d =1,08 г · мл–1);
молярность 11% раствора КОН (d = 1,10 г · мл–1).
6. Сколько мл 11% раствора КОН (d = 1,10 г · мл–1) потребуется для приготовления 500 мл 0,1 М раствора?
7. Какие из способов выражения концентрации следует выбрать, чтобы она не менялась с изменением температуры?
8. На титрование 10 мл раствора NaCl израсходовано 5 мл 0,1 М раствора AgNO3. Какова нормальность NaCl?
5.4. Методы определения концентрации растворов
Концентрацию растворов можно установить различными методами.
Химические методы анализа основаны на способности вещества вступать в химические взаимодействия. Физическиеметоды основаны на измерении каких-либо параметров веществ (плотности, показателя преломления, угла вращения плоскости поляризации и т.д.). Физико-химические методы основаны на наблюдении за изменениями физических свойств веществ, которые происходят в результате химической реакции (колориметрия, кондуктометрия, потенциометрия, хроматография и т.д.).
В нашем практикуме предлагается два метода определения концентраций растворов.
Фотоколориметрическое определение концентрации относится к оптическим методам физико-химического анализа и основано на измерении интенсивности светового потока, прошедшего через окрашенный раствор. Окрашенные растворы в некотором интервале концентраций подчиняются закону Бугера-Ламберта-Бера:
It = Iо·10–ε∙ℓ∙с,
где Iо – интенсивность падающего светового потока;
It – интенсивность светового потока, прошедшего через поглощающий слой;
ε – молярный коэффициент поглощения при данной длине волны (коэффициент экстинкции), зависит от природы вещества;
ℓ – толщина поглощающего слоя, см;
с – концентрация раствора, моль · л–1.
Уравнение в логарифмической форме имеет вид:
 ε∙ℓ∙с = D.
ε∙ℓ∙с = D.
Величину  называют оптической плотностью D. При постоянной толщине поглощающего слоя ℓ оптическая плотность зависит только от концентрации раствора.
называют оптической плотностью D. При постоянной толщине поглощающего слоя ℓ оптическая плотность зависит только от концентрации раствора.
При определении концентрации какого-либо окрашенного раствора фотоколориметрическим методом сначала измеряют оптическую плотность серии растворов данного вещества с известными концентрациями и строят график зависимости оптической плотности от концентрации для данного прибора – так называемый калибровочный график. Измерив оптическую плотность исследуемого раствора, по калибровочному графику находят его концентрацию.
Рефрактометрический метод анализа основан на определении концентрации вещества путем измерения показателя преломления света. Преломлением или рефракцией называют изменение направления прямолинейного распространения света при переходе из одной среды в другую при пересечении границы раздела двух прозрачных однородных сред. Отношение синусов углов падения и преломления – величина постоянная для каждого вещества, её называют показателем преломления: 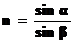 .
.
Показатель преломления связан с удельной рефракцией r соотношением  ; отсюда и название метода.
; отсюда и название метода.
Показатель преломления зависит от природы и плотности вещества, его концентрации, температуры и длины волны падающего света. При прочих равных условиях показатель преломления пропорционален только концентрации вещества. В справочниках приведены значения показателей преломления при 20оС для желтой линии в спектре натрия λ = 589,3 нм (линия D). Соответственно они обозначаются nD20. Для измерения показателей преломления применяются рефрактометры, работающие на принципе измерения предельного угла преломления. Рефрактометрическое определение концентрации сходно с фотоколориметрическим. Сначала строится график зависимости «состав – показатель преломления» при определенной температуре для исследуемой системы. Затем с помощью этого градуировочного графика по показателю преломления, определенному при той же температуре, находят состав исследуемого раствора.
Показатели преломления nD20 основных растворителей имеют следующие значения: вода – 1,3333; этанол – 1,3613; ацетон – 1,3591; хлороформ – 1,4456.
Экспериментальная часть
5.5а. Определение концентрации раствора сульфата меди (II) фотоколориметрическим методом.
В мерную колбу на 25 мл отмерьте из бюретки 1 – 10 мл (по указанию преподавателя) раствора CuSO4неизвестной концентрации, прилейте 10 мл 10%-ного раствора NH4OHи дистиллированной воды до метки. Закройте пробкой и тщательно перемешайте. Реакция идет согласно уравнению:
CuSO4+ 4 NH4OH= [Cu(NH3)4]SO4+ 4 H2O
или в ионном виде:
Cu2++ 4 NH3 · H2O= [Cu(NH3)4]2+ + 4 H2O.
После десятиминутной выдержки (для установления химического равновесия) измерьте на фотоколориметре оптическую плотность окрашенного раствора, используя в качестве раствора сравнения дистиллированную воду. По калибровочному графику к прибору найдите количество Сu2+в растворе. Рассчитайте титр приготовленного и исходного растворов. Результаты оформите в виде таблицы:
| Количество мл раствора, заданное преподавателем, v, мл
| Оптическая плотность раствора,
D
| Количество Cu2+в раство-ре (г в 25 мл), определенное по оптической плотности, g, г
| Титр приготов-ленного раствора,  ,г·мл-1 ,г·мл-1
| Титр исхоного раст-вора,  , г·мл-1 , г·мл-1
|
|
|
|
|
|
|
5.5б. Определение концентрации раствора сульфата железа (III) фотоколориметрическим методом
В мерную колбу на 25 мл отмерьте из бюретки 2 –14 мл (по указанию преподавателя) раствора Fe2(SO4)3 неизвестной концентрации, прилейте 10 мл 10%-ного раствора роданистого аммония NH4NCS, долейте до метки дистиллированной водой, закройте пробкой и тщательно перемешайте.
В упрощенном виде данная реакция может быть записана следующим образом:
Fe2(SO4)3 + 6 NH4NCS = 2 Fe(NCS)3 + 3 (NH4)2SO4.
После десятиминутной выдержки (для установления химического равновесия) окрашенный раствор фотоколориметрируйте, используя в качестве раствора сравнения дистиллированную воду.
Определив оптическую плотность, по градуировочному графику к прибору найдите количество Fe3+в растворе. Рассчитайте титры растворов, приготовленных для фотоколориметрирования и исходного.
Результаты оформите в виде таблицы:
| Количество мл раствора, заданное преподавателем,
v, мл
| Оптическая плотность раствора,
D
| Количество Cu2+в раст-воре (г в 25 мл), опреде-ленное по оп-тич. плотно-сти, g,г
| Титр приготов-ленного раствора,  , г·мл-1 , г·мл-1
| Титр исходного раствора,  , г·мл-1 , г·мл-1
|
|
|
|
|
|
|
5.5в. Рефрактометрическое определение концентрации растворенного вещества
Работа выполняется на рефрактометре (правила работы указаны в инструкции к прибору).
Измерьте показатели преломления растворов известных концентраций. Данные запишите в таблицу:
| № исслед. раствора
|
|
|
|
|
|
|
| Процентная (массовая) концентрация W, %
|
|
|
|
|
|
|
| Показатель преломления, nD20
|
|
|
|
|
|
|
Постройте калибровочный график зависимости показателя преломления nD20 от концентрации для данной системы nD20(W).
Получите контрольную задачу, измерьте показатель преломления и определите по калибровочному графику концентрацию контрольного раствора. Рассчитайте молярную концентрацию контрольной задачи.



 % 1
% 1 %
% %
% моль · кг–1
моль · кг–1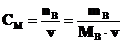 моль·л–1.
моль·л–1. моль·л–1
моль·л–1 ;
;  ,
, г·мл–1.
г·мл–1. г·мл–1
г·мл–1 ,
, г · мл–1
г · мл–1
 моль · л–1
моль · л–1 поскольку
поскольку  ЭHCl = MHCl
ЭHCl = MHCl
 моль · кг–1
моль · кг–1 моль · л–1
моль · л–1 г · мл–1.
г · мл–1.
 мл,
мл,
 г · моль–1
г · моль–1 моль·л–1
моль·л–1 ε∙ℓ∙с = D.
ε∙ℓ∙с = D. называют оптической плотностью D. При постоянной толщине поглощающего слоя ℓ оптическая плотность зависит только от концентрации раствора.
называют оптической плотностью D. При постоянной толщине поглощающего слоя ℓ оптическая плотность зависит только от концентрации раствора.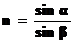 .
. ; отсюда и название метода.
; отсюда и название метода. ,г·мл-1
,г·мл-1
 , г·мл-1
, г·мл-1



