Кинетика химических реакций. Ферментативный катализ. Химическое равновесие. Условия смещения равновесия.
План:
1. Скорость реакции. Зависимость скорости реакции от концентрации. Константа скорости. Порядок реакции. Период полураспада.
2. Зависимость скорости реакции от температуры. Правило Вант - Гоффа.
3. Зависимость скорости реакции от природы веществ. Энергия активации. Понятие о теории активного комплекса. Катализ и катализаторы. Особенности действия катализаторов. Гомогенный и гетерогенный катализ. Кислотно-основный катализ. Автокатализ. Промоторы и каталитические яды.
4. Ферменты как биологические катализаторы. Особенности действия ферментов.
5. Закон действующих масс для скорости химической реакции. Константа равновесия. Сдвиг химического равновесия. Правило ЛеШателье. Стационарное состояние организма – гомеостаз.
1. Химическая кинетика – учение о скоростях и механизмах химических реакций. Основное понятие кинетики – скорость химической реакции (vх.р.).
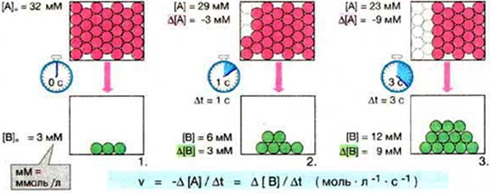 Скорость химической реакции определяется числом частиц (т.е. количеством вещества), прореагировавших за единицу времени в единице объема. Т.к. количество вещества в единице объема (
Скорость химической реакции определяется числом частиц (т.е. количеством вещества), прореагировавших за единицу времени в единице объема. Т.к. количество вещества в единице объема (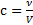 ) – это молярная концентрация, то можно сказать, что скорость - это изменение концентрации вещества за единицу времени.
) – это молярная концентрация, то можно сказать, что скорость - это изменение концентрации вещества за единицу времени. 
От чего зависит скорость химической реакции? Чтобы ответить на этот вопрос надо понимать, что для того чтобы реакция произошла, надо чтобы частицы столкнулись. Поэтому между газами реакции происходят быстрее, чем между двумя жидкими веществами и т.д. Кроме того, чем больше частиц в единице объема, тем вероятнее их столкновения. Чем больше их скорость, тем тоже вероятнее их столкновения. Т.е. скорость зависит от концентрации исходных веществ и температуры.
Итак: Основное понятие химической кинетики – скорость химической реакции. Она зависит от природы вещества (энергии активации), концентрации и температуры. Энергетический барьер энергии активации можно преодолеть с помощью катализа. Все реакции в живых организмах проходят при участии ферментов - биохимических катализаторов и, поэтому, имеют ряд особенностей. В состоянии химического равновесия (при не изменяющихся параметрах) система подчиняется закону действующих масс, смещение равновесия при изменении параметров определяется принципом ЛеШателье. Живые организмы существуют в состоянии гомеостаза.
Упражнения.
№1 Выпишите в тетрадь основные понятия химической кинетики и выучите их.
№2 Почему скорость реакции очень сильно зависит от температуры? Как именно?
№3 Когда скорость химических реакций зависит от давления?
№4 Почему скорость большинства химических реакций уменьшается с течением времени?
№5 Что такое скорость химической реакции? Перечислите факторы, от которых зависит скорость химической реакции.
№6 В растворе протекает реакция А + В = 2С. Исходная концентрация вещества А (СА) равно 0,80 моль/л, начальная концентрация вещества В равно 1,00 моль/л. Через 20 мин концентрация вещества А (СА*) стала 0,75 моль/л. Какова стала концентрация вещества В и С? Чему равна средняя скорость реакции за это время?
№7 Измениться ли скорость реакции между водородом и кислородом, если в их смесь (сохранив температуру и общее давление) ввести азот? Ответ поясните.
№8 Химическая реакция протекает по уравнению 2Н2 +О2 = 2Н2О. Запишите кинетическое уравнение для этой реакции. Как изменится скорость реакции если А) концентрацию кислорода увеличить в 3 раза? Б) концентрацию водорода увеличить в 3 раза?
№9 Запишите кинетическое уравнение для прямой и обратной реакции. Какого порядка эти реакции? А) 2С(тв) + О2(г) ↔ 2СО (г) Б) 2NH3(г) ↔ N2(г) + 3H2(г)
№10 При 300С скорость реакции 0,01моль/л мин. Чему она будет равна А) при 00С? Б) при 600С? Температурный коэффициент реакции равен 3.
№11 Почему для хранения лекарств и биопрепаратов используют холодильники?
№12 Почему все биохимические анализы проводят при 37-390С?
№13 Почему для длительного хранения продуктов используют маринады, в состав которых входит кислота?
№14 Напишите математическое выражение для константы равновесия процессов:
А) 2NH3(г) ↔N2(г) + 3H2(г) ΔН = + 92,4 кДж
Б) H2(г)+ S(тв) ↔ H2S(г) ΔН = - 21 кДж
Какое из равновесий не будет смещаться при изменении давления? Куда сдвинется равновесие при увеличении концентрации водорода?
Как надо изменить температуру, стобы равновесие сдвинуть к продуктам реакции?
№15 Пользуясь схемой ответа определите в какую сторону будет смещаться равновесие в системе:
А) 2SO2(г) + O2(г)↔ 2SO3(г)ΔН = -196,6 кДж
Б) I2(г) + H2(г)↔ 2HI(г) ΔН = +50,8 кДж
В) O2(г) + 2C(тв)↔2CO(г) ΔН = -221 кДж
Г) CO2(г) +C(тв)↔ 2CO(г) ΔН = +172 кДж
В этом процессе 1) в прямой реакции концентрация вещества (формула!) (увеличивается, уменьшается), потому что это вещество (вступает в реакцию и расходуется; образуется в ходе реакции); в обратной реакции наоборот… 2) в прямой реакции тепло (выделяется, поглощаетс) т.к. реакция (экзотермическая, эндотермическая), потому что (ΔН < 0, ΔН > 0). А в обратной реакции наоборот… 3) в прямой реакции число газовых молекул (не изменяется, увеличивается, уменьшается), поэтому давление (не изменяется, увеличивается, уменьшается). В обратной реакции… 4) По принципу ЛеШателье если повысить температуру (↑t), то система стремиться понизить температуру и для этого увеличивает скорость (прямой, обратной) реакции, и равновесие сдвигается в сторону (исходных веществ, продуктов реакции). Если увеличить концентрацию О2(Н2, СО, СО2), то система стремиться понизить эту концентрацию и для этого увеличивает скорость (прямой, обратной) реакции, и равновесие сдвигается в сторону (исходных веществ, продуктов реакции). Если уменьшить давление, то то система стремиться увеличить давление и для этого увеличивает скорость (прямой, обратной) реакции, и равновесие сдвигается в сторону (исходных веществ, продуктов реакции).
Кинетика химических реакций. Ферментативный катализ. Химическое равновесие. Условия смещения равновесия.
План:
1. Скорость реакции. Зависимость скорости реакции от концентрации. Константа скорости. Порядок реакции. Период полураспада.
2. Зависимость скорости реакции от температуры. Правило Вант - Гоффа.
3. Зависимость скорости реакции от природы веществ. Энергия активации. Понятие о теории активного комплекса. Катализ и катализаторы. Особенности действия катализаторов. Гомогенный и гетерогенный катализ. Кислотно-основный катализ. Автокатализ. Промоторы и каталитические яды.
4. Ферменты как биологические катализаторы. Особенности действия ферментов.
5. Закон действующих масс для скорости химической реакции. Константа равновесия. Сдвиг химического равновесия. Правило ЛеШателье. Стационарное состояние организма – гомеостаз.
1. Химическая кинетика – учение о скоростях и механизмах химических реакций. Основное понятие кинетики – скорость химической реакции (vх.р.).
 Скорость химической реакции определяется числом частиц (т.е. количеством вещества), прореагировавших за единицу времени в единице объема. Т.к. количество вещества в единице объема (
Скорость химической реакции определяется числом частиц (т.е. количеством вещества), прореагировавших за единицу времени в единице объема. Т.к. количество вещества в единице объема (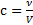 ) – это молярная концентрация, то можно сказать, что скорость - это изменение концентрации вещества за единицу времени.
) – это молярная концентрация, то можно сказать, что скорость - это изменение концентрации вещества за единицу времени. 
От чего зависит скорость химической реакции? Чтобы ответить на этот вопрос надо понимать, что для того чтобы реакция произошла, надо чтобы частицы столкнулись. Поэтому между газами реакции происходят быстрее, чем между двумя жидкими веществами и т.д. Кроме того, чем больше частиц в единице объема, тем вероятнее их столкновения. Чем больше их скорость, тем тоже вероятнее их столкновения. Т.е. скорость зависит от концентрации исходных веществ и температуры.



 Скорость химической реакции определяется числом частиц (т.е. количеством вещества), прореагировавших за единицу времени в единице объема. Т.к. количество вещества в единице объема (
Скорость химической реакции определяется числом частиц (т.е. количеством вещества), прореагировавших за единицу времени в единице объема. Т.к. количество вещества в единице объема (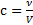 ) – это молярная концентрация, то можно сказать, что скорость - это изменение концентрации вещества за единицу времени.
) – это молярная концентрация, то можно сказать, что скорость - это изменение концентрации вещества за единицу времени. 


