Для выполнения опыта необходимы: универсальный иономер ЭВ-74, технические весы и разновесы, стаканы емкостью 100 мл, фарфоровые чашки, мерные цилиндры, раствор хлорида калия 1 н, набор проб почв, пропущенных через сито с отверстиями диаметром 1 мм.
В агрохимических и почвенных лабораториях определяют как рН водной вытяжки из почвы (актуальную кислотность), так и рН вытяжки из 1 н раствора хлорида калия (особенную кислотность). Но рН водной вытяжки из почвы – величина неустойчивая, меняющаяся в течение вегетационного периода. Поэтому чаще определяют рН солевой вытяжки из почвы, значение которого обычно ниже, чем в водной вытяжке из той же почвы. По рН солевой вытяжки судят о степени ее кислотности и необходимости известкования. Считают, что при рН 3…4 – почва кислая; рН 5…6 – слабокислая; рН 7 – нейтральная; рН 7…8 – слабощелочная; рН 8…9 – щелочная. Почвы с рН солевой вытяжки меньше 4…5 нуждаются в известковании.
В соответствии со своим вариантом получить у преподавателя пробу почвы.
Приготовление водной суспензии. На технических весах отвесить 10 г воздушно-сухой почвы. Навеску поместить в колбу емкостью 50…100 мл и прилить 25 мл дистиллированной воды, рН которой 6,6…6,8. Колбу плотно закрыть чистой пробкой, встряхивать 5 минут и оставить стоять 24 часа, после чего слить оставшийся раствор (или отобрать его пипеткой) для определения рН.
Приготовление солевой вытяжки. На технических весах отвесить 10 г воздушно-сухой почвы, пропущенной через сито с отверстиями диаметром 1 мм и поместить в сухую чистую емкость объемом 10 мл.
Прилить 50 мл 1 н раствора КСl, закрыть чистой пробкой, энергично встряхивать 5 минут и оставить стоять 24 часа. По истечении срока отстаивания взять пипеткой часть раствора и определить рН.
Вопросы для самоконтроля и повторения
1. Дать определение водородного показателя реакции среды. Диапазон значения рН для кислой, основной и нейтральной сред.
2. Дать определения процессу гидролиза. Является ли гидролиз экзо- или эндотермическим процессом?
3. Какие существуют случаи гидролиза в соответствии с типом солей?
4. Как определяется степень гидролиза?
5. Ответьте на следующие вопросы по гидролизу соли, выданной преподавателем:
Подвергается соль гидролизу и почему?
Сколько ступеней гидролиза соли?
Обратимый или необратимый гидролиз соли?
Какова реакция среды (рН) в результате гидролиза соли?
Полный или частичный гидролиз соли?
Компьютеризированная лабораторная работа № 10
Определение произведения растворимости
Малорастворимых солей
Цель работы: определить произведение растворимости малорастворимых солей серебра методом потенциометрии. Для этого необходимо:
- измерить ЭДС гальванических элементов с различной концентрацией солей;
- рассчитать значение произведения растворимости исследуемой соли, полученной при различных измерениях;
- усреднить полученные значения и сравнить с данными, приведенными в справочной литературе.
Теоретическая часть
Для определения произведения растворимости какого-либо галогенида серебра необходимо составить гальванический элемент, в котором в качестве одного электрода используется электрод 1-го рода, другим электродом служит электрод 2-го рода с осадком исследуемого соединения на электроде
Ag, AgX | КХ || AgNО3(aq.) | Ag,
где X – соответствующий галоген (Сl, Вr или I).
На электродах будут протекать следующие реакции:
Ag+ + е- ↔ Ag,
AgX + е- ↔ Ag + X-
Суммарная реакция, протекающая в электрохимическом элементе, соответствует реакции образования исследуемого малорастворимого соединения из ионов: Ag+ + X- ↔ AgX.
Запишем уравнения Нернста для этих электродов
 (1);
(1);  . (2)
. (2)
Выражение для ЭДС этого элемента будет
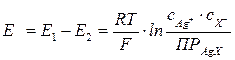 . (3)
. (3)
Произведение растворимости малорастворимого соединения связано с ЭДС рассмотренного элемента, и для его определения необходимо измерить ЭДС элемента при известных концентрациях иона серебра (Ag+) в растворе первого электрода и аниона X– в растворе второго.
Практически рассмотренный гальванический элемент составляют из двух частей, каждая из которых представляет собой соответствующий электрод. Электроды соединяются электролитическим мостиком заполненным раствором KNO3 с агар-агаром. В связи с тем, что подвижности ионов калия и нитрат-ионов близки, величина диффузионного потенциала не будет существенно влиять на результаты измерений. Первоначально обе части элемента заполняют раствором AgNO3 для того, чтобы проверить правильности приготовления электродов. Затем, раствор из одной части заменяют раствором галогенида калия (не промывая при этом стаканчик) ион приобретает свойства электрода второго рода.
Для проведения работы предварительно готовят растворы галогенидов (KCl, KBr или KI - в зависимости от того произведение какого галогенида серебра необходимо определить) концентрации 0,01 М и раствор AgNO3 той же концентрации (слегка подкисленный азотной кислотой для предотвращения гидролиза). Следует помнить, что раствор нитрата серебра плохо хранится и для проведения работы необходимо использовать его свежеприготовленным.
Экспериментальная часть
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации:
- центральный контроллер;
- модуль «Электрохимия» в комплекте с двумя стаканчиками (50 см3), двумя серебряными электродами, электролитическим мостиком и двумя шнурами для подсоединения электродов;
2. Растворы AgNО3 и растворы галогенидов щелочных металлов 0,01 М, агар-агар, дистиллированная вода;
3. Две пипетки на 10 см3, лабораторная посуда.



 (1);
(1);  . (2)
. (2)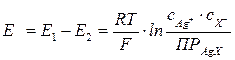 . (3)
. (3)


