

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Интересное:
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Электрохимические процессы происходят при взаимном превращении химической и электрической форм энергии. Превращение химической энергии в электрическую осуществляется в гальваническом элементе, превращение электрической энергии в химическую – в электролизере.
Электрохимические превращения могут протекать на любом металлическом оборудовании, в том числе на металлической поверхности древесносушильных камер, дереворежущих инструментов (пил, ножей и т.п.) при наличии соответствующих сред.
Данная тема включает 3 лабораторные работы.
Лабораторная работа № 13
Гальванический элемент
Цель работы
1. Ознакомиться с понятием "электродный потенциал" и определить величины равновесных электродных потенциалов исследуемых металлов. Определить теоретические значения электродных потенциалов по уравнению Нернста. Сравнить расчетные и экспериментальные значения величин электродных потенциалов и определить относительную ошибку измерения.
2. Составить гальванический элемент из двух исследуемых металлических электродов в растворе солей одноименных металлов. Написать уравнения электрохимических реакций, приводящих к генерированию электрического тока в такой системе.
3. Определить величину ЭДС гальванического элемента, сравнить ее с соответствующим стандартным значением ЭДС и определить относительную ошибку измерения.
Теоретическая часть
Электродный потенциал
Любая электрохимическая система состоит из двух электродов, помещенных в растворы. Растворы служат проводниками второго рода и имеют ионную проводимость. Металлические электроды являются проводниками первого рода, имеют электронную проводимость. Они контактируют с ионными проводниками.
Если металл поместить в раствор собственных ионов, то происходит сложное взаимодействие металла с компонентами раствора. Металлы имеют кристаллическое строение, где атомы связаны друг с другом металлической связью. В узлах кристаллических решеток расположены ион-атомы, находящиеся в равновесии со свободными электронами. Диполи воды подходят к ион-атомам, ориентируясь вдоль поверхности металла. В результате взаимодействия ион-атома с диполями воды происходит окисление металла и переход гидратированных ионов в раствор. Равновесие нарушается, а на поверхности металла остаются избыточные электроны. Заряд этих электронов не скомпенсирован положительно заряженными ионами в металле

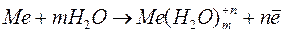 .
.
Поэтому металл заряжается отрицательно, а раствор вблизи поверхности металла - положительно. Происходит притяжение противоположно заряженных частиц и возникновение двойного электрического слоя (рис.1).
 –+ + +
–+ + +
–+ + +
– + + +
–+ +
–+ +
–+ + +
–+ + +
Металл Раствор
Рис.1. Двойной электрический слой на границе раздела металл-раствор
Между металлом и раствором возникает разность потенциалов, которая называется электродным потенциалом, или потенциалом электрода.
Кроме процесса перехода ионов металла в раствор происходит обратный процесс – восстановление ионов металла до атомов
 .
.
С увеличением скачка потенциала между электродом и раствором скорость прямой реакции падает, а обратной реакции - растет.
При некотором значении электродного потенциала скорость прямого процесса ( ) равна скорости обратного (
) равна скорости обратного ( ), то есть устанавливается термодинамическое равновесие:
), то есть устанавливается термодинамическое равновесие:
 ⇄
⇄  .
.
|
|



 .
.
Если в качестве электрода выбрать электрохимически активный металл, то процесс самопроизвольной ионизации в стандартных условиях термодинамически возможен, поскольку сопровождается убылью свободной энергии Гиббса в системе
 .
.
Для электрохимически неактивных металлов процесс самопроизвольной ионизации в стандартных условиях термодинамически невозможен, поскольку изменение свободной энергии Гиббса оценивается положительной величиной
 .
.
Итак, электрод – это система, состоящая из проводника первого рода (металла или графита), контактирующего с проводником второго рода (электролитом).
Как было сказано выше, образование двойного электрического слоя на границе металл-раствор приводит к возникновению скачка потенциала j. Потенциал имеет знак заряда, возникающего на поверхности металла в двойном электрическом слое.
Значение равновесного потенциала металлического электрода можно рассчитать по уравнению Нернста
 , (1)
, (1)
где  – равновесный потенциал металлического электрода в растворе собственной соли, В;
– равновесный потенциал металлического электрода в растворе собственной соли, В;
 – стандартный потенциал данного металлического электрода (потенциал металлического электрода в растворе собственной соли с концентрацией
– стандартный потенциал данного металлического электрода (потенциал металлического электрода в растворе собственной соли с концентрацией  = 1 моль/л при Т=298 К), В;
= 1 моль/л при Т=298 К), В;
R – универсальная газовая постоянная (8,31 Дж/моль К);
T – абсолютная температура по шкале Кельвина, К;
F – число Фарадея (~ 96500 Кл/моль);
n – число электронов, принимающих участие в процессе;
 – концентрация ионов металла в растворе, моль/л.
– концентрация ионов металла в растворе, моль/л.
После подстановки численных значений постоянных величин и перехода от натурального к десятичному логарифму уравнение (1) для 298 К (25°С) примет вид
 . (2)
. (2)
Газовые электроды представляют собой системы, состоящие из благородного металла, который находится в контакте одновременно с газом и с раствором электролита. Последний в свою очередь содержит ионы, являющиеся продуктами окисления или восстановления данного газа.
Наиболее распространенным газовым электродом является водородный электрод. Его схема приведена на рис. 2.
В водородном электроде через водный раствор серной кислоты продувается газообразный водород. В раствор серной кислоты погружена платиновая пластина, покрытая слоем платиновой черни. На этом слое высокодисперсной платины адсорбируется молекулярный водород. Условное обозначение водородного электрода  .
.

Рис. 2. Схема водородного электрода
Равновесный электродный потенциал водородного электрода определяется уравнением 2 Н +(р) + 2  ® Н 2(г). Н +(р) +
® Н 2(г). Н +(р) +  ⇄ 1/2 Н 2(г).
⇄ 1/2 Н 2(г).
Если давление газообразного водорода равно одной атмосфере (1,01×105 Па или 10,1 кПа), а концентрация ионов водорода в растворе - одному эквиваленту в литре (1н), то водородный электрод называют нормальным. Если концентрация равна одному молю в литре (1М), то водородный электрод называется стандартным.
Величина равновесного потенциала зависит от концентрации ионов водорода в растворе и от парциального давления газообразного водорода и может быть рассчитана по уравнению
 , (3)
, (3)
где 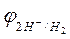 – величина равновесного потенциала водородного электрода, В;
– величина равновесного потенциала водородного электрода, В;
 – стандартный потенциал водородного электрода, В;
– стандартный потенциал водородного электрода, В;
 – парциальное давление газообразного водорода, Па;
– парциальное давление газообразного водорода, Па;
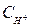 – концентрация ионов водорода в растворе, моль/л.
– концентрация ионов водорода в растворе, моль/л.
Учитывая, что парциальное давление водорода равно нормальному атмосферному ( = 1) и, подставив численные значения констант в уравнение (3), получим
= 1) и, подставив численные значения констант в уравнение (3), получим


 + 0,059 lg
+ 0,059 lg 
Абсолютное значение потенциала водородного электрода неизвестно, но условно считают за ноль потенциал стандартного, или нормального, водородного электрода. Тогда
 = 0,059 lg
= 0,059 lg  .
.
Зная, что  , окончательно получаем
, окончательно получаем
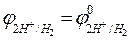 = - 0,059 pH.
= - 0,059 pH.
|
|
|

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2025 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!