Структурная основа холестерола - кольца циклопентанпергидрофенантрена - не может быть расщеплена до СО2 и воды, как другие органические компоненты, поступающие с пищей или синтезированные в организме. Поэтому основное количество холестерола выводится в виде жёлчных кислот.
Некоторое количество жёлчных кислот выделяется в неизменённом виде, а часть подвергается действию ферментов бактерий в кишечнике. Продукты их разрушения (в основном, вторичные жёлчные кислоты) выводятся из организма.
Часть молекул холестерола в кишечнике под действием ферментов бактерий восстанавливается по двойной связи в кольце В, в результате чего образуютря 2 типа молекул - холестанол и копростанол, выводимые с фекалиями. В сутки из организма выводится от 1,0 г до 1,3 г холестерола, основная часть удаляется с фекалиями.
Концентрация холестерола в крови взрослых людей составляет 200±50 мг/дл (5,2±1,2 ммоль/л) и, как правило, увеличивается с возрастом. Превышение нормальной концентрации холестерола в крови называют гиперхолестеролемией.
70. Роль липопротеинов низкой и высокой плотности (ЛПНП и ЛПВП) в обмене холестерина. Биохимические основы развития атеросклероза Количественное определение общего холестерина в сыворотке крови. Клиническое значение определения. Особенности липидного состава крови у детей.
Липиды являются в основе своей гидрофобными молекулами, они транспортируются в водной фазе крови в составе особых частиц – липопротеинов. Такие транспортные липопротеины можно сравнить с орехом, который имеет скорлупу и ядро. Поверхность липопротеиновой частицы ("скорлупа") гидрофильна и сформирована белками, фосфолипидами и свободным холестеролом. Триацилглицеролы и эфиры холестерола составляют гидрофобное ядро. Белки в липопротеинах обычно называются апобелками, выделяют несколько их типов – А, В, С, D, Е. В каждом классе липопротеинов находятся соответствующие ему апобелки, выполняющие структурную, ферментативную и кофакторную функции.
ЛП различаются по соотношению триацилглицеролов, холестерола и его эфиров, фосфолипидов и как сложные белки состоят из четырех классов.
хиломикроны (ХМ),
липопротеины очень низкой плотности (ЛПОНП, пре-β-липопротеины, пре-β-ЛП),
липопротеины низкой плотности (ЛПНП, β-липопротеины, β-ЛП),
липопротеины высокой плотности (ЛПВП, α-липопротеины, α-ЛП).
Хиломикроны и ЛПОНП ответственны, в первую очередь, за транспорт жирных кислот в составе ТАГ. ЛП высокой и низкой плотности – за транспорт холестерола и жирных кислот в составе эфиров ХС.
Транспорт триацилглицеролов от кишечника к тканям (экзогенные ТАГ) осуществляется в виде хиломикронов (ХМ), от печени к тканям (эндогенные ТАГ) – в виде липопротеинов очень низкой плотности.В транспорте ТАГ к тканям можно выделить последовательность следующих событий:
1.Образование незрелых первичных ХМ в кишечнике. 2.Движение первичных ХМ через лимфатические протоки в кровь.
3.Созревание ХМ в плазме крови – получение белков апоС-II и апоЕ от ЛПВП. 4.Взаимодействие с липопротеинлипазой (ЛПЛ) эндотелия, которая отщепляет жирные кислоты от ТАГ. Жирные кислоты переходят непосредственно в данную ткань или, связываясь с альбумином, разносятся по организму. В результате количество ТАГ в хиломикроне резко снижается и образуются остаточные ХМ. 5.Переход остаточных ХМ в гепатоциты и полный распад их структуры. 6.Синтез ТАГ в печени из пищевой глюкозы. Использование ТАГ, пришедших в составе остаточных ХМ. 7.Образование первичных ЛПОНП в печени.
8.Созревание ЛПОНП в плазме крови – получение белков апоС-II и апоЕ от ЛПВП. 9.Взаимодействие с липопротеинлипазой эндотелия и потеря большей части ТАГ. Образование остаточных ЛПОНП (по-другому липопротеины промежуточной плотности, ЛППП). 10.Остаточные ЛПОНП переходят в гепатоциты и полностью распадаются, либо остаются в плазме крови. После воздействия на них печеночной ТАГ-липазы в синусоидах печени ЛПОНП превращаются в ЛПНП.
ЛП очень низкой плотности (пребеталипопротеиды): -синтезируются в печени из эндогенных и экзогенных липидов,
-в их составе преобладают ТАГ, около 40% от массы составляют белок, фосфолипиды и холестерол (8% белка, 60% ТАГ, 6% ХС, 12% эфиров ХС, 14% фосфолипидов), -основным белком является апоВ-100, выполняющий структурную функцию,
-в норме концентрация 1,3-2,0 г/л, -слабо атерогенны.
Функция: Транспорт эндогенных и экзогенных ТАГ от печени в ткани, запасающие и использующие жиры, т.е. в те же ткани, что и хиломикроны (в сутки в печни обр-ся от 20 до 50 г жира на экспорт)
Метаболизм: 1. Первичные ЛПОНП образуются в печени из пищевых жиров, достигающих гепатоцитов с остаточными хиломикронами, и новосинтезированных из глюкозы жиров, содержат только апоВ-100; 2. В крови первичные ЛПОНП взаимодействуют с ЛПВП и приобретают от них апоС-II и апоЕ, образуя зрелые формы. 3. Аналогично хиломикронам, на эндотелии капилляров ряда тканей зрелые ЛПОНП подвергаются воздействию липопротеинлипазы, которая находится на поверхности кл эндотелия сосудов с образованием свободных жирных кислот и глицерина. Жирные кислоты перемещаются в клетки органов и используются как Е материал, либо остаются в плазме крови и в комплексе с альбумином разносятся с кровью в другие ткани. 4. Остаточные ЛПОНП (также называемые липопротеины промежуточной плотности, ЛППП)
либо эвакуируются в гепатоциты посредством эндоцитоза, связанного с рецепторами к апоЕ и апоВ-100-белкам, либо после воздействия на них печеночной ТАГ-липазы (только в сосудах печени) превращаются в следующий класс липопротеинов – липопротеины низкой плотности (ЛПНП).
ЛП низкой плотности (ЛПНП или beta-липопротеипы): Образуются в крови. Состоят из 25% белка и 75% липидов. Главным компонентом является холестерин (примерно50%) в виде эфиров с линолевой кислотой и фосфолипиды. У здоровых людей до 2/3 всего холестерина плазмы находится в составе ЛПНП. Они являются главным поставщиком холестерина в ткани. ЛПНП регулируют синтез холестерина de novo. Большинство ЛПНП являются продуктами расщепления ЛПОНП липопротеидлипазой. На клеточных мембранах имеются рецепторы для ЛПНП, они взаимодействуют с апопротеинами ЛПНП. После узнавания проникают в клетки путем эндоцитоза, там распадаются под действием ферментов гидролаз в лизосомах. Освободившийся холистерин идёт на построение мембран и метаболические нужды клеток. Функция: транспорт холестерина в ткани, в том числе в печени.
ЛП высокой плотности (ЛПВП или а-липопротеины): Состав: 50% белков, 25% фосфолипидов, 20% эфиров холестерина и очень мало триацилглицеринов. Образуются главным образом в печени. В поверхностном слое ЛПВПобразуют комплексы с ферментом лецитинхолестеролацилтрансферазой (ЛХАТ). С помощью этого фермента остаток ж к-ты переносится с лицитина на свободный холестерин ЛПВП, превращая его в эфир (холестерид) и лизофосфотидилхолин. Холестерид является гидрофобным соединением, поэтому перемещается в ядро ЛПВП. Т.о. он нагружается эфирами холестерина, увел-ся в размерах и из дисковидного превращается в частицу сферической формы – зрелый ЛПВП. Далее он транспортируется в печень, где холестерин исп-ся на синтез желчных к-т. ЛПВП, благодаря ЛХАТ, забирают холестерин от других липопротеидов и транспортируют его в печень, предотвращая накопление его в клетках. Концентрация ЛПВП меняется в зависимости от ритма питания. Их мах кол-во ч/з 4-5 часов после еды. Ч/з 10-12 часов хиломикронов 0%, ЛПОНП 15%, ЛПНП 60%, ЛПВП 25%.
ЛПОНП и ЛПНП считают атерогенными, то есть вызывающими атеросклероз. ЛПВП — антитиатерогенными.
Нарушения липидного обмена могут быть как первичными, так и вторичными, т.е. вызванными патологией эндокринной системы или компенсаторные при различных заболеваниях.
Нарушения переваривания и всасывания липидов сопровождаются развитием стеатореи (повышенное содержание липидов и жирных кислот в кале) и обусловливаются одной из следующих причин:
1.Дефицит панкреатической липазы, связанный с заболеваниями поджелудочной железы.
2.Дефицит желчи в кишечнике, обсуловленный заболеваниями печени или желчевыводящих путей.
3.Угнетение ферментных систем ресинтеза триглицеридов в стенке кишечника при его заболеваниях.
Повышение липопротеидов называется гиперлипопротеидемией. Главная опасность этого состояния связана с тем, что повыш-ся вер-ть возникновения атеросклероза. Вер-ть заболевания тем выше, чем больше отношение ЛПНП к ЛПВП в крови.
Атеросклероз -это патология, которая характеризуется отложением, главным образом, холестерина в стенке крупных сосудов (аорта, коронарные сосуды, сосуды мозга и т.д.) с образованием вначале пятен, полосок. Затем на их месте образуются утолщения (атеросклеротические бляшки). Эти липидные бляшки являются своеобразным инородным телом, вокруг которого развивается соединительная ткань, затем наступает кальцификация пораженного участка сосуда. Сосуды становятся неэластичными, плотными, ухудшается кровоснабжение ткани, а на месте бляшек могут возникать тромбы. В стенке сосудов есть два защитных механизма от избыточного отложения холестерина: Работа липопротеидлипазы, которая расщепляет жир липопротеидов, делает их меньше по размеру;ЛПВП, которые уносят холестерин. Ожирение: У нормально упитанного человека жиры составляют около 15% массы тела. При сбалансированном питании количество жира в организме не изменяется. При этом жиры жировой ткани все время обновляются, то есть одновременно идут липолиз и липогенез с равными скоростями. В результате жиры жировой ткани за несколько дней обновляются полностью. При длительном голодании и физических нагрузках липолиз идет с большей скоростью, чем липогенез. В результате количество депонированного жира уменьшается. Если липогенез опережает липолиз, наступает ожирение. Наиболее частой причиной ожирения является несоответствие между количеством потребляемой пищи и энергетическими тратами организма. Такое несоответствие возникает при переедании (особенно углеводов, так как они легко переходят в жиры), при гиподинамии (при этом мобилизация жира идет с более низкой скоростью) и, особенно, при сочетании этих факторов. Кроме того, ожирение является характерным признаком многих эндокринных заболеваний. Генетические заболевания, при которых происходит неполное расщепление полимерных веществ и их накопление, получили название лизосомные болезни накопления, так как они обусловлены дефектами специфических лизосомальных гидролаз. В случае накопления липидов такие болезни называются липидозы. При липидозах нарушается нормальный катаболизм липидов до соответствующих мономеров. Болезнь Вольмана – редкое аутосомно-рецессивное заболевание из-за дефекта кислой эстеразы лизосом, что обусловливает накопление эфиров холестерола в лизосомах печени, селезенки, надпочечников, костного мозга и тонкого кишечника. Проявляется в первые недели жизни рвотой, диареей и стеатореей, гепатоспленомегалией и двусторонним кальцинозом надпочечников. Больные умирают в возрасте до 6 мес. Болезнь Шюллера-Кристиана аутосомно-рецессивное заболевание характеризуется отложением в плоских костях, твердой мозговой оболочке и коже холестерола и его эфиров. Характерными являются деструктивные изменения в костях, остеопороз, мозжечковые расстройства. Заболевание обычно начинается в возрасте до 10 лет, реже позднее. Мужчины болеют в 2 раза чаще, чем женщины. Течение заболевания прогрессирующее. Дефектный фермент неизвестен. Болезнь Гоше – отложение цереброзидов в макрофагальных клетках селезенки, печени, лимфатических узлов и костного мозга. Возникает в связи с аутосомно-рецессивным отсутствием гликоцереброзидазы (β-глюкозидазы). Основными симптомами заболевания являются спленомегалия, увеличение печени и селезенки, а также изменения в костях, проявляющиеся в виде остеопороза. При болезни Нимана-Пика наблюдается отложение сфингомиелина в клетках различных органов из-за дефицита сфингомиелиназы. Болезнь наследуется аутосомно-рецессивно, проявляется резким увеличением печени и селезенки, замедлением психического развития ребенка, появлением слепоты и глухоты. Чаще всего дети погибают в возрасте до 2 лет. Болезнь Тея-Сакса (амавротическая семейная идиотия) является результатом дефекта N-ацетилгексозаминидазы, при котором происходит отложение ганглиозидов в клетках головного мозга, что сопровождается атрофией зрительных нервов, слепотой, слабоумием и смертью в младенческом возрасте.
Содержание липидных фракций новорожденных отличается от спектра этих веществ у более старших детей и взрослых тем, что у них значительно увеличено содержание альфа-липопротеинов и понижено количество.
Общая схема источников поступления и путей расходования аминокислот в тканях. Динамическое состояние белков в организме. Причины необходимости постоянного обновления белков организма. «Незаменимые» аминокислоты.
АК, класс органических соединений, объединяющих в себе свойства кислот и аминов, т.е. содержащих наряду с карбоксильной группой - COOH аминогруппу - NH2. АК играют важную роль в жизни организмов, т.к. все белковые вещества построены из аминокислот. Все белки при полном гидролизе (расщеплении с присоединением воды) распадаются до свободных аминокислот, играющих роль мономеров в полимерной белковой молекуле. Источники АК в клетке – поступление с пищей, из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот, кетокислот. Основным экзогенными источником аминокислот являются белки пищи. Белки переводятся в доступную для организма форму при переваривании под действием протеолитических ферментов, входящих в состав желудочно-кишечных секретов. Свободные аминокислоты всасываются и после транспорта кровью включаются в клетках в различные пути использования. Путь дальнейшего превращения аминокислот зависит от вида и функции клетки, условий ее существования и гормональных влияний. Спектр веществ, получаемых клеткой из аминокислот, чрезвычайно широк.
Главным путь испол-я - синтез собственных белков. АК используются для синтеза других азотсодержащих соединений, например таких, как тироксин, адреналин, гистамин, выполняющих специфические функции. Аминокислоты используются также как источники энергии, включаясь в путь катаболизма. Многие растения и бактерии могут синтезировать все необходимые им аминокислоты из простых неорганических соединений. Большинство аминокислот синтезируются в теле человека и животных из обычных безазотистых продуктов обмена веществ и усвояемого азота. Однако восемь аминокислот (валин, изолейцин, лейцин, лизин, фенилаланин, метионин, треонин, триптофан) являются незаменимыми, т.е. не могут синтезироваться в организме животных и человека, и должны доставляться с пищей. Суточная потребность взрослого человека в каждой из незаменимых аминокислот составляет в среднем около 1 грамма. При недостатке этих аминокислот (чаще триптофана, лизина, метионина) или в случае отсутствия в пище хотя бы одной из них невозможен синтез белков и многих других биологически важных веществ, необходимых для жизни.
В организме человека возможен синтез восьми заменимых аминокислот: Ала, Асп, Асн, Сер, Гли, Глу, Глн, Про. Углеродный скелет этих аминокислот образуется из глюкозы. α-аминогруппа вводится в соответствующие α-кетокислоты в результате реакций трансаминирования. Универсальным донором α-аминогруппы служит глутамат. Путём трансаминирования α-кетокислот, образующихся из глюкозы, синтезируются аминокислоты. Глутамат также образуется при восстановительном аминировании α-кетоглутарата глутаматдегидрогеназой. Эти реакции обратимы и играют большую роль как в процессе синтеза аминокислот, так и при их катаболизме. Такие реакции, выполняющие двойную функцию, называют амфиболическими.
Бднако безбелковое питание (особенно продолжительное) вызывает серьёзные нарушения обмена и неизбежно заканчивается гибелью организма. Исключение даже одной незаменимой аминокислоты из пищевого рациона ведёт к неполному усвоению других аминокислот и сопровождается развитием отрицательного азотистого баланса, истощением, остановкой роста и нарушениями функций нервной системы.
Конкретные проявления недостаточности одной из аминокислот были выявлены у крыс, которым скармливали белки, лишённые определённой аминокислоты. Так, при отсутствии цистеина (или цистина) возникал острый некроз печени, гистидина - катаракта; отсутствие метионина приводило к анемии, ожирению и циррозу печени, облысению и геморрагии в почках. Исключение лизина из рациона молодых крыс сопровождалось анемией и внезапной гибелью (этот синдром отсутствовал у взрослых животных).
Недостаточность белкового питания приводит к заболеванию, получившему в Центральной Африке название "квашиоркор", что в переводе означает "золотой (или красный) мальчик". Заболевание развивается у детей, которые лишены молока и других животных белков, а питаются исключительно растительной пищей, включающей бананы, таро, просо и, чаще всего, кукурузу. Квашиоркор характеризуется задержкой роста, анемией, гипопротеинемией (часто сопровождающейся отёками), жировым перерождением печени. У лиц негроидной расы волосы приобретают красно-коричневый оттенок. Часто это заболевание сопровождается атрофией клеток поджелудочной железы. В результате нарушается секреция панкреатических ферментов и не усваивается даже то небольшое количество белков, которое поступает с пищей. Происходит поражение почек, вследствие чего резко увеличивается экскреция свободных аминокислот с мочой. Без лечения смертность детей составляет 50-90%. Даже если дети выживают, длительная недостаточность белка приводит к необратимым нарушениям не только физиологических функций, но и умственных способностей. Заболевание исчезает при своевременном переводе больного на богатую белком диету, включающую большие количества мясных и молочных продуктов. Один из путей решения проблемы - добавление в пищу препаратов лизина.




72. Катаболизм аминокислот. Общие пути распада аминокислот. Трансаминирование аминокислот. Схема реакций, ферменты, роль витамина В6. Биологическое значение трансаминирования. Диагностическое значение определения трансаминаз в сыворотке крови.
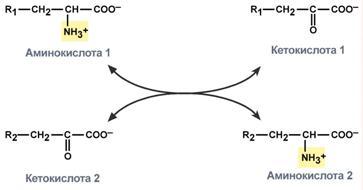 Непрямое окислительное дезаминирование (трансдезаминирование). Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Непрямое окислительное дезаминирование (трансдезаминирование). Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование и его механизм довольно сложен. В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота, которая превращается в глутамат ("аминокислота 2"). В результате трансаминирования свободные аминокислоты теряют α-NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы в глюконеогенезе.
 Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх). В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Т.к. НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования:
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх). В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Т.к. НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования:
Реакции трансаминирования:
-активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
-обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
-начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
-необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для кетогенеза и глюконеогенеза, в других органах – для его прямого вовлечения в реакции цикла трикарбоновых кислот.
-при патологиях (сахарный диабет, гиперкортицизм) обуславливают наличие субстратов для -глюконеогенеза и способствуют патологической гипергликемии.
Продукт трансаминирования глутаминовая кислота:
-является одной из транспортных форм аминного азота в гепатоциты,
-способна реагировать со свободным аммиаком, обезвреживая его.
 Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
Механизм реакции трансаминирования непрост и протекает по типу "пинг-понг". Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента имеют пиридоксальфосфат (активная форма витамина В6). В тканях насчитывают около 10 аминотрансфераз, обладающие групповой специфичностью и вовлекающие в реакции все аминокислоты, кроме пролина, лизина, треонина, которые не подвергаются трансаминированию.
Весь перенос аминогруппы совершается в две стадии:
1.к пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат.
2. на второй стадии к пиридоксаминфосфату присоединяется другая кетокислота, получает аминогруппу, образуется новая аминокислота и пиридоксальфосфат регенерирует.
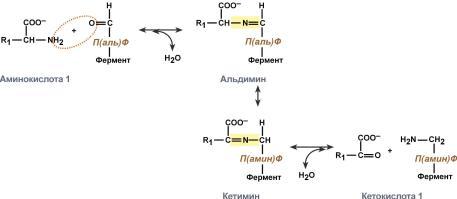 Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
После отщепления кетокислоты к комплексу пиридоксамин-фермент присоединяется новая кетокислота и процесс идет в обратном порядке: образуется кетимин, затем альдимин, после чего отделяется новая аминокислота. Чаще всего аминокислоты взаимодействуют со следующими кетокислотами: пировиноградной с образованием аланина, щавелевоуксусной с образованием аспартата, α-кетоглутаровой с образованием глутамата. Однако аланин и аспартат в дальнейшем все равно передают свою аминогруппу на α-кетоглутаровую кислоту. Таким образом, в тканях осуществляется поток избыточных аминогрупп на один общий акцептор – α-кетоглутаровую кислоту. В итоге образуется большое количество глутаминовой кислоты. Далее глутаминовая кислота может вовлекается в процессы  связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
В медицине нашло практическое применение определение активности двух ферментов трансаминирования – аланинаминотрансферазы (АЛТ, АлАТ) и аспартатаминтрансферазы (АСТ).
Оба фермента обратимо взаимодействуют с α-кетоглутаровой кислотой и переносят на нее аминогруппы от соответствующих аминокислот с образованием глутаминовой кислоты и кетокислот. Хотя активность обоих ферментов значительно возрастает при заболеваниях сердечной мышцы и печени, при поражении клеток миокарда наибольшая активность в сыворотке крови обнаруживается для АСТ, при гепатитах – для АЛТ.









 Непрямое окислительное дезаминирование (трансдезаминирование). Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Непрямое окислительное дезаминирование (трансдезаминирование). Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма. Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх). В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Т.к. НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования:
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование. В организме человека дезаминированию подвергается только глутаминовая кислота. Второй этап осуществляется глутаматдегидрогеназой (перейти вверх). В организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота, и только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма, кроме мышечных. Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование. Если реакция идет в митохондриях печени, аммиак используется для синтеза мочевины, которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза. Т.к. НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН. Роль трансаминирования и трансдезаминирования: Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей.
Процесс трансдезаминирования идет в организме непрерывно, потому что сопряженные реакции трансаминирования и дезаминирования создают поток лишнего аминного азота из периферических клеток в печень для синтеза мочевины и в почки для синтеза аммонийных солей. Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота.
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота. связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.
связывания аммиака (синтез глутамина) либо в прямое окислительное дезаминирование.


