Техническая термодинамика рассматривает в основном термодеформационные системы, рабочими телами которых являются газы и пары.
Чтобы определить работу деформации замкнутой неподвижной силы с однородным газообразным (или жидким) рабочим телом, следует рассмотреть бесконечно малое расширение объема занимаемого рабочим телом, в элементарном термодинамическом процессе.
Газ, заключенный в оболочку способную деформироваться без сопротивления, имеет давление и находится в равновесии с окружающей средой. При бесконечно малом расширении газа оболочка системы смещается в сторону окружающей среды на бесконечно малое расстояние, которое, может быть различным на разных участках поверхности. При этом на каждом участке с элементарной площадью поверхности бесконечно малая сила совершает над окружающей средой бесконечно малую работу. Для вычисления элементарной работы, совершаемой всей термодинамической системой, необходимо вычислить интеграл по всей поверхности.
Абсолютное давление — существенно положительная величина, поэтому знак dl определяется знаком dv: при dv > 0 работа производится системой над окружающей средой и считается положительной, при dv < 0 работа совершается окружающей средой над системой и считается отрицательной.
P=P(v)
Эта зависимость, определяемая характером термодинамического процесса, называется уравнением процесса в переменных V, P.
Важнейшим свойством работы как формы обмена энергией является ее зависимость от характера термодинамического процесса.
I. Для термодинамических систем, обладающих более чем одной степенью свободы, вид уравнения процесса определяется не только деформационным воздействием, но и одновременно протекающим термическим воздействием, т. е. теплообменом. Это выражается зависимостью давления от двух переменных — объема и, например, температуры, а действительная линия такого процесса представляет собой пространственную кривую в координатах р, v, Т. Одно и то же конечное состояние системы может быть достигнуто в ходе различных термодинамических процессов, изображающихся различными пространственными линиями на поверхности состояний р, v, Т.
Первый закон термодинамики
Первый закон термодинамики – изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме количества теплоты, подведенной к системе из вне и работе внешних сил действующих на нее: ∆U=Q+A.
Аналитические выражения:
Через внутреннюю энергию и работу: dq=du+pdV
Через энтальпию: dq=dh-Vdp
6. Уравнение состояния идеальных газов. Законы идеальных газов.
1. Закон Бойля – Мариотта устанав-т завис-ть между удельным объемом и абсолют. давлением ИГ в процессе при пост. темп-ре. «При постоянной температуре объем, занимаемый ИГ-ом, изм-ся обратно пропорционально его давлению» или «При пост. тем-ре произведение удельного объема на давление есть вел-на пост-ная». p · v = const.  (Т = const)
(Т = const)
2. Закон Гей-Люссака устан-ет зав-сть между удельным объемом и абс.тем-рой при пост. давл-и. «При постоянном давлении объемы одного и того же количества идеального газа изменяются прямо пропорционально абсолютным температурам»
 при (р=const).«Если давление газа в процессе нагрева поддерживать неизменным, то объем газа при нагреве будет увеличиваться с ростом температуры»
при (р=const).«Если давление газа в процессе нагрева поддерживать неизменным, то объем газа при нагреве будет увеличиваться с ростом температуры» 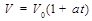 , при р=const, ρ · Т = const
, при р=const, ρ · Т = const
где V0 – объем газа при температуре 0º С; V – объем газа при температуре t º С; α- температурный коэффициент объемного расширения газа, α=1/273 К-1.
3. Закон Шарля устан-ет зав-сть давления газа от его тем-ры при пост-ном удельном объеме (француз, 1737 г.). «При пост-ом объеме давление газа изменяется прямо пропорционально его абсол. температуре» р / Т = const,  , при v = const
, при v = const
4.Закон Авогадро: «При один-х тем-рах и давл-х в равных объемах различных ИГ содержится одинаковое количество молекул». Так как ρ=1/ v, то μ · v = const.
У равнение состояния ИГ было выведено франц. Физиком Клапейроном в 1834 г. и связ-ет между собой основные параметры сост-я — давление,
Каждое из этих уравнений отличается от другого лишь тем, что относится к различным массам газа: первое — к М кг; второе—к 1 кг, третье— 1 кмолю газа.
7. Теплоемкость идеальных газов. Основные определения. Теплоемкости  и
и 
Если в результате теплообмена телу передается некоторое количество теплоты, то внутренняя энергия тела и его температура изменяются. Количество теплоты Q, необходимое для нагревания 1 кг вещества на 1 К называют удельной теплоемкостью вещества c.
Во многих случаях удобно использовать молярную теплоемкость C:
где M – молярная масса вещества.
Определенная таким образом теплоемкость не является однозначной характеристикой вещества. Согласно первому закону термодинамики изменение внутренней энергии тела зависит не только от полученного количества теплоты, но и от работы, совершенной телом. В зависимости от условий, при которых осуществлялся процесс теплопередачи, тело могло совершать различную работу. Поэтому одинаковое количество теплоты, переданное телу, могло вызвать различные изменения его внутренней энергии и, следовательно, температуры.
Такая неоднозначность определения теплоемкости характерна только для газообразного вещества. При нагревании жидких и твердых тел их объем практически не изменяется, и работа расширения оказывается равной нулю. Поэтому все количество теплоты, полученное телом, идет на изменение его внутренней энергии. В отличие от жидкостей и твердых тел, газ в процессе теплопередачи может сильно изменять свой объем и совершать работу. Поэтому теплоемкость газообразного вещества зависит от характера термодинамического процесса. Обычно рассматриваются два значения теплоемкости газов: CV – молярная теплоемкость в изохорном процессе (V = const) и Cp – молярная теплоемкость в изобарном процессе (p = const).



 (Т = const)
(Т = const) при (р=const).«Если давление газа в процессе нагрева поддерживать неизменным, то объем газа при нагреве будет увеличиваться с ростом температуры»
при (р=const).«Если давление газа в процессе нагрева поддерживать неизменным, то объем газа при нагреве будет увеличиваться с ростом температуры» 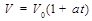 , при р=const, ρ · Т = const
, при р=const, ρ · Т = const , при v = const
, при v = const и
и 


