- Синдром дефицита лейкоцитарной адгезии (DAL1, DAL2) – дефицит интегринов, обеспечивающих плотное прилипание лейкоцитов (1), нарушение экспрессии селектинов – нарушение слабого сцепления лейкоцитов (2) → нарушение фагоцитарной функции.
- Хроническая гранулематозная болезнь– нарушение формирования АФК → снижается активность респираторного взрыва → хронические, нагноительные заболевания→ гиперпродукция бактериями антиоксидантов → гибель и так небольшого количества нф.
- Недостаточность МПО – нарушение респираторного взрыва.
-
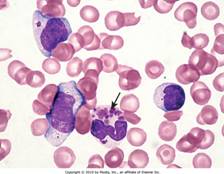 Синдром Чедиака-Хигаси – аномалии внутриклеточных везикул в нейтрофилах, моноцитах, меланоцитах, натуральных киллерах, тромбоцитах: везикулы сливаются, образуются крупные недееспособные гранулы, т.к. образовались аномалии лизосомальных белков, нарушение хемотаксиса и киллинга клеток-мишеней, цитотоксической активности натуральных киллеров и Тцтк
Синдром Чедиака-Хигаси – аномалии внутриклеточных везикул в нейтрофилах, моноцитах, меланоцитах, натуральных киллерах, тромбоцитах: везикулы сливаются, образуются крупные недееспособные гранулы, т.к. образовались аномалии лизосомальных белков, нарушение хемотаксиса и киллинга клеток-мишеней, цитотоксической активности натуральных киллеров и Тцтк - Синдром «ленивых» лейкоцитов – нарушена адгезия и миграция лейкоцитов, т.е. отсутствует ответ на хемоаттрактанты→ хронические воспаления и персистирующая инфекция
Дефекты системы комплемента
- Дефицит ингибиторов и инактиваторов – перерасход компонентов системы комплемента
- Дефицит начальных факторов – патология иммунных комплексов (системная красная волчанка).
- Дефицит терминальных компонентов – инфекция, вызванная мицеллами (?)
Причины вторичных ИДС
Вторичные ИДС – нарушения иммунной защиты организма, развившиеся в постнатальном периоде вследствие действия ненаследственных индукторных факторов (внешних и внутренних).
- Хронические бактериальные, вирусные, грибные, протозоо- и паразитарные инфекции
- Иммуносупрессивная терапия (цитостатики, ГКС)
- Лучевая болезнь
- Кахексия
- Старческий возраст
- Стрессы
- Аутоимунные заболевания
- Уремия
- Длительные оперативные вмешательства
- Ожоговая и опухолевая болези
- Сазарный диабет
- ВИЧ
Более четкое деление:
- нарушения ОВ, в том числе по причине аллиментарных факторов
- инфекционный процесс
- эндокринная патология
- лекарственные препараты
- стресс
- ионизирующая радиация
Приобретённый В-клеточный дефицит - Миелома, хронические рецидивирующие бактериальные инфекции (сильный расход В-лимфоцитов)
Приобретенный Т-клеточный дефицит – хронический кандидоз, персистирующие вирусные инфекции, саркоидоз, лепра, лимфогранулематоз, СПИД, глистная инвазия, аутоиммунная патология.
Приобретенный дефект гранулоцитов:
- СД
- Ожоговая болезнь
- Гемодиализ
- Лейкоз
- Апластическая анемия
- Сепсис
- Лечение ГКС
- Голодание – недостаток а/к для синтеза ИГ.
Нарушаются адгезия лейкоцитов, эмиграция, процессы фагоцитоза.
Инфекционный мононуклеоз (в. Эпштейна-Барр)
Временная доброкачественная пролиферация В-лимфоцитов, т.к. один из продуктов вируса – транскрипционный фактор, способствующий индукции генов митогенеза. В странах Африки – лимфома Беркитта.
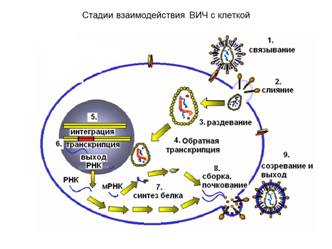 ВИЧ-инфекция
ВИЧ-инфекция
Рецепторы для ВИЧ – CD4. Связывание с рецептором блокирует распознавание сигналов от АПК.
Так как рецепторы для ВИЧ не только на лимфоцитах, но и на сперматозоидах, микроглии, мегакариоцитах, эозинофилах, нейтрофилах, нейронах, это обеспечивает политропность и полиморфизм клинической картины.
Иммунодефицит при СПИДе
Основной механизм гибели клеток: некроз, образование ВИЧ-синцития, апоптоз Т-хелперов и мегакариоцитов.
Подавление Т-зависимой иммунной системы:
- Снижение числа CD4-клеток
- Ослабление их функции из-за индукции ВИЧ
- Сдвиг баланса Тх1/Тх2 в сторону Тх2 (противовирусная активность связана с Тх1)
- Индукция супрессорных клеток белком gp120 и р67.
Может развиваться саркома Капоши.
Патогенез под действием ионизирующей радиации
- Повреждение естественных барьеров, отделяющих внутреннюю среду от внешней → усиление биологической агрессии
- Избирательное повреждение лимфоцитов и всех делящихся клеток → организм беззащитен перед биологической агрессией
Механизмы гибели клеток
- Интерфазная гибель при облучении → развитие апоптоза (В-клетки более чувствительные)
- Гибель покоящихся клеток при облучении (апоптоз)
Иммунодефицит при стрессе
Стресс – эволюционно выработанная реакция организма на действие экстремальных факторов. В основе реакции – повышенная выработка АКТГ и индуцированная ею гиперпродукция стероидных гормонов надпочечников + катехоламинов.
- Незрелые тимоциты и часть зрелых Т-клетко эмигрируют из тимуса и поступают в костный мозг
- Снижение функциональной активности лимофцитов и макрофагов, иммунный ответ, особенно гуморальный, существенно снижается.
При интенсивных стрессорных воздействиях
- Рост концентрации ГКС
- Апоптоз лимфоцитов (особенно кортикальных)
- Предшественники устойчивы к действию ГКС.
Возрастные иммунодефициты
Раннего возраста – формирование иммунной системы не завершается к моменту рождения. Из тимуса выселяются только клетки с ограниченной способностью к распознаванию АГ. Снижена выработка цитокинов, в том числе гамма-ИФН → низкая секреторная активность Тх2, недостаточность контактных сигналов → низкая выработка антител.
Из собственных ИГ синтезируются только М и то в малых количествах. К концу первого жизни – нормальный уровень. Синтез IgG начинается около 6 мес, полного развития достигает к 5-6 годам. IgА и IgЕ – 10 лет.
Вывод: у детей – естественный гуморальный иммунодефицит.
Иммунодефицит старения – связано с возрастной инволюцией тимуса. Снижение секреторной активности эпителия тимуса проявляется в том, что секреция тимулина неуклонно уменьшается с периода полового созревания. К 60 годам – практически невозможно обнаружить функциональными тестами.
- Снижение Т-лимфоцитов на периферии – после 60-70 лет, затрагивает Тх1,2 и Тцтк.
- Численность В-лимфоцитов и НК-клеток практически не изменяется
- Подавление тимус-зависимого гуморального ответа
- Повышение концентрации IgА и IgG (преобладание низкоаффиных тел), т.к. уменьшаются Т-регуляторы.
- Ослабевают аллергические процессы
- Накопление аутоантител как к распространенным, так и к органоспецифическим АГ.



 Синдром Чедиака-Хигаси – аномалии внутриклеточных везикул в нейтрофилах, моноцитах, меланоцитах, натуральных киллерах, тромбоцитах: везикулы сливаются, образуются крупные недееспособные гранулы, т.к. образовались аномалии лизосомальных белков, нарушение хемотаксиса и киллинга клеток-мишеней, цитотоксической активности натуральных киллеров и Тцтк
Синдром Чедиака-Хигаси – аномалии внутриклеточных везикул в нейтрофилах, моноцитах, меланоцитах, натуральных киллерах, тромбоцитах: везикулы сливаются, образуются крупные недееспособные гранулы, т.к. образовались аномалии лизосомальных белков, нарушение хемотаксиса и киллинга клеток-мишеней, цитотоксической активности натуральных киллеров и Тцтк ВИЧ-инфекция
ВИЧ-инфекция


