

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...
Топ:
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ВВЕДЕНИЕ
Класс Mollicutes объединяет микоплазмы, ахолеплазмы, спироплазмы, уреаплазмы, анаэроплазмы. Представителей класса Mollicutes характеризует ряд особенностей, уникальных для прокариот, а именно: отсутствие у них клеточной стенки и ее предшественников; наименьший среди прокариот размер генома (0,5-1,0 MДa); самое низкое относительно других микроорганизмов соотношение Г+Ц пар оснований в их ДНК; чрезвычайно простая организация клетки, имеющей минимальное количество органелл: цитоплазматическую мембрану, более похожую на мембрану клеток эукариот, прокариотический нуклеотид и рибосомы [18, 52]. Представители класса Mollicutes очень широко распространены в природе; они обнаружены у человека и других млекопитающих, птиц, рыб, моллюсков, насекомых, растений [42, 1, 2]. Их жизненный цикл и метаболизм зависят от клетки-хозяина, с которой они тесно связаны.
Большинство молликут - симбионты и факультативные паразиты растений и животных. У человека микоплазмы могут становиться причиной воспалительных процессов в различных органах, но преимущественно они связаны с эпителием. С M. pneumoniae связано развитие так называемых абактериальных атипичных пневмоний. M. genitalium, M. hominis, U. urealyticum ассоциированы с негонококковыми уретритами и другими заболеваниями урогенитального тракта [52]. На сегодняшний день считается доказанной роль микоплазм в развитии ревматоидного артрита [52].
Среди микоплазмозов большой процент занимают уреаплазмозы, т.е. заболевания, вызываемые U. urealyticum [78]. Сейчас известно, что уреаплазменное носительство может сопровождаться воспалительными процессами гениталий, приводящими к бесплодию, прерыванию беременности, преждевременным родам, пренатальной патологии плода, а также вызывать уретриты, простатиты и бесплодие у мужчин. Недавно было показано, что U.urealyticum является кофактором развития СПИД [37].
|
|
Благодаря большому разнообразию проявлений уреаплазменной инфекции и чрезвычайной генетической гетерогенности этого вида молликут возникла необходимость дифференциации различных типов U.urealyticum по их патогенным свойствам.
Были осуществлены попытки связать присутствие в инфицированном организме определенных сероваров U.urealyticum. с теми или иными клиническими проявлениями болезни. Однако, вследствие того, что возможны перекрестные реакции между различными сероварами U.urealyticum., и инфицированный организм в большинстве случаев содержит уреаплазмы, относящиеся к различным сероварам, попытка дифференциации по сероварам не принесла успеха [5].
Показать связь того или иного биологического варианта U.urealyticum. с определенными клиническими проявлениями уреаплазменной инфекции возможно при изучении факторов вирулентности уреаплазм и поиске адекватных подходов для дифференциальной диагностики уреаплазменной инфекции.
В настоящее время большое внимание уделяется вкладу изменчивости антигенных структур U.urealyticum в различные проявления уреаплазменной инфекции.
На основе полученных данных была сформулирована
Цель работы:
Изучение вариабельности структуры MB-антигена у клинических изолятов U.urealyticum и использование полученных данных для создания методики дифференцирования U.urealyticum биовара Parvo на генотипы.
Задачи:
ЛИТЕРАТУРНЫЙ ОБЗОР
ХАРАКТЕРИСТИКА КЛАССА MOLLICUTES.
|
|
Таксономия и филогения.
В класс Mollicutes входят 3 порядка, 4 семейства, 6 родов и около 100 видов. Таксономия Mollicutes представлена на схеме 1.
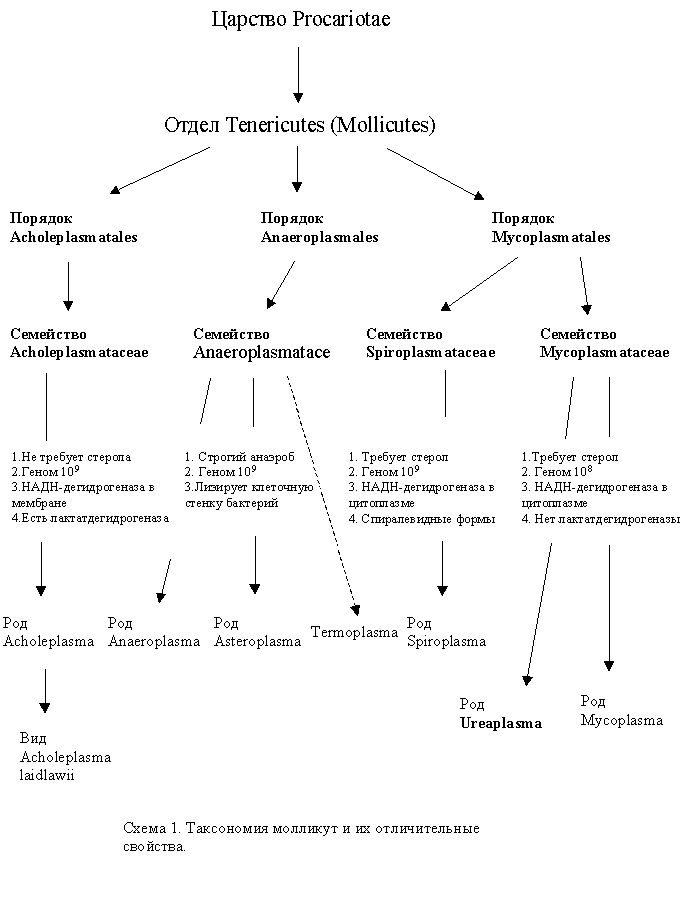
Филогенетические связи класса Mollicutes и пути их эволюции обсуждаются специалистами в основном с двух точек зрения. Согласно одной из них микоплазмы являются выжившей ветвью примитивных микроорганизмов, из которых впоследствии произошли прокариоты и эукариоты. Они появились как продукт прогрессивной эволюции еще до образования присущей бактериям клеточной стенки [44]. Другая точка зрения состоит в том, что микоплазмы являются регрессивной ветвью эволюции некоторых грамположительных бактерий и (или) клостридий. Второе предложение находит экспериментальные подтверждения и рассматривается в двух возможных вариантах. Все микоплазмы происходят либо от предка, общего с грамположительными бактериями [72], либо от разных бактерий (эту модель предложил Neimark в 1979 году). На основании проведенного сравнения последовательностей олигонуклеотидов 16S рРНК нескольких видов микоплазм (M. gallisepticum, M. capricolum, A. laidlawii, S. sitri) и грамположительных бактерий из родов Clostridium, Bacillus, Lactobacillus, Streptococcus Woese и соавторы высказали обоснованное предположение об их родстве [52].
Сравнительный анализ 16S РНК показал, что филогенетически микоплазмы ближе всего к клостридиям, а именно к C. Innocuum и C. Ramosum [18]. Такой вывод подтвердился исследованиями Rogers c соавторами [55]. При сравнительном анализе числа и последовательностей нуклеотидов в 5S РНК различных видов грамположительных бактерий и 13 видов микоплазм было также обнаружено, что предки последних отделились от ветви клостридий, возможно, от Clostridium innocuum, имеющей 114 нуклеотидов в составе 5S РНК. В отношении M. hominis такое предположение получило подтверждение в работах Ladefoged с соавторами [35] при сравнительном анализе порядка генов 5S РНК у этого вида и Clostridium perfringens. Наиболее вероятными предками клостридий считаются грамположительные бактерии с низким содержанием Г+Ц пар в ДНК (схема 2).
Морфология Mollicutes.
Mollicutes - прокариоты без клеточной стенки, не способные синтезировать a-Е-диаминопимелиновую кислоту [3]. В силу этого они осмотически неустойчивы и проявляют пластичность и разнообразие форм.
На твердой питательной среде эти микроорганизмы образуют колонии с плотным врастающим в агар центром и более светлой периферией, размер колоний варьирует от 50 до 500 мкм. В литературе вид этих колоний обычно сравнивают с яичницей-глазуньей ("fried-eggs"). Формы, растущие таким образом, называли PPLO (pleuropneumonia-like organisms) [6]. Поверхностную часть колонии обычно составляют более крупные, иногда вакуолизированные клетки, а центральную, более глубинную часть - мелкие, оптически более плотные клетки [5]. На уровне световой микроскопии в окрашенном по методу Романовского-Гимзы препарате видны полиморфные клетки микоплазм: глобулы, зерна, иногда нити. Фазово-контрастная микроскопия выявляет гетерогенность популяции не только по величине, но и по оптической плотности отдельных клеток.
|
|
Микоплазмы чрезвычайно полиморфны. Форма и размеры всех микоплазм изменяются в зависимости от возраста культуры, условий и сред культивирования [51]. По данным фильтрации и электронной микроскопии диаметр сферических клеток Mollicutes варьирует чаще всего в пределах 0,1-0,25 мкм [44]. Некоторые виды микоплазм представлены клетками грушевидной или гантелевидной формы (например, M. pneumoniae и M. gallisepticum). С глобулярными структурами связаны нитевидные мицеллярные формы, у некоторых видов, например, M. mycoides, - ветвящиеся. Их диаметр 0,2-0,3, длина - 100-150 мкм [5]. Способность клеток микоплазм сохранять свою форму в отсутствие клеточной стенки долгое время рассматривалась как доказательство наличия у них цитоскелета [53], что и было подтверждено после исследования генома M.pneumoniae [28]. Некоторые виды микоплазм способны к движению по субстрату, но механизм этого движения до сих пор неизвестен.
Размножение микоплазм происходит путем обычного деления клеток, распада нитей на кокковидные клетки, а также процесса, сходного с почкованием [7]. Процесс деления микоплазм в общем не отличается от такового у других бактерий. Однако надо заметить, что микоплазмы лишены клеточной стенки, хотя ей отводится важная роль в процессе деления. У микоплазм процесс деления цитоплазмы часто значительно отстает от процесса репликации генома, что приводит к появлению мультиядерных филаментов [16].
Структура клеток Mollicutes типична для прокариот: цитоплазматическая мембрана толщиной 10 нм с двумя электронно-плотными и внутренним электронно-прозрачным слоями, в цитоплазме - нуклеоид, диффузно распределенный в виде нитей ДНК, рибосомы, и иногда трех- и пятислойные внутрицитоплазматические мембранные структуры, функция которых окончательно не выяснена. [4,29].
|
|
Микоплазменные инфекции
Большинство микоплазм - симбионты и факультативные паразиты растений и животных. Микоплазмы поражают слизистые оболочки и суставные сумки животных в условиях их сельскохозяйственного разведения, вызывая различные поражения респираторного тракта, артриты, маститы и снижение репродуктивной способности. Они вызывают также некоторые массовые поражения цитрусовых и пасленовых (например, томатов и картофеля). Для пораженных растений характерны карликовость и недоразвитие плодов [1].
У человека микоплазмы могут становиться причиной воспалительных процессов в различных органах, но преимущественно они связаны с эпителием. С M. pneumoniae связано развитие так называемых абактериальных атипичных пневмоний. M. genitalium, M. hominis, U. urealyticum ассоциированы с негонококковыми уретритами и другими заболеваниями урогенитального тракта [52]. На сегодняшний день считается доказанной роль микоплазм в развитии ревматоидного артрита [52].
Значительное место среди микоплазмозов занимают уреаплазмозы, т.е. заболевания, вызываемые U. urealyticum. Сейчас известно, что уреаплазменное носительство может сопровождаться воспалительными процессами гениталий, приводящими к бесплодию, прерыванию беременности, преждевременным родам, пренатальной патологии плода, а также вызывать уретриты, простатиты и бесплодие у мужчин. Недавно было показано, что U.urealyticum является кофактором развития СПИД [37].
Систематика
Уреаплазмы, как представители микоплазм, принадлежат к царству Procariotae, отделу Tenericutes (Mollicutes), классу Mollicutes. Они входят в порядок Mycoplasmatales, семейство Mycoplasmataceae и объединяются в род Ureaplasma. В этот род входят U.urealyticum и U.diversum. Паразитом человека является U. urealyticum, а U.diversum выделяют от крупного рогатого скота и других животных.
Общая характеристика
Уреаплазма человека - U.urealyticum -впервые была выделена М.С. Shepard в 1954 г. от больного негонококковым уретритом. Первоначально уреаплазмы были названы Т-штаммами из-за мелкого (tiny) размера колоний (10-30 мкм). Однако позже были оптимизованы условия культивирования, и размер колоний приблизился к "классическим" для микоплазм размерам. Наиболее характерным биологическим свойством U.urealyticum является способность гидролизовать мочевину с образованием аммиака, т.е. уреазная активность.
Своеобразие биологии уреаплазм выражается также в их относительно быстром росте. Кривя роста уреаплазм совпадает с таковой у микоплазм в латентной фазе и ранней логарифмической фазе, однако стационарная фаза достигается за 16-18 часов. Оптимум рН ростовой среды для уреаплазм ниже, чем у большинства микоплазм - 6,5-6,0. В недостаточно забуференной среде уреаплазмы быстро гибнут [5].
|
|
Для U.urealyticum характерен более низкий титр КОЕ в жидкой среде, чем для микоплазм - не более 106-107 КОЕ / мл. На плотной среде уреаплазмы лучше культивируются в атмосфере газовой смеси, состоящей из 95% N2 и 5% СО2, либо 5% О2, 10% СО2, и 85% N2.[5]
Согласно электронно-микроскопическим наблюдениям клетки U.urealyticum можно разделить на 3 типа: малые (120-150 нм) с гомогенной цитоплазмой и множеством рибосом; средние (500-750 нм) с рибосомами по периферии; и большие, или раздутые - с оптически более плотной негомогенной цитоплазмой и выраженным нуклеоидом [4]
Уреаплазмы не редуцируют тетразол и не обладают каталазной активностью. Они отличаются от других представителей Mollicutes способностью синтезировать как насыщенные, так и ненасыщенные жирные кислоты. Уреаплазмы продуцируют пигмент гипоксантин - продукт пуринового обмена, обладают растворимым b-гемолизином, активным в отношении эритроцитов кролика и морской свинки, но не человека.[5]
Подводя итог можно отметить, что уреаплазмы обладают такими общими для всех микоплазм свойствами, как отсутствие клеточной стенки и ее предшественников, чрезвычайно простая организация клетки (цитоплазматическая мембрана, нуклеоид, рибосомы), наименьший среди прокариот размер генома (760 kb, 840-1140 kb), низкое содержание GC-пар в геноме (29,6-31,6%), потребность в стеролах. Вместе с тем уреаплазмы обладают и своими особенностями: колонии уреаплазм очень мелкие - 10-30 мкм (на порядок меньше, чем у других микоплазм), клетки сферической формы размером 0,12-0,15 мкм (мелкие), 0,5 мкм (средние), 0,8 мкм (большие), способность гидролизовать мочевину (уреазная активность), требовательность к составу питательной среды (богатая, многокомпонентная), оптимум рН 6,0 - 6,5, на агаровой среде лучше растут в атмосфере, содержащей 5% СО2 и 95% N2, быстрый рост, низкий титр КОЕ - _ 106 КОЕ/ml.
Классификация U.urealyticum
Ureaplasma urealyticum - гетерогенная группа микроорганизмов. С помощью специфических антисывороток удалось выделить 14 серотипов U.urealyticum. Эти серотипы можно объединить в 2 биовара Parvo и T-960. К биовару Parvo относятся следующие серотипы - 1,3,6 и 14. К биовару T-960 относятся серотипы 2,4,5,7-13.[52]
Основными критериями отнесения определенных серотипов к биоварам являются размер генома (биовар Parvo 760 kb, биовар Т960 840-1140 kb) и анализ генов 16S рРНК (показано несколько отличий генов 16S рРНК представителей различных биоваров [54]).
В настоящее время интенсивно исследуется роль биоваров в развитии патологических проявлений уреаплазменной инфекции.Предполагается, что биовар Parvo является более патогенным, чем биовар T-960.[52] Однако роль серотипов остается невыясненной из-за отсутствия стандартных методик серотипирования.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Схема исследования
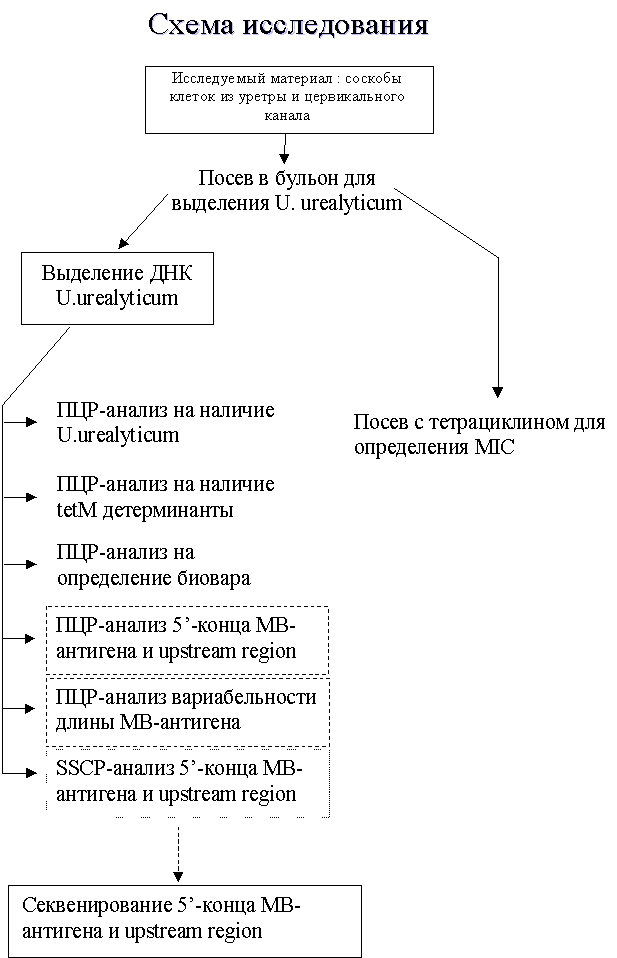
На первом этапе нашей работы мы применили комплексную схему исследования U. urealyticum у пациентов с циститом (см. схему 2). Она состояла из следующих этапов: забор клинического материала из уретры и цервикального канала женщин, больных циститом; культивирование этого материала для выделения U. urealyticum на селективной питательной среде, содержащей мочевину; выделение ДНК U. urealyticum; анализ полученной ДНК с помощью ПЦР для подтверждения бактериологических результатов, определение биовара U. urealyticum, исследование на присутствие tetM детерминанты в геноме U. urealyticum, исследования вариабельности гена МВ; SSCP анализ 5' конца гена МВ и прилежащей к нему регуляторной области; получение вторичной культуры U. urealyticum и определение минимальной ингибирующей концентрации к тетрациклину. Применение данной схемы исследования позволило охарактеризовать выделенные клинические изоляты и создать собственную коллекцию U.urealyticum для дальнейших исследований.
ЛИТЕРАТУРА
ВВЕДЕНИЕ
Класс Mollicutes объединяет микоплазмы, ахолеплазмы, спироплазмы, уреаплазмы, анаэроплазмы. Представителей класса Mollicutes характеризует ряд особенностей, уникальных для прокариот, а именно: отсутствие у них клеточной стенки и ее предшественников; наименьший среди прокариот размер генома (0,5-1,0 MДa); самое низкое относительно других микроорганизмов соотношение Г+Ц пар оснований в их ДНК; чрезвычайно простая организация клетки, имеющей минимальное количество органелл: цитоплазматическую мембрану, более похожую на мембрану клеток эукариот, прокариотический нуклеотид и рибосомы [18, 52]. Представители класса Mollicutes очень широко распространены в природе; они обнаружены у человека и других млекопитающих, птиц, рыб, моллюсков, насекомых, растений [42, 1, 2]. Их жизненный цикл и метаболизм зависят от клетки-хозяина, с которой они тесно связаны.
Большинство молликут - симбионты и факультативные паразиты растений и животных. У человека микоплазмы могут становиться причиной воспалительных процессов в различных органах, но преимущественно они связаны с эпителием. С M. pneumoniae связано развитие так называемых абактериальных атипичных пневмоний. M. genitalium, M. hominis, U. urealyticum ассоциированы с негонококковыми уретритами и другими заболеваниями урогенитального тракта [52]. На сегодняшний день считается доказанной роль микоплазм в развитии ревматоидного артрита [52].
Среди микоплазмозов большой процент занимают уреаплазмозы, т.е. заболевания, вызываемые U. urealyticum [78]. Сейчас известно, что уреаплазменное носительство может сопровождаться воспалительными процессами гениталий, приводящими к бесплодию, прерыванию беременности, преждевременным родам, пренатальной патологии плода, а также вызывать уретриты, простатиты и бесплодие у мужчин. Недавно было показано, что U.urealyticum является кофактором развития СПИД [37].
Благодаря большому разнообразию проявлений уреаплазменной инфекции и чрезвычайной генетической гетерогенности этого вида молликут возникла необходимость дифференциации различных типов U.urealyticum по их патогенным свойствам.
Были осуществлены попытки связать присутствие в инфицированном организме определенных сероваров U.urealyticum. с теми или иными клиническими проявлениями болезни. Однако, вследствие того, что возможны перекрестные реакции между различными сероварами U.urealyticum., и инфицированный организм в большинстве случаев содержит уреаплазмы, относящиеся к различным сероварам, попытка дифференциации по сероварам не принесла успеха [5].
Показать связь того или иного биологического варианта U.urealyticum. с определенными клиническими проявлениями уреаплазменной инфекции возможно при изучении факторов вирулентности уреаплазм и поиске адекватных подходов для дифференциальной диагностики уреаплазменной инфекции.
В настоящее время большое внимание уделяется вкладу изменчивости антигенных структур U.urealyticum в различные проявления уреаплазменной инфекции.
На основе полученных данных была сформулирована
Цель работы:
Изучение вариабельности структуры MB-антигена у клинических изолятов U.urealyticum и использование полученных данных для создания методики дифференцирования U.urealyticum биовара Parvo на генотипы.
Задачи:
ЛИТЕРАТУРНЫЙ ОБЗОР
ХАРАКТЕРИСТИКА КЛАССА MOLLICUTES.
|
|
|

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!