ПЕРЕВАРИВАНИЕ БЕЛКОВ В ЖЕЛУДОЧНО-КИШЕЧНОМ ТРАКТЕ
Переваривание белков в желудочно-кишечном тракте представляет собой расщепление пищевых белков, на составляющие их аминокислоты, лишенные данной видовой специфичности.
Конечная цель – превращение самых разнообразных белков, которые обладают видовой и тканево й специфичностью в мономеры, т.е. в АК, которые видовой специфичностью не обладают.
Известно, что даже однократное парэнтеральное введение чужеродных белков в организм человека вызывает выработку у него антител, а повторное парэнтеральное введение того же белка сопровождается развитием анафилактической реакции, представляющей прямую угрозу жизни. В то же время введение АК широко используется в клинической практике как лечебный препарат, кроме того, даже белковые гидролизаты, полученные из мышц животных, или белки гидролизат козеина (основной белок молока) используется в качестве белковых протозаменителей (??), поскольку они не обладают видовой и тканевой специфичностью и их введение представляет собой абсолютно безопасную процедуру
Расщепление белков в желудочно-кишечном тракте идет при участии ферментов- протеиназ, катализирующих гидролитическое расщепление пептидных связей. Протеиназы делят на две группы:
а) эндопротеиназы, катализирующие разрыв пептидных связей внутри белковых молекул с образованием полипептидов различной длины. К их числу относятся пепсин, гастриксин, трипсин, химотрипсин, коллагеназа, эластаза;
б) экзопротеиназы, катализирующие отщепление концевых аминокислот с N- или С-конца полипептида. К ним относятся карбоксипептидазы А и Б, лейцинаминопептидаза и аланинаминопептидаза.
Протеиназы желудочно-кишечного тракта обладают специфичностью действия — с наибольшей эффективностью они катализируют разрыв пептидных связей между вполне определенными аминокислотами. Это не означает, что они вообще не катализируют расщепление пептидных связей между другими аминокислотами, но эффективность катализа в последнем случае неизмеримо меньше.
Например:
а) пепсин — катализ разрыва пептидных связей, образованных аминогруппами Фенилаланин и Тирозин;
b) трипсин — катализ разрыва пептидных связей, образованных карбоксильными группами Лизин и Аргинин;
с) химотрипсин — катализ разрыва пептидных связей, образованных карбоксильными группами Фенилаланин, Тирозин и Три;
d) Карбоксипептидаза А — катализ разрыва пептидных связей, образованных С‑концевыми Фенилаланин, Тирозин и Три;
e) Карбоксипептидаза B — катализ разрыва пептидных связей, образованных C‑концевыми Лизин и Аргинин;
f) Aланинаминопептидаза — катализ разрыва пептидных связей, образованных N‑концевым Аланином.
В целом протеиназы желудочно-кишечного тракта в отношении своей специфичности обладают дополнительностью действия, т.е. за счет совокупности их каталитического эффекта с большой скоростью идет гидролиз всех пептидных связей в белковых молекулах. Более того, отсутствие одной из протеиназ, за исключением трипсина, обычно не приводит к существенному нарушению процесса переваривания белков.
Аминокислотный пул организма.
В жидкой среде организма, т.е. в плазме крови, в межклеточной жидкости и во внутриклеточной жидкости постоянно имеется определенное количество свободных аминокислот. Они образуют аминокислотный пул организма. Для человека массой 70 кг величина этого пула составляет около 30 г.
Пул постоянно пополняется за счет трех процессов:
Ø распада тканевых белков;
Ø поступления аминокислот из кишечника;
Ø синтеза заменимых аминокислот.
Ежесуточно в аминокислотный пул поступает до 400 г аминокислот в результате расщепления тканевых белков и около 100 г аминокислот поступает из кишечника. Объем синтеза заменимых аминокислот оценить крайне сложно, поскольку нет соответствующих критериев.
В то же время из аминокислотного пула ежесуточно изымается не менее 400 г аминокислот для ресинтеза тканевых белков и около 100 г. аминокислот расщепляется до конечных продуктов, для синтеза различных небелковых в-в, например, на глюконеогенез (синтезируется 100 – 120 г глюкозы), синтез некоторых гормонов, биогенных аминов, синтез липидов
В целом, за сутки через аминокислотный пул проходит не менее 500 г аминокислот, т.е. пул обменивается за сутки не менее 15 раз, а его постоянство есть отражение динамического равновесия между процессами, обеспечивающими поступление и использование аминокислотного пула.
Роль трансаминирования:
1. Один из этапов синтеза заменимых аминокислот из безазотистых соединений в клетках.
2. Так, в организме синтезируется ряд кетокислот, которые в результате трансаминирования могут превращаться в заменимые аминокислоты, именно за счет этого происходит оптимизация смеси аминокислот – перераспределение аминового азота поступающего из кишечника.
Чужеродные белки рациона, при расщеплении образуют смесь аминокислот, в которой соотношение отдельных аминокислот может быть весьма далеким от соотношения аминокислот в белках человеческого организма.
3. Трансаминирование в качестве одного из этапов входит в более сложные процессы — трансдезаминирование и трансреаминирование.
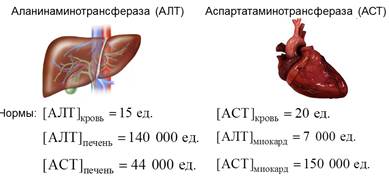
4. Определение активности 2-х трансминаз: аланинаминотрансфераза и аспартатаминотрансфераза нашло широкое применение в клинической практике, причем их используют в качестве диагностического теста
Названные ферменты являются внутриклеточными ферментами
В норме их активность в плазме крови очень низкая, поэтому повышение активности этих ферментов свидетельствует о деструкции той или иной ткани
· При кортимиокарде (?) резко повышается активность аспартатаминотранасферазы
· При болезни Боткина (?) наиболее характерным является повышение аланинаминотрансферазы
При правильном лечении активность этих ферментов восстанавливается до исходного уровня, поэтому определение активности этих ферментов используется не только в целях диагностики, но и для контроля за эффективностью проводимого лечения
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
Дезаминирование аминокислот представляет собой процесс отщепления от аминокислот аминогруппы с образованием свободного аммиака.
Дезаминирование в организме человека может протекать вдвух вариантах:
- в виде прямого дезаминирования, в ходе которого аммиак образуется при непосредственном отщеплении аминогруппы от аминокислоты
- в виде непрямого дезаминирования, в ходе которого отщепляемая аминогруппа вначале переносится с аминокислоты на другое соединение, от которого в дальнейшем отщепляется аммиак. Непрямое дезаминирование известно еще как трансдезаминирование.
Прямое дезаминирование, в свою очередь, на разных уровнях организации живых объектов встречается в 4 вариантах:
а) окислительное дезаминирование,
б) внутримолекулярное дезаминирование,
в) гидролитическое дезаминирование,
г) восстановительное дезаминирование.
В клетках человеческого организма работают лишь два из перечисленных механизма: окислительное и внутримолекулярное дезаминирование.
· Прямое окислительное дезаминирование.
· Внутримолекулярное
А) Прямое окислительное дезаминирование.
При прямом окислительном дезаминировании аминокислот образуются альфа-кетокислоты и аминогруппа отщепляется в виде аммиака.

Процесс идет в два этапа. На первом этапе происходит окисление путем дегидрирования и аминокислота превращается в иминокислоту. Атомы водорода переносятся на простетическую группы ферментов оксидаз, причем это ФМН для оксидазы аминокислот L-ряда и ФАД для оксидазы аминокислот D-ряда. Оксидазы являются аэробными дегидрогеназами, и после того как ФМН восстанавливается, атомы водорода переносятся на О2 с образованием токсичной перекиси водорода, которая расщепляется каталазой с образованием воды и О2
На втором этапе
Иминокислота является крайне неустойчивым соединением, атом углерола связан с крайне реакционно способной карбоксильной и иминогруппой, поэтому 2 этап протекает спонтанно, например образовавшаяся иминокислота без участия фермента взаимодействует с водой с образованием α-кетокислоты и аммиака:
Выделенная из организма человека оксидаза L-аминокислот представляет собой малоактивный фермент, к тому же он способен дезаминировать лишь около 10 аминокислот. Поэтому принято считать, что прямое окислительное дезаминирование аминокислот L-ряда не вносит существенного вклада в метаболизм этих соединений у человека.
В то же время в некоторых тканях организма человека присутствует высокоактивная дегидрогеназа L –глутамата.(глутаматдегидрогеназа), наибольшая его активность обнаружена в печени и в почка. Этот фермент обладает высокой специфичностьюи катализирует прямое окислительное дезаминирование L-глутамата. В начале образуется иминоглутамаи, а дальше спонтанно присоединяетсявода с образованием α-кетоглутарата.
Б) Прямое неокислительное дезаминирование
Три аминокислоты — гистидин, серин и треонин — в организме человека подвергаются дезаминированию, которое можно рассматривать как внутримолекулярное дезаминирование.

Гистидин под действием гистидазы превращается в уроканиновую кислоту:
Уроканиновая кислота при участии фермента уроканазы превращается далее в альфа-формамидо-L-глутаминовую кислоту, распадающуюся далее до L-глутамата, аммиака и муравьиной кислоты.
* Гистидаза обнаружена в печени и в коже. Интересно, что образующаяся в коже под действием гистидазы уроканиновая кислота выступает в качестве фактора, защищающего кожу от повреждающего действия ультрафиолетовой радиации. Фермент уроканаза, по-видимому, имеется только в печени. В крови активность этих ферментов в норме минимальна, но она повышается в крови при развитии опухолевых процессов в печени, в связи с чем определение активности этих ферментов в крови используется в качестве диагностического теста на опухолевые поражения печени.
Аминокислоты серин и треонин при участии пиридоксальфосфатзависимого фермента серин - треонин - дегидратазы подвергаются сходным превращениям, в результате которых серин превращается в пируват, а треонин в альфа-кетобутират. Схема дезаминирования серина:
СИНТЕЗ АМИНОКИСЛОТ В ТКАНЯХ
Если в клетках имеются альфа-кетокислоты - аналоги соответствующих аминокислот, то эти кетокислоты могут быть использованы для синтеза необходимых организму аминокислот путем трансаминирования, исключением является только ___(??), которые не вступают в р-ию трансаминирования. Таким образом, фактически незаменимыми в своем большинстве являются не аминокислоты, а их кетоаналоги, не синтезируемые в организме.
Источником аминного азота для синтеза аминокислот из соответствующих кетокислот путем трансаминирования является глутамат:
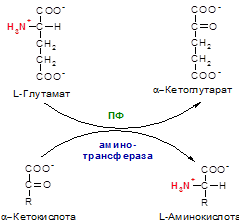
Пиридоксальфосфат выступает в качестве простетической группы. В результате: кетокислота превращается в LАК. А глутамат превращается в α-Кетоглутарат
Если в клетках нет достаточного количества глутамата, то он может быть синтезирован из 2-оксоглутарата и аммиака в реакции восстановительного аминирования за счет обратимости действия глутаматдегидрогеназы:
Комбинация реакций восстановительного аминирования 2‑оксоглутарата с последующим переносом аминного азота на кетокислоты получила наименование трансреаминирование и является основным путем синтеза заменимых аминокислот в организме. В происхождении кетокислот не имеет существенного значения, т.к.
1. Кетокислоты могут синтезироваться при окислении углеводов
2. Они могут быть получены при дезаминировании АК в к-ках любого органа или тканях
ОБЕЗВРЕЖИВАНИЕ АММИАКА
В организме человека в результате дезаминирования аминокислот, биогенных аминов или азотистых оснований некоторых нуклеотидов, ежесуточно образуется 15-17 г аммиака.
Кроме того, в качестве продукта жизнедеятельности микробной флоры аммиак постоянно образуется в кишечнике (гниение); этот аммиак легко всасываясь, поступает во внутреннюю среду организма.
Это очень токсичное соединение, которое блокирует работу цикла Кребса, а значит быстро приводит к развитию гипоэнергетического состояния и при высоких концентрациях аммиака в крови может наступить гибель.
Средняя концентрация аммиака в крови в норме не превышает 1 мг в 1 л
При повышении концентрации аммиака в крови наблюдаются симптомы аммиачного отравления:
· своеобразный тремор,
· повышенная раздражительность,
· нечленораздельная речь,
· затуманивание зрения
· затуманивание сознания
· а в тяжелых случаях отравления развивается кома и может наступить смерть.
Печень является основным органом, в котором происходит обезвреживание аммиака. В гепатоцитах обезвреживается до 90% образовавшегося аммиака. Аммиак превращается в мочевину — малотоксичное соединение, которое с током крови поступает из печени в почки и выводится с мочой. В норме в сутки с мочой выводится от 20 до 35 г мочевины. Небольшая часть образующегося в организме аммиака — до 1 г в сутки — выводится почками с мочой в виде аммонийных солей.
СИНТЕЗ МОЧЕВИНЫ
Аммиак, поступивший в печень или непосредственно образовавшийся в гепатоцитах вступает в орнитиновый цикл мочевинообразования, известный под названием цикла Кребса-Гензенлейта, открытый этими учеными в 1932 г.
Синтез мочевины начинается в митохондриях гепатоцитов с образования карбамоилфосфата:
( Реакция активации аммиака) – в матриксе митохондрий
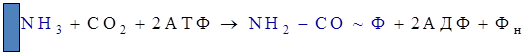 :
:
Данная реакция происходит в матриксе митохондрий
Образовавшийся карбамоилфосфат взаимодействует (в митохондриях) с орнитином с образованием цитруллина (АК).
Последующие стадии процесса протекают в цитозоле. Вначале цитруллин взаимодействует с аспартатом с образованием аргининосукцината, с участием фермента аргининосукцинатсинтетаза. Эта реакция энергозависима и сопровождается расщеплением АТФ до АМФ и пирофосфата, причем пирофосфат сразу же расщепляется пирофосфатазой на два остатка фосфорной кислоты и реакция становится необратимой — термодинамический контроль направления реакции и процесса в целом.
Далее аргининосукцинат расщепляется до аргинина и фумарата, под действием фермента аргининосукцинаттриазы (причем расщепление идет не гидролитическим путем) до АК аргинина и фумаровой кислоты
В заключитльной стадии аргинин, присоединяя воду, образует мочевину, и регенирирует орнитин. Таким образом орнитин вступает в цикл и выходит из него, поэтому он может использоваться повторно.
Мочевина из гепатоцитов поступает в кровь и выводиться в организме чрез почки
Фермент, который катализирует 4-ую реакция – фермент аргиназа, проявляет абсолютную специфичность действие, т.е. он расщепляет только аргинин.
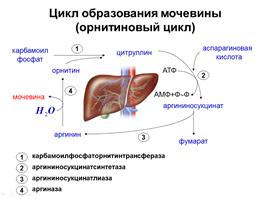
Суммарное уравнение синтеза мочевины:
Фумарат поступает затем в цикл Кребса и через оксалоацетат может вновь превращаться в аспартат и использоваться, в последующем, для синтеза
Из суммарного уравнения следует, что в состав мочевины включается 2 атома азота, один из которых из аммиака, второй — из аспартата, и атом углерода из углекислоты. На синтез одной молекулы мочевины клетка затрачивает 4 макроэргических эквивалента.
Если рассматривать происхождение атомов
NH3
↓
NH2
|
СО2 à C=O
|
NH2
↑
Асп
В норме концентрация мочевины в крови составляет 3,3-8,3 ммоль/л, причем азот мочевины составляет примерно 50% всего небелкового азота крови. Суточное выведение мочевины из организма составляет 20-35 г.
Количество мочевины, ежесуточно выводимой из организма, зависит от нескольких факторов и снижается при:
Ø недостаток пищевого белка(н-р, голодание)
Ø функциональные нарушения печени (т.к мочевина образуется именно здесь)
Ø нарушения активности ферментов синтеза
Ø нарушения выделительной функции почек
Ø нарушения аммиак-транспортных систем крови
Ø состояние метаболического ацидоза
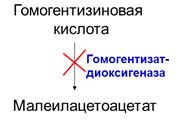
АЛКАПТОНУРИЯ
Вторым вариантом наследственного нарушения обмена тирозина является алкаптонурия. При этом в организме нарушен переход гомогентизиновой кислоты в малеилацетоацетат из-за отсутствия в клетках фермента гомогентизат-диоксигеназы.
В органах и тканях, в том числе в крови, повышается содержание гомогентизиновой кислоты, она в больших количествах выделяется с мочой, которая приобретает черный цвет из-за накопления в ней окрашенных продуктов конденсации гомогентизиновой кислоты. Однако каких-либо серьезных расстройств здоровья (в отличие от фенилкетонурии) при этом нарушении метаболизма тирозина не наступает. Иногда вследствие отложения продуктов конденсации гомогентизиновой кислоты в хрящах может развиваться потемнение ушных раковин или кончика носа, иногда развивается локальный артрит
НАРУШЕНИЯ ОБМЕНА АМНОКИСЛОТ
Нарушения обмена простых белков и аминокислот могут быть
· первичными, т.е. в основе своей иметь генетический дефект
· вторичными (развиваются или в результате какого-либо заболевания, несбалансированное питание (недостаточное содержание белков и АК))
Белковая недостаточность
Белковая недостаточность может развиваться или вследствие дефицита белка в пищевом рационе, в том числе при недостаточном поступлении с пищей одной или нескольких незаменимых аминокислот, или в результате нарушения усвоения пищевых белков при заболеваниях желудочно-кишечного тракта.
От белковой недостаточности по данным ВОЗ страдает в мире по меньшей мере 250 млн человек; основными причинами ее развития являются или голодание, или питание однообразной растительной пищей с недостаточным содержанием незаменимых аминокислот. Таким образом, проблема белковой недостаточности — это прежде всего социальная проблема, причем Россия в этом плане — отнюдь не исключение.
Главными симптомами (признаками) развития этого состояния являются
· отрицательный азотистый баланс,
· гипопротеинемия (снижение содержания белков в плазме крови)
· развитие отеков («голодные отеки»).
В организме нарушается синтез белков, что приводит к быстрой утомляемости, снижению резистентности организма к воздействию неблагоприятных факторов внешней среды и другим нежелательным явлениям.
В далеко зашедших случаях в организме нарушается синтез ферментов, принимающих участие в обмене аминокислот, нарушаются процессы дезаминирования, трансаминирования и лдекарбоксилирования аминокислот. Эти нарушения сопровождаются парадоксальным явлением — в крови пострадавших увеличивается содержание аминокислот, увеличивается и их выведение с мочой ( аминоацидурия ). В тканях нарушается также обмен отдельных аминокислот: так, в тканях накапливаетсягистамин, образующийся из гистидина; в результате нарушения обмена триптофана в организме снижается образование никотинамида и накапливается ксантуреновая кислота, обладающая токсичным эффектом в отношении бета-клеток поджелудочной железы.
При выраженной белковой недостаточности, например, при длительном голодании, нарушаетсявыработка пищеварительных ферментов желудочно-кишечного тракта, в том числе и протеиназ. Поэтому такие больные нуждаются в парэнтеральном введении аминокислотных гидролизатов для восстановления синтеза ферментов, участвующих в расщеплении белков в желудочно-кишечном тракте, и восстановлении процессов переваривания белков.
Особенно тяжело белковую недостаточность переносят дети: у них развивается тяжелое поражение печени, наблюдается остановка роста, исхудание, резко падает сопротивляемость организма к воздействию неблагоприятных факторов внешней среды.
Белковая недостаточность может развиваться и при тяжелых заболеваниях, поражающих органы ЖКТ.
ОБМЕН ПРОСТЫХ БЕЛКОВ И АМИНОКИСЛОТ.
Белки в организме человека выполняют множество функций. Среди них:
Ø Структурная;
Ø Каталитическая;
Ø Транспортная;
Ø Регуляторная;
Ø защитная и т.д..
На белки приходится около 45 % сухой массы тела. В таких органах как мышцы, легкие, селезенка белки составляют 80-85% их сухой массы, даже в костях на долю белков приходится около 28% сухой массы.
Белки органов и тканей постоянно обновляются, т.е. находятся в состоянии динамического равновесия между процессами их синтеза и распада. Установлено, что в организме человека массой около 70 кг ежесуточнообновляется около 400гбелков. Период полуобновления белков (время, за которое изменяется половина белков ткани) для организма человека составляет около 80 суток.
· У белков печени, плазмы период полуобновления всего лишь 10 дней
· Мышечная ткань – пол года
· Еще больше у ткани костей и зубов
Для обеспечения синтеза белков организм человека нуждается в наличии 20 аминокислот, которые входят в состав подавляющего кол-ва белков пищи. В то же время, человек и другие млекопитающие способны синтезировать лишь часть необходимых им аминокислот; другая их часть должна поступать с пищей.
Для человека абсолютнонезаменимымиявляются8 аминокислот: Валин, Лейцин, Изолейцин, Лизин, Фенилаланин, Триптофан, Треонин, Метионин.
Условно незаменимым относят Гистидин и Аргинин, синтез которых недостаточен для покрытия потребности организма.
Условно заменимые – Тирозин и Цистеин. Для их синтеза используются незаменимые Фенилаланин и Метионин и при недостатке Тирозина и Цистеина автоматически увеличивается потребность в незаменимых Фенилаланин и Метионин.
АЗОТИСТЫЙ БАЛАНС. НОРМЫ БЕЛКА В ПИТАНИИ.
Состояние белкового обмена в организме может быть оценено по соотношению поступающего в организм азота и азота, выводимого из организма. Это соотношение получило название “ азотистый баланс ”. Т.к. большая часть азота, поступающего в организм с пищей (около 95%) представляет собой азот белков или аминокислот; в то же время основная часть азота, выводимого из организма в составе конечных продуктов метаболизма, представляет собой опять же азот расщепленных в клетках аминокислот.
При положительный азотистом балансе в организм поступает больше азота, чем выводится. Наблюдается задержка азота в организме, что характерно для организма детей или для людей, выздоравливающих после длительной тяжелой болезни.
При отрицательном азотистом балансе выведение азота из организма превышает его поступление с пищей, что является результатом усиления распада белков в организме, не компенсируемым синтезом обновления. Такая ситуация встречается при длительном голодании или тяжелых заболеваниях или у лиц старческого возраста.
Для здоровых взрослых людей характерно азотистое равновесие, т.е. - поступление азота с пищей эквивалентно его выведению из организма.
Состояние азотистого баланса следует оценивать применительно к конкретному индивидууму, здоровому или больному. Дело в том, что, например, положительный азотистый баланс для здорового ребенка является нормой, в то же время положительный азотистый баланс для больного с поражением почек свидетельствует о задержке азотистых шлаков (конечных продуктов азотистого обмена) в организме и развивающейся интоксикации этими шлаками, тогда как положительный азотистый баланс в период выздоровления после тяжелой болезни говорит об улучшении состояния пациента.
Полное исключение белка из пищи приводит к развитию отрицательного азотистого баланса. Экспериментально установлено, что в условиях полного отсутствия белков (или аминокислот) в пище и при компенсации энергозатрат организма достаточным количеством жиров и углеводов выведение азота из организма стабилизируется и составляет 53 мг на 1 кг массы тела, что для человека весом 70 кг эквивалентно ежесуточномурасщеплению23,2гбелка. Эта величина получила название “ коэффициент изнашивания ” (кол-во азота при отсутствии белков в рационе, которое постоянно расщепляется и выводится в виде аммиака или мочевины).
Следовательно, человек не может длительное время находится на рационе, лишенном белков или аминокислот, поскольку из-за ежесуточного расщепления белков их количество в организме снижается ниже критического уровня и приводит к гибели.
Минимальное количество белков пищевого рациона, обеспечивающее наступление азотистого равновесия, получило название “ физиологический минимум ”. В условиях смешанной пищи эта величина равна двойному коэффициенту изнашивания и составляет 30-45г в сутки и в значительной степени зависит от полноценности белка, которая определяется по следующим признакам:
Ø во-первых, способностью ферментов пищеварительного тракта человека расщеплять эти белки до аминокислот. Ряд белков, такие как кератин волос или фиброин шелка, практически не расщепляются ферментами желудка и кишечника, в связи с чем не усваиваются организмом.
Ø аминокислотным составом белков. Пищевые белки должны содержать весь набор незаменимых Ак; процентное соотношение АК пищи должно максимально соответствовать АК-ому составу наших собственных белков.
Поддержание смешанной диеты, т.е. пища животно-растительного происхождения
Некоторые белки или вообще не содержат отдельных незаменимых аминокислот или содержат их в явно недостаточном количестве. Так, коллаген практически не содержит триптофана, а в белке кукурузы зеине недостаточно лизина.
Кол-во белка в питании, которое поддерживает равновесие различно
· Картофель – 30 г
· Молоко – 25
· Куринное яйцо – 20
· Мука и изделия из нее – значительно больше 40
Оптимальным содержанием белка в пище по данным ВОЗ является количество, определяемое из расчета 1 г белка на 1 кг массы тела. По отечественным нормам этот показатель несколько выше — 100-110 г для человека массой 70 кг или же примерно 1,5 г на 1 кг массы тела.
При обычном смешанном пищевом рационе, кол-во белков, которое обеспечивает организм 5000 кДж, содержит необходимое кол-во всех незаменимых АК








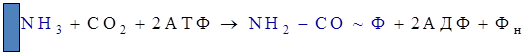 :
: