

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
Топ:
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Пептиды-биомиметики — низкомолекулярные вещества белковой природы, регулирующие различные физиологические процессы в коже путем сигнального воздействия на клетки.
В большинстве своем это водорастворимые соединения, поэтому для улучшения проникновения сквозь кожный барьер их часто модифицируют гидрофобными группами, например прикрепляют ацетатную группу или жирную кислоту, — такая гибридная молекула, состоящая из пептидной и липидной частей, представляет собой липопептид. Олигопептиды и их липидные модификации получают путем химического синтеза.
В косметологии также применяются гидролизаты различных белков (коллагена, пшеницы, овса, кукурузы, риса, молока) — это низкомолекулярные пептидные фрагменты, которые образовались в результате гидролиза крупных белковых молекул. К этим пептидам также может быть «пришита» пальмитиновая жирная кислота для их улучшения пенетрации.
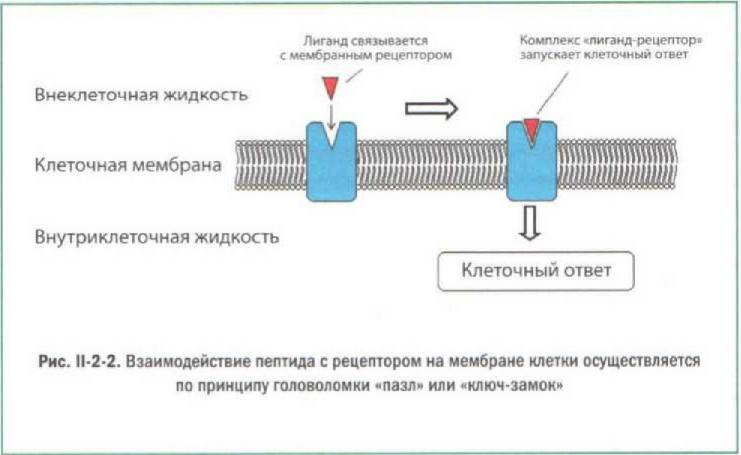
В коже липидная часть «отрезается» ферментами, высвобождая пептидный фрагмент, который начинает действовать в соответствии со своей природой. Несмотря на разнообразие ответов кожи, механизмы действия низкомолекулярных пептидов имеют много общего — как правило, они соединяются с клеточными рецепторами, которые воспринимают это как сигнал и отвечают определенными изменениями. Иногда вместо рецептора выступает другая мишень, например белок, который переходит в активную форму и запускает каскад реакций. Чтобы то ни было — рецептор или иная мишень, их взаимодействие с пептидом происходит по принципу «пазл» (ИЛИ «ключ-замок»).
По механизмам и направленности действия косметические пептиды биомиметики можно разделить на несколько групп:
|
|
1) ремоделирующие пептиды (Ремоделирующие пептиды улучшают качество кожи и омолаживают ее, регулируя естественные механизмы процессов распада и синтеза компонентов дермального матрикса и синтеза эпидермиса);
2) пептиды-стабилизаторы гомеостаза (Пептиды-стабилизаторы в целом улучшают состояние кожи за счет повышения ее собственного защитного потенциала. Например, повышающие антиоксидантную активность.;
3) пептиды-миорелаксанты (Пептиды-миорелаксанты (син. — пептиды-ботуломиметики) блокируют передачу сигнала о сокращении мышц с нервного окончания на мышечное волокно, однако механизм их действия иной, нежели у ботулинического токсина типа А.
Мимические мышцы вносят существенный вклад в формирование морщин. В результате поисков безопасных альтернатив инъекциям ботулотоксина появилась особая категория косметических препаратов, ослабляющих интенсивность мимики. В роли активного начала в них выступают пептиды-ботуломиметики, способные блокировать передачу сигнала о сокращении с нервного окончания на мышечное волокно. По сути, речь идет о параличе отдельных мышц, но только в гораздо более мягкой форме, нежели паралич, наступающий при действии паралитических ядов.

Несмотря на то что способы блокады ацетилхолинового рецептора у пептидов-миорелаксантов разные, результат один: закрытый рецептор — нет потока натрия — нет поляризации — нет мышечного сокращения.)
4) пептиды-регуляторы процесса меланогенеза (Пептиды-регуляторы меланогенеза могут воздействовать на процесс пигментообразования, ослабляя или, наоборот, усиливая выработку пигмента.);
5) пептиды-активаторы системы выработки антимикробных пептидов (Антимикробные пептиды (АМП) присутствуют в нашей коже и представляют собой химическое оружие защиты против микроорганизмов. Исследования возможности включения аналогов АМП в средства по уходу за кожей активно ведутся. Но сегодня уже используются синтетические пептиды, активирующие выработку в коже собственных АМП.
|
|
АМП — это короткие цепочки из 12-50 аминокислот, способные убивать клетки микроорганизмов путем разрушения их оболочки. АМП действуют как на грамотрицательные, так и на грамположительные бактерии, а также на грибы, вирусы, простейшие. Более того, АМП проявляют антимикробную активность в отношении штаммов бактерий, устойчивых кантибиотикам. Клетки млекопитающих и растений в силу особенностей строения своих мембран нечувствительны к АМП.
АМП действуют на заряженную отрицательно внешнюю оболочку грамотрицательных бактерий. На поверхности этой оболочки находятся катионы магния, которые нейтрализуют отрицательный поверхностный заряд. АМП вытесняют эти ионы и либо прочно связываются с отрицательно заряженным липополисахаридом, либо нейтрализуют отрицательный заряд на поверхности мембраны, нарушают ее структуру и проникают внутрь периплазматического пространства (рис. 2-2-7).
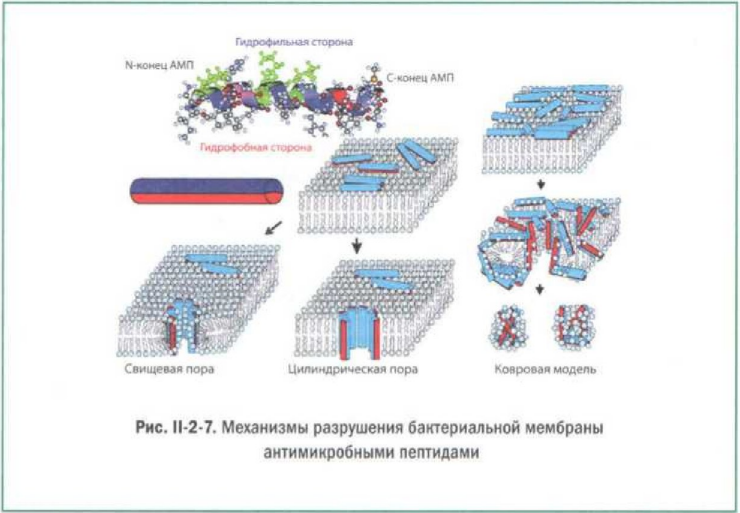
Цитоплазматическая мембрана бактерий также заряжена отрицательно. АМП могут встраиваться в цитоплазматическую мембрану и менять свою конформацию, образуя каналы (поры), нарушающие целостность клетки. Среди существующих моделей действия на микробную клетку антибактериальных пептидов есть и так называемая ковровая модель. Положительно заряженные молекулы пептидов как бы выстилают отрицательно заряженную мембрану бактерии, образуя «молекулярный ковер». Когда вся поверхность бактерии занята пептидами, ее мембрана начинает разрываться на куски. Кроме того, проникая в цитоплазму бактерии или другого паразита, АМП, будучи заряжены положительно, связываются с клеточными полианионами (такими, как ДНК и РНК) и инактивируют их, что также приводит к гибели бактериальной клетки.);
6) пептиды-иммуномодуляторы (Пептиды-иммуномодуляторы нормализуют иммунный статус кожи. При старении нарушается соотношение кожных цитокинов, в частности, усиливается выброс провоспалительных цитокинов ФНО-а, ИЛ-1, ИЛ-6, ИЛ-8, активирующих металлопротеиназы и усиливающих деградацию межклеточного матрикса)
7) пептиды-нейротрансмиттеры (Пептиды-нейротрансмиттеры способны воздействовать на кожные нервные окончания, влияя на кожную чувствительность);
8) пептиды, улучшающие микроциркуляцию и лимфотон. (Известны пептиды, способные регулировать проницаемость сосудистой стенки и уменьшать отечность ткани. Развитию отека способствуют потеря эластичности кожи, мышечная «слабость», нарушение микроциркуляции и проницаемости сосудистой стенки. Эта проблема часто возникает в области глаз — результатом становятся темные круги и одутловатость, с которыми трудно бороться. Разработано несколько ингредиентов пептидной природы, применение которых улучшает состояние кожи вокруг глаз благодаря их противоотечному действию.)
|
|
Белки
Классификация белков (протеинов)
Деление на белки и пептиды по числу аминокислот весьма условно. Считают, что белки содержат в молекуле от 100 до 10 000 аминокислот. Все огромное разнообразие белковых соединений живых организмов построено из 20 видов аминокислот (табл. 2-2-1). Полипептидные цепи, содержащие аминокислоту цистеин, в местах его расположения скреплены дисульфидными связями (-S-S-). Между аминокислотами в белках, как правило, не существует иных химических связей, кроме пептидных и дисульфидных.

Существует несколько классификаций белков: по химическому составу, структуре, функциям в организме, по строению молекул.
По химическому составу белки делят на простые и сложные. Простые белки состоят только из остатков аминокислот. Сложные белки помимо аминокислот могут содержать какие-либо еще соединения. Если это металлы, то такие белки называют металлопротеиды, если это углеволы, то белки называют гликопротеиды, если жиры, то — липопротенды, если нуклеиновые кислоты, то — нуклеопротеиды.
По функциям белки делят на:
1. структурные, которые образуют ткани и органы человека;
2. каталитические, которые обеспечивают протекание необходимых биохимических реакций;
3. транспортные, осуществляющие перенес различных веществ в клетки и из клеток;
4. защитные, связанные с иммунной системой человека;
5. гормоны, обеспечивающие регуляцию многих жизненно важных процессов (например, рост, половое созревание и т д.).
По строению молекул белки делят на фибриллярные, имеющие линейные молеку и глобулярные, молекулы которых — и глобулярных свернуты в клубок, или глобул.
|
|
Фибриллярные белки представляют собой волокнистые вещества, большей частью нерастворимые в воде и солевых растворах. Их пептидные цепи ориентируются в волокне параллельно друг другу и образуют пучки. Рентгенографические исследования показали, что полипептидные цепи фибриллярных белков закручены внутри пучка в спираль благодаря наличию водородных связей. Многие структурные белки относятся к фибриллярным.
Глобулярные белки частично растворимы в воде или в солевых растворах. Их полипептидные цепи плотно свернуты в компактные сферические структуры (шар; эллипсоид вращения и т п.) Выводы о форме макромолекул глобулярных белков сделаны на основании рентгенографических, электронно-микроскопических, осмометрических и вискозиметрических измерений. Эти белки обычно выполняют в клетках динамические функции, к глобулярным белкам относятся почти все известные ферменты, антитела, некоторые гормоны и транспортные белки.
Интересная особенность белков и пептидов заключается в том, что в процессе выполнения своих функций они, как правило, соединяются с другими белками. Формирование белкового комплекса осуществляется по принципу головоломки «пазл» или замок-ключ — путем соединения подходящих по форме участков (рис. 1-2-2). В связи с этим биологическая активность белковой молекулы очень сильно зависит от формы молекулы: если белок принимает иную форму, его функциональность меняется, как правило в сторону снижения.
Форма белков определяется, во-первых, их аминокислотной последовательностью, и во-вторых, окружающей средой. Среди аминокислот есть гидрофобные и гидрофильные. Находясь в водной среде, длинная белковая цепочка скручивается и складывается до тех пор, пока все гидрофобные участки не спрячутся от воды. При этом между различными участками одной молекулы образуются слабые ионные связи, стабилизирующие полученную форму. Прочность этих связей зависит от кислотности среды, температуры, ионного окружения и других факторов, поэтому, попав в неподходящую среду, белок часто теряет форму (денатурирует). Пептиды гораздо короче белков, поэтому их форма определяется главным образом тем, какие аминокислоты и в каком порядке в них входят, и в меньшей степени зависит от характеристик внешней среды.
Структура белка
Строение белка определяется несколькими уровнями его структуры.
Первичная структура — это последовательность аминокислот в молекуле белка. Это непосредственно химическая структура и определяют ее химическими методами.
Вторичная структура белка формируется водородными связями между отдельными участками молекулы белка, благодаря которым молекулы белка или закручиваются в спираль, или образуют структуру складчатого типа.
|
|
Третичная структура определяет пространственную форму молекулы белка. Если это длинные цепочки, связанные вместе и образующие фибриллу (волокно), то белок называют фибриллярным. Если молекула белка свернута в клубок, то белок будет глобулярным.
Четвертичная структура образуется, если несколько белковых молекул объединяются вместе. Так, белок гемоглобин, переносчик кислорода в крови, состоит из четырех полипептидных цепей, объединённых вокруг иона железа Fе.
Для каждого белка характерна по крайней мере одна трехмерная структура, в которой он стабилен и проявляет свою биологическую активность при физиологических условиях (температура и рН). Эту структуру называют нативной конформацией белка.
Большая часть белковых молекул сохраняет свою биологическую активность в узкой области температуры и рН. При повышении температуры или при смещении рН в кислую или щелочную области наблюдается денатурация белков. Они утрачивают свою биологическую активность, ферменты теряют способность катализировать соответствующие химические реакции. Причиной денатурации является развёртывание полипептидной цепи. Чем выше температура, тем более беспорядочной оказывается конфигурация развернувшейся цепи. При температурах, превышающих 50 °С, почти все белки денатурируют.
Структурные белки кожи
По своему строению белки кожи — это структурные фибриллярные белки. Типичный структурный белок кожи — это коллаген (см. раздел 2.1.).
Коллаген составляет 30—40% всех белков в организме, это важнейший белок соединительной ткани, сухожилий, кожи, хрящей и костей, а также строительный белок всех животных клеток, обеспечивающий их прочность. Молекулярная масса коллагена колеблется от 300 до 500 тысяч (300—500 кДа). По данным рентгеноструктурного анализа у высших млекопитающих и человека молекула коллагена состоит из трех перекрученных в тройную спираль и тесно связанных друг с другом полипептидных целей. Она достаточно прочна, и выдерживает нагрузку до 600 кг/см^2.
Длина молекулы примерно 3000 А (1 ангстрем = 10^-9м), что составляет 0,003 мм. Каждая полипептидная цепь коллагена содержит около 1000 аминокислотных остатков. Одну треть всех аминокислотных остатков коллагена составляет глицин, а одну четверть — пролин или оксипролин.
Коллаген синтезируется в клетках — фибробластах. Образование коллагена в клетках возможно лишь при наличии коротких аминокислот, таких как глицин (его в коллагене около 359%), аланин (21%), валин и цистеин. Увеличение физических нагрузок также способствует синтезу коллагена. Поэтому у людей, занимающихся бодибиллингом, должна быть диета, насыщенная этими аминокислотами.
При старении организма постепенно увеличивается число связей между полипептидными цепочками в молекуле коллагена, и упругость молекулы уменьшается.
Другой белок кожи — эластин. В молекуле эластина чередуются участки с фибриллярной и складчатой структурами. Эластин входит в состав кожи и волос. Этот белок может изменять длину своей молекулы, т. е. сокращаться. Поэтому эластин входит также в состав связок, сухожилий, кровеносных сосудов, находится В волосяной сумке. Окончательно структура эластина еще не выяснена.
В состав кожи и волос входит еще один белок — кератин. Существуют две его конфигурации: альфа и бета-кератин. Волосы, кожа, ногти состоят из параллельно расположенных полипептидных цепей кератина, имеющих правую о-спиральную конфигурацию. В волосах три или семь спиралей могут быть скручены вместе. Такая структура напоминает трех- или семижильный кабель. В альфа-кератине содержится много остатков цистеина, расположенных таким образом, что между соседними пептидными цепочками образуются дисульфидные «мостики». Эти дисульфидные связи придают а-кератинам прочность и стабильность.
Параллельные цепи в вытянутой зигзагообразной конформации бета-кератина связаны между собой поперечными водородными связями и образуют структуры типа складчатого слоя. В поперечном связывании принимают участие все пептидные связи, что придает структуре высокую стабильность. Волосы и ногти человека на 5—8% состоят из бета-кератина. Он нерастворим в воде, но обладает способностью набухать и размягчаться под действием воды. Это заметно, когда ногти слегка размягчаются в воде, а потом снова затвердевают после испарения воды. То же происходит с кератинами кожи и волос.
|
|
|

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!