(сообщения пресс-службы Минсельхоза РФ)
Январь-декабрь 2007 года
| № п/п
| Страна, регион
| Месяцы
|
Федеральные округа
|
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
| 9
| 10
| 11
| 12
|
| 1
| Алтайский край
|
|
|
|
|
|
|
|
|
|
|
|
| Сибирский
|
| 2
| Республ.
Калмыкия
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 3
| Курганская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Уральский
|
| 4
| Новосибир-ская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Сибирский
|
| 5
| Омская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Сибирский
|
| 6
| Ставрополь-ский край
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 7
| Тамбовская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Центральный
|
| 8
| Тульская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Центральный
|
| 9
| Тюменская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Уральский
|
| 10
| Челябинская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Уральский
|
| 11
| Астраханская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 12
| Московская обл.
| -
| 5/5 Пти-чий ры-нок
|
|
|
|
|
|
|
|
|
|
| Центральный
|
| 13
| Республ. Тыва
|
|
|
|
|
|
|
|
|
|
|
|
| Сибирский
|
| 14
| Республ. Дагестан
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 15
| Кабардино-Балкарская Республ.
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 16
| Краснода-рский край
|
| 1/0 Анапа
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 17
| Ставрополь-ский край
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 18
| Республ. Адыгея
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 19
| Чеченская Республ.
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 20
| Республ. Северная Осетия
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 21
| Волгоград-ская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 22
| Томская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Сибирский
|
| 23
| Ростовская обл.
|
|
|
|
|
|
|
|
|
|
|
|
| Южный
|
| 24
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Σ=
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Согласно статистическим данным ИАЦ Россельхознадзора (ФГУ «ВНИИЗЖ»), во втором квартале 2007 г. грипп птиц, в том числе водоплавающих, при 95% нормальном распределении среднего значения (М) попадает в интервал ±2m (стандартной ошибки среднего) и находится в зоне эпидемиологического порога с минусом 101% ниже значения М. На данный момент минус 101% составляет около ½ m, ближе к средней стандартной: M±2m=13,15±13 (0,15-26,15).
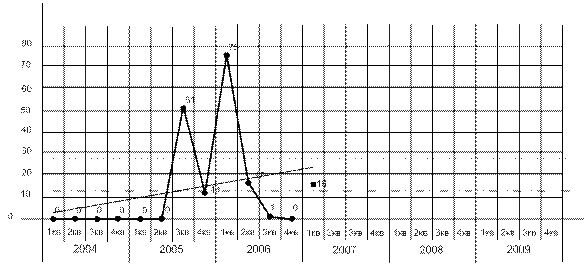
Рисунок 7. Эпидемиологическое состояние гриппа птиц в Российской Федерации
(2004-2006 гг)
В мае-июне 2007 г. специфические антитела к вирусу А подтипа Н5N1 обнаружены в 17 сыворотках крови разных видов околоводной и водоплавающей дикой птицы на территории 4 субъектов Сибирского федерального округа. Генетический материал вируса А Н5 обнаружен в 47 пробах материалов дикой перелётной птицы в Алтайском крае, Усть-Ордынском и Бурятском автономных округах и Республике Бурятия.
Из общего количества проб сывороток (2200), отобранных в вышеназванных субъектах и пяти районах Томской области, только 15 проб дикой птицы показали наличие антител одновременно к вирусу с Н5 и Н7.
Сообщение EuroNews: В пригороде Праги (Чехия, 9-11 июля 2007 г.) во время вспышки гриппа убиты 70000 кур. Ветеринарная служба Республики утверждает, что птица заразилась от лебедей, болезнь которых была отмечена в июне этого года.
В августе 2007 года в Германии (г. Эрланген) после установления диагноза на грипп был проведён убой 160 тысяч больных и контактных уток на одном из самых крупных предприятий страны. Предполагают, что ортомиксовирус был завезён с утятами из частных утководческих ферм Нижней Саксонии. Подтип H5N1 возбудителя был идентифицирован в институте им. Лёффлера.
В ФГУ ВНИИЗЖ в 2008 г. был исследован биоматериал от 60 видов птиц, включительно гусеобразных, ржанкообразных, веслоногих, гагар, пеганок, попугаев, журавлей, куриных, воробьиных и веслоногих. Из 1570 проб геном ортомиксовируса выявлен в 14 пробах от 5 видов (кряквы, чирка – свистунка, грача, воробья и гуся белолобого), из них подтипы с Н5, Н4, Н3, и Н13 в Ростовской области и Красноярском крае (кроме лебедя) и геномный материал типа А на о. Врангеля Чукотской АО. Получены три изолята вируса с антигенной формулой Н4N6 и один – H5N1. Следует отметить, что Н3, Н4 часто присутствовали в птице до июля 2005г. – начала энзоотии. Из 1082 проб, исследованных на наличие антител к Н5, 34 оказались положительными (метод ИФА набор фирмы «Sinbiotics»), из них 24 - от вакцинированного поголовья. В Алтайском крае в 10 пробах выявлены антитела к подтипу Н5.
В течение 2008г. во ВНИИЗЖ проверены 8600 проб крови не вакцинированных кур 412 птицехозяйств России, обслуживающий персонал которых содержит домашнюю птицу. Антитела к ортомиксовирусу с Н5 не обнаружены (Ирза В.Н., декабрь 2008г.).
В августе 2010г. гибель 367 девяти видов диких птиц на озёрах вТуве России (на границе с Монголией), во Вьетнаме пало 500 уток, Лаосе – 44 птицы, Камбоджии 1167 заболело, из них 900 кур и уток пало. Единичные случаи болезни людей в Египте, Бенгладеш и Индонезии (августе 2010г).
Течение и симптомы болезни. Инкубационный период после инфицирования высоковирулентным вирусом длится от нескольких часов до трёх суток, тогда как слабовирулентным – до 14 суток.
Проявление симптомов гриппа зависит от вирулентности и дозы вируса, способа заражения, вида, породы, возраста и индивидуальной резистентности (или толерантности) птицы в момент заражения, проведённых ранее предварительных профилактических мер – вакцинации или применения антивирусных лечебных препаратов, и других факторов.
Болезнь протекает в острой, подострой или хронической формах с поражением, чаще, верхних дыхательных путей. При острой и подострой формах чаще отмечают угнетение, шаткость походки, выделение из носовых отверстий прозрачной или сероватой жидкости, взъерошенность оперения, одно- или двухстороннюю припухлость подглазничных синусов. Перед гибелью наблюдают затрудненное дыхание и судороги.
Поражение желудочно-кишечного тракта сопровождается постоянной диареей с выделением жидких фекалий зеленоватого цвета. В группах больных в течение 5-10 суток гибнет от 10 до 100% поголовья. Нередко болезнь, вызванная высокопатогенными штаммами, протекает без проявления каких-либо симптомов и заканчивается внезапной гибелью птицы в более короткий период (1-3 суток).
Хроническая форма проявляется малозаметными симптомами, наличием в группе разновесных особей с признаками синусита и перемежающейся диареей. Течение болезни длительное - до 2 недель. Чаще болеет молодняк 20-30–суточного и старшего возраста. Летальность составляет до 5-10%, причём при ассоциации вируса гриппа с другими патогенами этот процент увеличивается (18, 37, 39, 2748).
Многолетние наблюдения за гриппом (подтипа H5N1) не показали какие-либо отличия в признаках от других, проявляющихся при подтипах с другой формулой. Чаще в литературных источниках констатируют, что проявление симптомов болезни у птиц различно и зависит чаще от возраста, пола, сопутствующих инфекций и факторов окружающей среды.
Классические признаки болезни малохарактерны, к ним относятся:
- повышение смертности в целом по стаду;
- пониженная активность и существенная депрессия;
- снижение потребления корма и истощение, сопровождаемое диареей;
- снижение яйценоскости;
- респираторный симптомокомплекс, при котором признаки болезни варьируют от слабых до сильных.
L. Perkins и D. Swayne (2001 г.) описали симптомы болезни у различных видов птиц после интраназальной инокуляции высокопатогенного штамма НК/220, выделенного от людей и кур в 1997 г. Вирус в дозе 6,0 lg ЭИД50, спустя 1-40 суток после заражения, индуцировал 100% заболеваемость кур пород белый леггорн и плимутрок, японских перепелов, американских куропаток, индеек, обыкновенных цесарок, фазанов и 75% - азиатских кекликов 4-недельного возраста(51).
Признаки проявлялись после короткого инкубационного периода, у некоторых особей гибель наступала через 6-8 часов после депрессии. На 1-2 сутки отмечали парезы, переходящие в паралич ног, а также вестибулярные нарушения (искривления шеи и общие отклонения в поведении). Происходила повышенная эвакуация жидкого фецеса и уратов. В фекалиях кур присутствовала кровь, в фекалиях других видов птиц – слизь и прожилки уратов. Спорадически выявляли одышку и жидкие выделения из носа и глаз. 25% азиатских кекликов переболели гриппом с менее выраженными клиническими признаками. Как правило, к 4-5 суткам экспериментальная инфекция завершалась для всех видов птиц благоприятно, кроме кекликов, среди них летальность составляла 100%.
В Тюменской области России Фролов А.В. и др. (август 2005 г.) наблюдали следующие клинические признаки гриппа (H5N1) у гусей и уток: круговые движения или вытягивание головы вверх с последующим запрокидыванием её на спину; слабость, угнетение, выраженную депрессию или, чаще, коматозное состояние; парезы или паралич ног – птица лежит и не в состоянии передвигаться; частое и затруднённое дыхание из-за отёка лёгких; а также слепоту как результат помутнения роговицы, развития керато-конъюнктивита и склеивания век.
Среди представителей дикой фауны чаще симптомы наблюдали у молодняка кряквы: утята внезапно совершали круговые движения по воде, переворачивались на спину и не реагировали на приближение человека. Фролов А.В. и др. отмечали сравнительно высокую чувствительность молодняка водоплавающих к заболеванию – симптомы болезни проявлялись значительно ярче, а гибель наступала быстрее, чем у взрослых особей. Авторы утверждают, что клиническая картина гриппа, вызванная слабо- или высокопатогенным вирусом, неспецифична, так же как и патологоанатомические изменения, которые в комплексе применимы только для постановки предварительного диагноза (25).
Патогенез. Ортомиксовирус уток репродуцируется в эпителиоцитах слизистой оболочки дыхательной системы и конъюнктивы, вызывает их дегенерацию и некроз. Интенсивность поражений других органов зависит от патогенности возбудителя и резистентности организма. Процесс носит характер общей токсикоинфекции, хотя размножение вируса чаще ограничивается верхними отделами дыхательной системы – клетками ткани носовой полости, подглазничных синусов, гортани и трахеи.
Первичное инфицирование васкулярного эпителия и фагоцитов приводит к быстрому и системному распространению патогенного вируса, его активной репродукции в клетках многих органов и гибели птицы.
Высокопатогенные вирусы часто репродуцируются в желудочно-кишечном тракте, выделяются в больших количествах с помётом, инфицируя окружающую среду (почву и воду) с вовлечением в инфекционный процесс других видов (порой весьма отдалённых) животных, сохраняя тканевой тропизм.
Патологоанатомические изменения. Макроскопические изменения, характерные для гриппа, в основном находят в верхних дыхательных путях. При острой форме отмечают гиперемию слизистой оболочки носовой и синусной полостей и содержание в них прозрачного жидкого или серовато-желтого густого экссудата с примесью фибрина. В околосердечной сумке содержится фибринозный экссудат. Довольно редко регистрируют катар железистого желудка и тонкого отдела кишечника. Печень увеличена, полнокровна, дряблой консистенции.
Гистологическими методами у убитых и павших уток устанавливают конъюнктивит, ринит, аэросаккулит, трахеит и синусит. В некоторых случаях отмечают точечные кровоизлияния и некроз гепатоцитов, а также тельца-включения в печеночных клетках, окрашенных тетрацинфуксином или по методу Нобле.
Один из самых патогенных вирусов (подтип H5N1), выделенный в Гонконге (1997 г.), в экспериментальных условиях у курообразных в первые 1-2 суток после инокуляции индуцировал в 42-100% случаев спленомегалию с пятнистым поражением паренхимы различной формы и цвета, увеличение почек с бледностью паренхимы (22-94% случаев), сопровождающиеся скоплением уратов в мочеточниках, уплотнением в лёгких с отёком и застоем крови (у кур – в 94% случаев, у кекликов – в 17%), кровоизлияниями в слизистой оболочке желудочно-кишечного тракта (у кур – в 89% случаев, у японских перепелов – в 15%), преимущественно в лимфоидных областях, соединении пищевода и железистого желудка, в местах нахождения пейеровых бляшек и лимфоидных фолликулов слепой кишки, клоакальной бурсе. В содержимом кишечника постоянно присутствовала кровь. В 5-83% случаев можно обнаружить петехиальные и экхимозные кровоизлияния на эпикарде и серозных оболочках печени и кишечника, наличие серозных экссудатов у большинства видов птиц. Гиперемия и отёк конъюнктивы были более присущи для кур (53% случаев).
После интраназального заражения вирусом (подтип H5N1) у кур обнаружили следующие микроскопические (гистологические) изменения: ринит, синусит с некрозом эпителия, интерстициальную пневмонию, миокардит, некроз нейронов, энтерит (кровоизлияния, лимфоидное истощение, эпителиальный некроз), редко некроз поджелудочной железы, истощение клеток костного мозга, лимфоидное истощение селезёнки, бурсы Фабрициуса и тимуса, некроз надпочечников.
Изменения в органах коррелировали с результатами обнаружения вирусного антигена. Наиболее насыщенными антигеном были надпочечники, лёгкие, сердце, селезёнка и головной мозг кур. В течение 1-2 суток после заражения вирус постоянно выявляли в эпителии носовой полости, подглазничных синусов, отделах дыхательной системы, кишечника и кортикотрофных клетках надпочечников (28, 37, 53, 43, 51, 55).
В Тюменской области России Фролов А.В. и др. (август 2005 г.) для всех видов домашней птицы при гриппе H5N1 чаще отмечали следующие патологоанатомические изменения: сосудистое расстройство в виде многочисленных точечных кровоизлияний в различных внутренних органах и видимых слизистых оболочках, катарально-геморрагические ринит и трахеит, ларингит, геморрагический энтерит и гастрит (железистого желудка), катаральный конъюнктивит, воспаление и отёк лёгких (иногда с участками некроза), дистрофические процессы в печени и почках, изменения структуры поджелудочной железы (большей частью с участками некроза). Геморрагический гастрит чаще отмечали у гусей. Авторы предупреждают, что у кур геморрагии на границе железистого и мышечного отделов желудка (в виде пояска) очень схожи с изменениями при болезни Ньюкасла кур, а под кутикулой мышечного (отдела) желудка могут быть кровоизлияния (25).
Диагноз и дифференциальная диагностика. Диагноз на грипп уток ставят на основании результатов лабораторных исследований с учетом сведений об эпизоотической обстановке, клинического проявления болезни и патологоморфологических изменений.
Для вирусовыделения используют пробы трахеи, легких, воздухоносных мешков, печени, головного мозга, крови, носовых выделений, экссудата подглазничных синусов, слизи из клоаки и спинномозговой жидкости больной и павшей птицы.
Из общего числа отобранных проб органов или каждого в отдельности готовят 10-20% суспензию на физиологическом растворе, осветляют при 800-1000g в течение 10-15 минут, обрабатывают активными антибиотиками, например, пенициллином - 1000 ЕД/см3 и стрептомицином - 250 мкг/см3 и используют для заражения КЭ 9-11-суточной инкубации, а также индюшиных и УЭ 12-15-суточного возраста. Исследуемый материал вводят в аллантоисную или амниотическую полости или наносят на ХАО. Специфическая гибель эмбрионов наступает через 24-48 часов. При пассировании вирулентность выделенного агента возрастает; на третьем и последующих пассажах в аллантоисной жидкости и органах эмбрионов вирус накапливается до 107 ЭЛД50/см3 и приобретает гемагглютинирующее свойство. У эмбрионов изменения выражены в виде гиперемии кожи в области головы, шеи, ног и туловища (18, 28).
Не исключено, что больные утки могут содержать вирус, высокопатогенный для других видов птиц, например, курообразных. Учитывая это обстоятельство, вероятно, необходимо для заражения (интраназального, внутривенного, внутримышечного или алиментарного) использовать молодняк и эмбрионы кур, индеек, японских перепелов, куропаток, цесарок, фазанов и, в последнюю очередь, азиатского кеклика. На 2-3 сутки, до начала индукции специфических антител, вирус максимально накапливается в лимфоидных органах (поджелудочной железе, щитовидной железе, тимусе, кишечных пакетах лимфоузлов, селезёнке) и только потом - в лёгких и носоглотке, например, при заражении штаммом А/курица/Гонконг/220/97 (Н5N1).
После антибиотикограммы надосадки отобранных проб органов используют для воспроизводства повторной инфекции и последующей идентификации возбудителя серологическими (РДП, РЗГА, РН, ИФА) и биологическими методами (РГА, ПЦР, или ПЦР-ИФА.
Клеточные культуры, в том числе первично трипсинизированные культуры клеток куриных и утиных эмбрионов, менее пригодны для вирусовыделения.
Идентификацию выделенного изолята вируса проводят в РЗГА, РН, РДП, ПЦР или ИФА на основе моноклональных и поликлональных антител, а также в реакции торможения нейраминидазной активности (РТНА). Для дифференциации выделенного вируса вполне достаточно использовать один из двух наборов, предлагаемых в России биологической промышленностью (разработано во ВНИИВВиМ). Применение первого "Набора антигенов и сывороток для диагностики гриппа птиц" предоставляет возможность распознать изоляты ортомиксовируса гриппа по восьми серологическим вариантам, а также определить наличие специфических антител к возбудителю в сыворотках больных и переболевших уток. С помощью второго "Набора для идентификации вирусов ньюкаслской болезни и гриппа птиц", при использовании РЗГА и РН, возможно провести дифференциацию возбудителей парамиксовирусной инфекции уток и гриппа, ретроспективную диагностику указанных инфекций и контроль напряженности иммунитета.
Постановка реакций проводится согласно наставлениям по применению наборов. Принято считать, что при постановке РЗГА с 4 ГАЕ выделенного вируса и известных гемагглютининов из наборов, а также 1% взвесью эритроцитов кур на физиологическом растворе рН 7,2-7,4 возможно получить более достоверные результаты.
С помощью РДП преципитирующий антиген выявляют в 30-50% суспензиях ХАО инфицированных эмбрионов, приготовленных на физиологическом растворе рН 7,2-7,4 и обработанных формальдегидом в конечной концентрации 0,1%. Обнаружение антигена проводят с использованием контрольного нормального эмбрионального антигена, специфической и нормальной сывороток в 0,7% геле агара при температуре 36-38°С в течение 48 часов. Реакция пригодна для ретроспективного выявления преципитирующих антител в пробах сывороток крови уток, отобранных спустя 2-4 недели после начала проявления клинических признаков (рекомендовано Санитарным кодексом наземных животных МЭБ 2008г.). Положительный антиген должен обладать гемагглютинирующей активностью не ниже 1:512, а инфекционной – 105-107 ЭЛД50/см3.
РТНА проводят для определения принадлежности выделенного вируса по его нейраминидазной активности.
ИФА является экспрессным и высокочувствительным серологическим методом. Литературных сведений по диагностике гриппа уток методами ИФА не имеется. Однако известно, что все подтипы ортомиксовируса птиц идентичны по NP-антигену, имеют общие антигенные детерминанты, и большинство их изолированы от уток. Поэтому разработанные методы - "сэндвич" - вариант и «непрямой» ИФА на основе поликлональных и моноклональных антител вполне пригодны для диагностики гриппа уток.
В 1987 году в Индии использовали реакцию встречного иммуноэлектроосмофореза для обнаружения специфических антител к вирусу гриппа. Тест ставили в 0,9% геле агарозы с применением антигена-суспензии ХАО павших куриных эмбрионов, зараженных вирусом. Антитела были обнаружены в течение 60 минут как в гипериммунных сыворотках, так и у птиц, вакцинированных против гриппа.
Davison S. et al. (США, 1998) сообщают, что стандартными тестами диагностики гриппа являются выделение вируса из инфицированных тканей и обнаружение антигемагглютининов в сыворотке крови или желтке яиц. Авторами разработан экспресс-метод для обнаружения вируса гриппа А у птиц на основе теста выявления вируса гриппа человека. Коммерческий набор для иммуноферментного анализа с захватом антигена (ИФА-ЗА) был испытан на чувствительность, специфичность и экспрессность при диагностике гриппа птиц, вызванного непатогенным вирусом H7N2 у естественно инфицированных сельскохозяйственных птиц. В период недавней вспышки гриппа птиц, вызванной H7N2, ИФА-ЗА использовали для экспресс-диагностики и принятия решения о введении карантина. С февраля по август 1997 г. 1524 пробы из 295 промышленных стад несушек, молодок и бройлеров поступило в диагностическую лабораторию Центра терапии и патологии птиц New Bolton с целью выделения и идентификации вируса гриппа птиц в ИФА-ЗА. Специфичность указанного метода составила 100%, а чувствительность – 79%. Авторы полагают, что ИФА-ЗА может быть использован как дополнительный метод диагностики гриппа (40).
Zhou E.-M. et al. (Канада, 1995) сообщают, что разработан конкурентный метод ELISA (k-ELISA) с использованием рекомбинантного нуклеопротеина, экспрессируемого бакуловирусом, и моноклональных антител, специфичных нуклеопротеину вируса гриппа типа А. Эффективность к-ELISA была оценена при исследовании 3847 проб сывороток крови, полученных от 756 цыплят, 1123 индеек, 707 эму и 1261 страуса. Установлена 100% специфичность разработанного метода k-ELISA, по сравнению с реакцией иммунодиффузии в агаровом геле (РИД). Относительная чувствительность k-ELISA, по сравнению с реакцией торможения гемагглютинации (РТГА), составила 100% с сыворотками цыплят, индеек и эму и 96,2% с пробами от страусов. Более чем 90% проб сывороток, отрицательных в РИД и положительных в k-ELISA, оказались положительными в РТГА, РЗГА, по крайней мере, в отношении одного серотипа вируса гриппа. Специфичность k-ELISA по отношению к РИД колебалась от 85,5% до 99,8% для проб сывороток от всех вышеуказанных видов птиц. Результаты показали, что k-ELISA является более специфичным и чувствительным, чем РИД, и по этим показателям идентичен РТГА. Разработанный метод k-ELISA рекомендуется для скрининга проб сывороток от различных видов птиц, включая бескилевых, на наличие антител к вирусу гриппа типа А (54).
Согласно рекомендации Санитарного кодекса МЭб 2008г. диагностика гриппа основывается на:
1.изоляция ортомиксовируса у больной (павшей) птицы;
2. определение его подтипа методом РЗГА и ПЦР;
3.определение степени патогенности методом внутривенной инокуляции изолята циплятам кур.
В Италии (2006 г) для диагностики гриппа применяли коммерческий твёрдофазный иммунохроматографический тест (Fast test® AIV Ag) для индикации антигена ортомиксовируса в фецесе уток. Реакцию сравнивали с РГА и ПЦР (hemaglutination test and Real time Rt- PCR).
Для ретроспективной диагностики: - применение серологических методов с применением структурных и неструктурных антигенов (протеинов) (РДП, РЗГА, ИФА и др.)
Грипп необходимо дифференцировать от ботулизма, чумы уток, коронавирусной болезни, ВГУ, сальмонеллеза, колибактериоза, парамиксовирусной инфекции и пастереллёза.
Коронавирусная болезнь характеризуется заболеванием уток пекинской и мускусной породы разного возраста. Болезнь чаще наблюдается у молодняка 5-30-суточного возраста с признаками энтерита, гепатита, нефрита, паралича ног и асфиксии. Возбудитель - коронавирус, не агглютинирующий эритроциты кур, уток, кроликов, человека и т.д. Агент изолирован только в России, Украине и Белоруссии. Размер вирусных частиц от 70 до 300 нм, плеоморфный. В больших концентрациях содержится в кишечном тракте. Идентификацию коронавируса проводят методами РДП, РГА с эритроцитами мышей и ИФА.
ВГУ поражает птиц до 6-недельного возраста. У павших утят печень часто охряно-желтого или глинистого цвета с кровоизлияниями. Возбудитель - энтеровирус сферической формы, с диаметром вирусных частиц от 20 до 60 нм. Он не обладает гемагглютинирующей активностью, устойчив к инактивации липорастворителями. К вирусу резистентны цыплята и голуби. Для идентификации вируса используют РН.
Сальмонеллез и колибактериоз дифференцируют от гриппа уток методами выделения и идентификации культур микроорганизмов сальмонелл и эшерихий коли, их серологического типирования и определения патогенности каждого возбудителя с использованием лабораторных животных и утят.
Парамиксовирусная инфекция – чаще латентная болезнь, характеризующаяся вирусоносительством, выработкой специфических антител и отсутствием патологоанатомических изменений у больной утки. Возбудитель - парамиксовирус, который легко идентифицировать и дифференцировать от возбудителя гриппа серологическими методами РДП, РЗГА, ИФА и другими тестами, используя специфические сыворотки к девяти серотипам парамиксовируса или ортомиксовируса, а также структурных и неструктурных протеинов (белков) обоих возбудителей.
Описание других болезней смотрите в соответствующих разделах.
Иммунитет. В сыворотке крови утят-реконвалесцентов в течение 4-5 месяцев содержатся специфические антитела против определенного антигенного варианта подтипа ортомиксовируса. Птицы не восприимчивы к заболеванию при титре вируснейтрализующих антител 1:16 и выше.
Лечение. Из-за отсутствия дешевых и эффективных лекарственных средств лечение больной птицы не проводится. В России были получены удовлетворительные результаты исследований по изучению лечебно-профилактического действия производных адамантадина при гриппе птиц, в частности кур. Выявлена прямая зависимость лечебно-профилактической активности препаратов от величины дозы. Мидантан, ремантадин, 1-аминоадамантанат-1-борадамантана, применяемые с кормом в дозе 20,0-30,0мг/кг, защищали 90-90,3% молодняка, зараженного вирусом гриппа типа А (подтипы Н1 и Н6), от гибели, а в дозе 2,5мг/кг - только 70%. Аналогичный результат получен при аэрозольном методе применения мидантана. На основании проведенных исследований были рекомендованы для лечения птицы следующие препараты: мидантан, ремантадин, 1-аминоадамантанат-1-борадамантана и 2-(1-аминоэтил)-норборан хлоргидрат (Д-84).
Профилактика и меры борьбы. Специфическая профилактика болезни может быть проведена путем иммунизации вакциной, изготовленной на основе конкретного (гомологичного) подтипа ортомиксовируса.
С 12 марта 2006 года в субъектах Российской Федерации в частных подворьях граждан угрожаемых зон начата профилактическая вакцинация птицы против гриппа инактивированной эмульгированной вакциной производства ОАО «Покровский завод биопрепаратов» и ФГУП «Ставропольская биофабрика». В период с 12 марта по 1 июля 2006 года в субъектах Российской Федерации всего вакцинировано против гриппа 57,1 млн. голов птицы.
Через 30-40 дней после вакцинации проводился отбор крови от птиц для выявления методом РЗГА антител к вирусу H5N1. По результатам напряжённости поствакцинального иммунитета в конкретном неселённом пункте принимается решение о ревакцинации птицы.
Ранее в России предлагалась вакцина «Инвак», чаще используемая для иммунизации кур. Препарат полностью защищал кур от гомологичного эпизоотического вируса, частично – от гетерологичных штаммов с идентичным гемагглютинином и слабо – от заражения гетерологичным вирусом, имеющим нейраминидазу, отличную от вакцинной.
В США до 1998 года была запрещена вакцинация против высокопатогенных (ВП) подтипов вируса гриппа. Недавно получено разрешение на применение в чрезвычайных обстоятельствах инактивированных вакцин против ВП подтипов 5 и 7 (Н5 и N7) вируса гриппа. В частности, вакцинация индеек инактивированным вирусом гриппа была разрешена в США с 1979 года, но трудности такой вакцинации заключались в парентеральном введении вакцины каждой птице, поэтому предпочтение отдавалось оральной иммунизации. Первыми кандидатами при разработке оральных вакцин были изоляты от водоплавающих птиц (ВПП), характеризующиеся тропизмом к пищеварительному тракту. У одного из изолятов ВПП – А/дикая утка/Огайо/556/1987(H5N9) была определена полная нуклеотидная последовательность гена гемагглютинина (ГА). Расшифрованная аминокислотная последовательность белка ГА этого изолята почти идентична таковой, полученной разными авторами при анализе гена Н5, из чего следует, что указанный белок ГА может служить основным компонентом при разработке эффективной вакцины. При экспериментальном оральном использовании живых и инактивированных препаратов на основе изолята Moh87 обнаруживали определяемый уровень сывороточных антител. Кроме того, оральная вакцинация защищала цыплят от контрольного заражения летальным штаммом H5N1 и препятствовала распространению этого штамма с фекалиями (49).
Пептидные вакцины индуцируют продукцию антител и активность цитотоксических лимфоцитов против вируса гриппа. Низкая иммуногенность пептидов, вероятно, может быть преодолена использованием в качестве адъюванта «анти-СД40» моноклональных антител, активирующих дендритные клетки, являющиеся мощными антиген-презинтирующими клетками. Существенное преимущество пептидных вакцин – это их способность активировать Т-хелперы и цитотоксические Т-клетки без побочных эффектов.
Beard C.W. et al. (1991) провели опыты по защите кур от высокопатогенного вируса гриппа птиц (H5N2) с помощью рекомбинантных белков вируса оспы птиц. Контрольное заражение эпизоотическим ортомиксовирусом А/СК/РА/1370/83, выделенным в 1983 году (США), показало эффективность рекомбинантной вакцины после инъекции её в перепонку крыла (100%) и методом скарификации гребня (60%, т. е. 40% погибло) на 2-й месяц после вакцинации. В контролях (оспа или без осповируса) произошла 100% гибель.
Титры антител в РЗГА (4ГАЕ) были низкими, в РДП – отрицательными, тогда как после контрольного заражения ортомиксовирусом – высокими и положительными (более 1:32) (38).
С целью ограничения распространения инфекции необходимо постоянно соблюдать нормы комплектования, содержания и кормления птицы. Комплектование новых групп молодняка проводится на основе родительских стад благополучных по гриппу хозяйств. Необходимо строгое соблюдение работы цехов по принципу "пусто-занято". В периоды санитарных разрывов проводят уборку старой подстилки, а также двукратную дезинфекцию стен, пола и оборудования в корпусах. Для этого используют ультрафиолетовые лампы, аэрозоли или растворы химических веществ.
Строгое соблюдение ветеринарно-санитарных норм содержания птицы всех возрастных групп и ограничение патогенного действия других агентов (бактерий, микоплазм, грибов, вирусов и т.д.) на организм утят в целом значительно снижает заболеваемость и летальность при гриппе.
Согласно предложениям, изложенным в Кодексе МЭБ по наземным животным (2004 г.) после регистрации гриппа проводится полный санитарный убой птицы следующих категорий:
- подверженных болезни;
- находящихся в прямом и косвенном в контакте с больными и павшими утками;
- всех вакцинированных и невакцинированных особей на инфицированном предприятии для исключения передачи патогена-возбудителя после снятия карантина или ограничений.
Тушки убитых птиц должны быть подвергнуты сожжению, захоронению или другому способу ликвидации, которые исключают распространение патогена за пределы очага инфекции.
Рынки купли-продажи живой птицы являются важным местом контакта и начала распространения инфекции в конкретном регионе. Вирус может быть перенесен через контаминированных людей, различные виды птиц и животных (особое внимание уделяется свиньям), клетки, оборудование и транспорт. Продажа яиц вместе с картонными коробками из неблагополучного предприятия – важный фактор распространения вируса.
В связи с этим, после установления диагноза на грипп, из хозяйства вывоз яиц, оборудования и прочих изделий полностью исключается. Проводят первичную дезинфекцию, очистку, затем повторную дезинфекцию помещений и оборудования. Все меры направлены на устранение вируса во внешней среде, объявление предприятия благополучным и восстановление его производственной деятельности.
Ранее неблагополучное хозяйство должно находиться под контролем ветеринарной службы не менее двух лет.
В странах с выраженным экспортом не ограничивают использование вакцины в регионах и отдельных предприятиях. В постинфекционный период хозяйства с вакцинированным поголовьем могут раньше возобновить экспорт при соблюдении соответствующего надзора по транзиту и продаже продукции.
Грипп – зоонозная болезнь. Люди могут быть инфицированы через прямой контакт с инфицированной птицей, во время массового убоя и уборки контаминированных помещений.
Известно, что ортомиксовирус с формулой H5N4 (Гонконг, 1997-2004 гг.) может передаваться от птицы людям и наоборот. В связи с этим все ветеринарные мероприятия по устранению агента в хозяйствах, включая вакцинацию, должны проводиться с соблюдением личной безопасности.
Список литературы
- Ан<







