Введение
Чеснок (Allium sativum L.), принадлежащий к семейству Alliaceae, является часто используемым ингредиентом в гастрономии. Чеснок также использовался в качестве традиционного лекарственного средства для различных биологических эффектов, таких как повышение выносливости, помощь пищеварению для предотвращения диареи и заражения глистами, а также для лечения сердечных заболеваний, артрита и усталости [ 1 ]. В последнее время многочисленные исследования показали, что чеснок обладает широким спектром биологически активных эффектов, включая антиоксидантные, антимикробные, противоопухолевые, антигипертензивные, гепатозащитные и инсектицидные свойства [ 2 ]. Хотя биоактивные свойства чеснока связаны с антиоксидантными полифенольными и биоактивными соединениями серы [ 3], когда чеснок измельчается или повреждается, некоторые из этих биоактивных компонентов серы создают сильный едкий запах, который связан с неприятным запахом тела и дыхания у потребителей. Процессы приготовления чеснока являются важными факторами при выборе чесночной добавки из-за различных биологически активных соединений чеснока, присутствующих и приемлемых для потребителей. Несколько чесночных продуктов, таких как обезвоженный чесночный порошок, эфирное масло чеснока, мацерат чесночного масла и выдержанный экстракт чеснока, были представлены на рынке и в настоящее время доступны [ 4 ].
Черный чеснок (BG) недавно был представлен на корейском рынке как продукт для здоровья. BG образуется при старении целого чеснока при высокой температуре и высокой влажности, в результате чего чеснок становится черным из-за веществ, вызывающих потемнение. Кроме того, BG не выделяет сильного неприятного запаха, как свежий чеснок. Это происходит из-за изменений в соединении аллицин, который отвечает за острый запах, в водорастворимые антиоксидантные соединения, такие как S- аллилцистеин, тетрагидро-β-карболины, биологически активные алкалоиды и флавоноидоподобные соединения [ 3, 5 ]. S-аллилцистеин образуется в результате катаболизма γ-глутамилцистеина и ингибирует окислительное повреждение, связанное со старением и различными заболеваниями [ 6]. Производные тетрагидро-β-карболина, которые были идентифицированы в экстрактах BG, также проявляют антиоксидантное действие [ 7, 8 ]. Производные тетрагидро-β-карболина образуются путем конденсации между триптофаном и альдегидом, аналогично образованию пировиноградной кислоты по пути аллин-аллицин или по реакции Майяра [ 5 ]. Кроме того, в нескольких исследованиях сообщалось, что экстракты BG обладают антиоксидантным, антиаллергическим, антидиабетическим, противовоспалительным, гипохолестеринемическим, гиполипидемическим и антиканцерогенным действием [ 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 ]. Однако в этих исследованиях использовались различные условия старения, от 4 до 40 дней. Таким образом, мы предположили, что должны быть оптимальные условия старения, чтобы максимизировать антиоксидантные свойства BG. Таким образом, наша цель этого исследования состояла в том, чтобы идентифицировать физико-химические свойства BG в течение 35 дней старения и определить оптимальный период старения для максимальных антиоксидантных свойств. Для достижения этого мы количественно оценили уровни биологически активного соединения, включая общее содержание полифенолов и флавоноидов и антиоксидантную активность BG, используя 1,1-дифенил-2-пикрилгидразил (DPPH), 2,2-азино-бис- (3-). этилбензотиазолин-6-сульфоновой кислоты) (ABTS), антиоксидантная сила, снижающая содержание железа (FRAP), и анализы понижающей мощности.
Результаты и обсуждение
2.1. Физико-химические свойства черного чеснока
Физико-химические характеристики БГ в период старения представлены в таблице 1. Общее содержание кислоты в BG значительно увеличилось по сравнению с содержанием сырого чеснока, в то время как pH BG значительно снизился с 5,49 до 3,74 по сравнению с 6,33 в сыром чесноке в течение периода старения (p <0,05). Этот результат согласуется с докладом Shin et al. [ 15 ], который показал, что рН BG снизился с 6,40 до 5,29 после 6 дней старения. Содержание восстанавливающего сахара в BG увеличилось примерно в 6 раз, с 2,73 г / кг на 7-й день до 16,07 г / кг на 35-й день, и эти значения были значительно выше, чем у сырого чеснока (1,52 г / кг). Этот результат согласуется с данными Choi et al. [ 16 ], которые показывают, что содержание сахара (например, глюкозы, фруктозы, сахарозы и мальтозы) увеличилось в BG по сравнению со свежим и приготовленным на пару чесноком. Кроме того, это повышенное содержание сахара в BG может быть связано с его сладким вкусом.
Цвет является одним из наиболее важных психологических свойств пищевых продуктов, которые влияют на восприятие еды у потребителей. Цвет BG изменился на темно-коричневый в течение периода старения (Рисунок 1, Таблица 1). Цветное покраснение (значение *) BG резко возрастало в течение периода старения, в то время как яркость (значение L *) и желтизна (значение b *) снижались по сравнению с сырым чесноком. Далее, мы сфокусировались на влиянии развития цвета BG с помощью УФ-видимой спектроскопии. фигура 2показывает разницу в спектральных закономерностях между сырым чесноком и BG в течение 35 дней старения. Сырой чеснок показал максимальную абсорбцию при 230 нм, в то время как BG на 7-й день показал максимальную абсорбцию при 230 нм, около 280–310 нм, а также незначительно при 360 нм. Однако на 14-й и 35-й день BG показал дополнительные плечи около 400–425 нм, в то время как на 21-й и 28-й день BG показал максимальную поглощающую способность в видимом диапазоне 425–450 нм. Изменения цвета в результате термической обработки обычно происходят из-за реакции Майяра, известной как неферментативная реакция потемнения. Согласно свойствам участвующих реагентов, продукты реакции Майяра обычно связаны с увеличением поглощения при 280 нм, 320–360 нм и 420–450 нм, что соответствует начальному, промежуточному,17 ]. На начальной стадии реакции Майяра образуются бесцветные (около 280 нм) промежуточные продукты, возникающие в результате конденсации амина и перегруппировки амадори. На промежуточной стадии (320–360 нм) образуются бесцветные или желтые продукты в результате нескольких реакций, таких как дегидратация сахара, фрагментация сахара и расщепление аминокислот (разложение Штрекера). Конечная стадия (420–450 нм) сильно окрашена альдольной конденсацией, альдегид-аминной конденсацией и образованием гетероциклических нитросоединений. Бийо и соавт. [ 18 ] показали, что MRP, полученные из глюкозы и цистеина, имели одно плечо поглощения при 285 нм с максимальной абсорбцией при 340–360 нм. Образование MRP зависит от условий обработки, таких как температура и время [ 19]. Следовательно, изменения цвета черного чеснока, такие как усиление покраснения и уменьшение яркости и желтизны, могут быть связаны с образованием MRP во время периода старения при 70 ° C.

Рисунок 1. Изменения цвета черного чеснока в период старения.
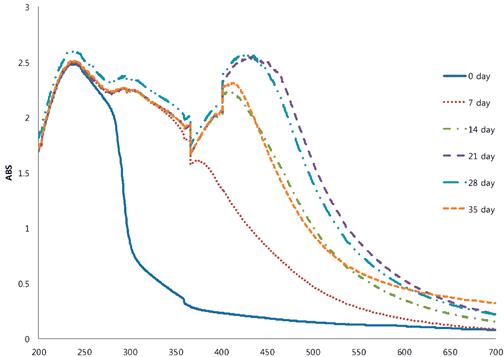
Таблица 1. Физико-химические характеристики черного чеснока в период старения.
Компоненты
Период старения (дни)
| | 0
| 7
| 14
| 21
| 28
| 35
|
| Влага (%)
| 64,21 ± 1,48 а
| 32,72 ± 0,97 б
| 31,77 ± 2,60 б
| 31,12 ± 0,17 б, с
| 29,55 ± 0,39 с
| 29,88 ± 0,49 с
|
| Общая кислотность (мг / кг)
| 0,40 ± 0,01 е
| 1,30 ± 0,01 д, е
| 1,50 ± 0,02 с, д
| 1,70 ± 0,03 с
| 2,30 ± 0,06 б
| 2,60 ± 0,03
|
| pH
| 6,33 ± 0,07 е
| 5,49 ± 0,09 д, е
| 4,41 ± 0,17 с, д
| 4,22 ± 0,08 с
| 4,07 ± 0,02 б
| 3,74 ± 0,062
|
| Восстанавливающий сахар (г / кг)
| 1,52 ± 0,01 д
| 2,73 ± 0,32 с
| 12,42 ± 0,85 б
| 15,96 ± 0,29 а
| 15,98 ± 0,23
| 16,07 ± 0,38
|
| цвет
| | | | | | |
| L *
| 68,44 ± 1,66
| 15,67 ± 2,41 б
| 9,28 ± 1,74 с
| 5,61 ± 0,68 д
| 5,19 ± 1,11 д
| 4,33 ± 2,02 д
|
| а *
| −3,84 ± 0,46 с
| 6,13 ± 0,95
| 5,45 ± 0,94
| 5,23 ± 1,06
| 3,18 ± 1,46 б
| 2,73 ± 1,01 б
|
| б *
| 26,59 ± 1,76 а
| 10,65 ± 4,16 б
| 2,37 ± 7,47 с
| −3,07 ± 4,60 д
| −3,76 ± 3,59 д
| −3,86 ± 1,49 д
|
Значения средние ± SD; Значения, за которыми следуют разные буквы в одной и той же строке, значительно различаются по критерию множественного диапазона Дункана (р <0,05).
2.2. Аминокислотные изменения черного чеснока
Изменения свободных аминокислот BG в течение периода старения показаны в Таблице 2. Содержание разветвленных аминокислот (лейцин и изолейцин) было выше в BG, чем в сыром чесноке. Цистеин является важным предшественником серосодержащих соединений в чесноке, таких как S- метил- 1- цистеинсульфоксид (метин) и S- аллил- 1- цистеинсульфоксид (аллин), которые являются наиболее распространенными и исходным цистеинсодержащим соединение, ответственное за душистые соединения [ 20]. После стадий обработки, таких как резка, дробление или дегидратация, эти соединения разлагаются на другие летучие соединения, включая диаллилсульфид, диаллилдисульфид, диаллилтрисульфид, дитирн и аоцен [ 3 ]. Здесь мы обнаружили, что содержание серосодержащего цистеина в BG значительно снижалось при старении и что содержание цистеина в BG было ниже, чем в сыром чесноке. Эти результаты могут быть связаны со сниженным содержанием серы в крови. Интересно, что среди ароматических аминокислот содержание фенилаланина (от 82,38 до 143,07 мг / 100 г) в BG возрастало при старении, а содержание было выше, чем в сыром чесноке (55,64 мг / 100 г), тогда как содержание тирозина (от 77,31 до 109,13) мг / 100 г) BG резко снижалось при старении по сравнению с таковым сырого чеснока (449,95 мг / 100 г). Hwang и другие. [ 21] сообщили, что MRPs в модельных системах сахар-цистеин и сахар-тирозин были более высокими по антиоксидантной активности, чем у других MRP. Снижение содержания цистеина и тирозина в БГ в период старения может быть связано с изменениями антиоксидантной активности БГ. Содержание кислых аминокислот в тирозине и аспарагиновой кислоте, а также содержание основных аминокислот в глутаминовой кислоте, аргинине и лизине снижалось с продолжением периода старения. Аналогично, содержание полярных аминокислот, таких как треонин и серин, и неполярных аминокислот, таких как глицин и аланин, уменьшилось по сравнению с сырым чесноком. Следовательно, уменьшение этих аминокислот, особенно цистеина и тирозина, в течение периода старения может быть связано с реакциями Майяра, которые происходят между аминами, которые обычно являются аминокислотами, и карбонильными соединениями, которые обычно восстанавливают сахара.
Таблица 2. Содержание аминокислот в черном чесноке в период старения.
| Аминокислота (мг / 100 г)
|
Периоды старения (дни)
|
| 0
| 7
| 14
| 21
| 28
| 35
|
| Leusine
| 58,62 ± 3,37 б
| 73,44 ± 1,79
| 62,81 ± 1,51 б
| 62,12 ± 5,64 б
| 61,23 ± 4,32 б
| 59,19 ± 3,94 б
|
| изолейцин
| 50,04 ± 13,47 б
| 89,25 ± 18,93
| 86,45 ± 8,23
| 83,79 ± 2,37 а
| 79,44 ± 1,14 а
| 71,07 ± 2,25
|
| Valline
| 47,74 ± 0,19
| 47,68 ± 0,64
| 36,71 ± 4,64 б
| 35,23 ± 5,61 б
| 34,73 ± 8,61 б
| 33,91 ± 6,61 б
|
| метионин
| 31,56 ± 1,40 б
| 82,51 ± 4,70
| 80,73 ± 6,37
| 78,11 ± 2,33 а
| 73,59 ± 9,71 а
| 71,11 ± 3,55
|
| Цистеин
| 81,06 ± 0,95
| 69,43 ± 0,94 б
| 49,20 ± 5,42 с
| 46,90 ± 8,98 с
| 43,44 ± 3,38 с
| 42,14 ± 7,18 с
|
| Фенилаланин
| 55,64 ± 0,74 с
| 82,38 ± 8,35 б
| 70,20 ± 4,41 б
| 135,16 ± 7,10
| 136,25 ± 12,76
| 143,07 ± 6,32
|
| Тирозин
| 449,95 ± 6,29
| 109,13 ± 26,09 б
| 102,33 ± 0,38 б
| 82,28 ± 7,41 б
| 78,35 ± 4,34 б
| 77,31 ± 7,54 б
|
| Аспарагиновая кислота
| 90,12 ± 2,55 б
| 117,50 ± 9,07
| 64,53 ± 5,84 с
| 62,43 ± 4,34 с
| 61,65 ± 9,12 с
| 60,19 ± 8,16 с
|
| Глютаминовая кислота
| 286,60 ± 8,09
| 128,87 ± 9,09 б
| 112,81 ± 3,02 б
| 108,11 ± 9,12 б
| 101,88 ± 7,71 б
| 100,11 ± 6,09 б
|
| Аргинин
| 409,05 ± 3,00
| 340,20 ± 75,68 б
| 119,30 ± 0,52 д
| 208,71 ± 51,36 с
| 71,92 ± 0,65 д, е
| 40,34 ± 1,10 е
|
| Лизин
| 61,68 ± 5,29
| 57,96 ± 4,93
| 47,39 ± 2,24 б
| 42,50 ± 2,27 б
| 41,53 ± 3,67 б
| 40,50 ± 9,22 б
|
| Гистидин
| 89,12 ± 1,88 б
| 191,69 ± 18,89 а
| 58,76 ± 13,02 с
| 58,75 ± 3,59 с
| 57,62 ± 5,51 с
| 57,89 ± 8,34 с
|
| Треонин
| 81,25 ± 13,59 а
| 46,30 ± 0,87 б
| 53,53 ± 8,36 б
| 57,54 ± 2,22 б
| 58,36 ± 11,17 б
| 59,36 ± 5,22 б
|
| серин
| 38,53 ± 0,82
| 25,72 ± 0,87 б
| 25,84 ± 0,33 б
| 24,78 ± 1,12 б
| 24,23 ± 4,22 б
| 23,71 ± 5,41 б
|
| Глицин
| 21,50 ± 2,51 б
| 37,41 ± 8,54
| 9,60 ± 1,78 с
| 8,63 ± 1,18 с
| Северная Дакота
| Северная Дакота
|
| аланин
| 89,72 ± 11,44 б
| 239,13 ± 17,84
| 67,01 ± 2,39 с
| 83,59 ± 5,71 б
| 47,38 ± 1,74 д
| 32,74 ± 5,37 д
|
Значения средние ± SD; Значения, за которыми следуют разные буквы в одной и той же строке, значительно различаются по критерию множественного диапазона Дункана (р <0,05). НД, не может быть обнаружен.
2,3. Содержание антиоксидантов в черном чесноке
Чтобы прояснить антиоксидантные свойства BG во время старения, мы сосредоточились на анализе общего содержания полифенолов и общего флавоноидов (таблица 3). Общее содержание полифенолов (25,81–58,33 мг GAE / г) в BG было не только значительно выше, чем в сыром чесноке (13,91 мг GAE / г), но также значительно увеличивалось до 21-го дня старения, а затем снижалось в течение остальной части период старения (р <0,05). Согласно Ким и соавт. [ 22 ], производные гидроксициннаминовой кислоты и другие фенольные кислоты повышены в 5 раз в черном чесноке по сравнению с сырым чесноком. Это увеличение фенольных кислот также может быть связано с увеличением общего содержания кислоты в BG. Согласно Сюй и соавт. [ 23], термическая обработка фенольных соединений увеличивала свободную фракцию фенольных кислот, тогда как она уменьшала эфирные, гликозидные и связанные с эфиром фракции, что приводило к увеличению свободных фенольных форм. Gorinstein et al. [ 24 ] показали, что условия обработки чеснока приводят к изменениям в содержании его биологически активных соединений, таких как полифенолы, флавоноиды и антоцианы, и что это связано с типом и продолжительностью обработки. Флавоноиды не только принадлежат к группе изменяющихся фенольных структур, но также содержатся во фруктах, овощах, зернах, корнях, цветах, чае и винах [ 25].]. Термическая обработка оказывает большое влияние на доступность флавоноидов, в зависимости от величины и продолжительности лечения, их чувствительности к теплу и физико-химической пищевой среды [ 26 ]. Во время термообработки общее содержание флавоноидов в пищевых продуктах увеличивается и уменьшается в зависимости от условий переработки [ 26 ]. Общее содержание флавоноидов в BG (от 5,38 мг RE / г до 16,26 мг RE / г) было не только значительно выше, чем в сыром чесноке (3,22 мг RE / г), но также значительно увеличилось до 21-го дня старения после который продолжал слегка увеличиваться в течение оставшегося периода старения (р <0,05). Исходя из результатов общего количества полифенолов и общего количества флавоноидов, оптимальный период старения BG для максимального увеличения содержания антиоксидантов может быть 21-м днем старения.
Таблица 3. Содержание антиоксидантов в черном чесноке в период старения.
|
| |
|
|
Период старения (дни)
| |
| 0
| 7
| 14
| 21
| 28
| 35
| |
| Общий полифенол (мг GAE / г)
| 13,91 ± 1,62ф
| 25,81 ± 1,59е
| 35,28 ± 0,32д
| 58,33 ± 1,90
| 55,25 ± 0,70б
| 48,35 ± 1,14с
| |
| Общий флавоноид (мг RE / г)
| 3,22 ± 0,07 д
| 5,38 ± 0,06 с
| 8,34 ± 0,61 б
| 15,37 ± 0,52
| 16,26 ± 1,69а
| 15,70 ± 2,11
| |
GAE = эквиваленты галловой кислоты; RE = рутинные эквиваленты; Значения средние ± SD; Значения, за которыми следуют разные буквы в одной и той же строке, значительно различаются по критерию множественного диапазона Дункана (р <0,05).
2,4. Антиоксидантная активность черного чеснока
Для точной оценки антиоксидантной активности BG были проведены четыре различных измерения антиоксидантной активности. Активность по удалению радикалов DPPH и анализы ABTS характеризуются способностью соответствующих субстратов подвергаться переносу одного электрона двумя компонентами в реакционной смеси антиоксидантов с окислителем, таких как радикалы DPPH и ABTS, соответственно. Анализы также просты в эксплуатации и просты в использовании [ 27 ]. Активность BG по удалению свободных радикалов DPPH (37,32–74,48%) была значительно выше, чем у сырого чеснока (4,65%) (рис. 3).А). Активность BG по удалению свободных радикалов DPPH возрастала примерно в 2 раза, с 37,32% на 7-й день до 74,48% на 21-й день, а затем слегка снижалась до 63,09% до 35-го дня старения. Значения были значительно выше, чем у сырого чеснока (4,65%) (р <0,05). Эта картина активности свободных радикалов DPPH в BG была сходна с общей концентрацией полифенолов (таблица 3). Активность BG по поглощению свободных радикалов ABTS • + была значительно выше в 21-й день (249,20 мМ TE) по сравнению с сырым чесноком (92,43 мМ TE). Значения неуклонно снижались с 21-го по 35-й день (245,45 мМ TE) (Рисунок 3Б). Эти результаты были аналогичны эффектам поглощения свободных радикалов DPPH. Как правило, анализ FRAP и снижение мощности основаны на способности реакции переноса электрона с солью трехвалентного железа в качестве окислителя. Для анализа FRAP требуются кислотные условия (pH 3,8), тогда как анализ восстановительной способности происходит при нейтральном pH [ 27 ]. Как показано на рисунке 3 C, значения BG FRAP были значительно выше, чем у сырого чеснока. Как и в других анализах, значение BG в FRAP увеличивалось до 21-го дня старения, а затем впоследствии уменьшалось. В течение периода старения содержание антиоксидантов (например, общего полифенола, общих флавоноидов) BG постепенно увеличивалось до 21-го дня (таблица 3).), что, вероятно, связано с антиоксидантными результатами, наблюдаемыми в анализе FRAP. Кроме того, восстановительная способность BG также резко увеличилась до 21-го дня (322,70 мМ TE) по сравнению с сырым чесноком (30,55 мМ TE) (рис. 3D). Эти результаты были аналогичны результатам, полученным в анализах DPPH, ABTS и FRAP, и увеличение антиоксидантной активности BG может быть связано с увеличением общего количества полифенолов, общих флавоноидов и содержания аскорбиновой кислоты в течение периода старения. Основываясь на приведенных выше результатах антиоксидантных соединений и результатов антиоксидантной активности, мы предлагаем, что оптимальный период старения для максимизации антиоксидантных свойств BG составляет 21 день.
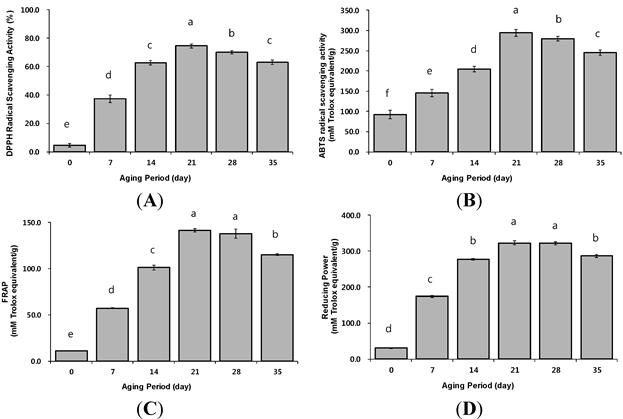
Рисунок 3. Антиоксидантная активность черного чеснока в период старения. (A) очиститель радикалов DPPH; (B) ABTS радикальная очистка; (C) восстановление Fe (III) (pH 3,6); (D) восстановление Fe (III) (pH 6,6). Различные буквы над столбиками для одинаковых периодов старения указывают на значительную разницу при p <0,05 (критерий Дункана).
Экспериментальная часть
3.1. Материалы и реагенты
Свежий чеснок (Allium sativum L.) был приобретен на местном рынке в Сельскохозяйственной ассоциации Уйсон, Кёнсан-Пукто, Южная Корея, в 2011 году. Реагент Фолина-Чокальтеу, чесночная кислота, рутин, 1,1-дифенил-2-пикрилгидразил (DPPH), 2,2'-азино-бис- (3-этилбензотиазолин-6-сульфоновая кислота) (ABTS), персульфат калия, трихлоруксусная кислота (TCA) и феррицинид калия были приобретены у Sigma-Aldrich Chemical Co. (Сент-Луис)., МО, США). Все химические вещества и реагенты, использованные в этом исследовании, были аналитического качества.
3.2. Приготовление и экстракция экстракта черного чеснока
Образцы БГ готовили по методике, описанной в [ 8]. Десять неочищенных сырых головок чеснока инкубировали в термогигростатической камере (THPE 025, Jeio Tech, Сеул, Корея) при 70 ° C и относительной влажности 90% в течение 7, 14, 21, 28 и 35 дней. В процессе старения сырой чеснок приобретал черный цвет. Свежий сырой чеснок и выдержанные гвоздики BG очищали от колбы и измельчали с помощью высокоскоростного миксера (Blaender 7012S, Waring, Torrington, CT, USA). Измельченный BG смешивали с деионизированной водой в соотношении твердое вещество: жидкость 1: 3. Образцы трижды экстрагировали деионизированной водой в течение 1 ч при комнатной температуре в шейкере (CR300, FinePCR, Сеул, Корея). Экстракты центрифугировали (4000 об / мин, 10 минут) и супернатанты собирали. Собранные супернатанты хранили при -70 ° С в течение 2 дней и затем сушили в лиофилизаторе (система сублимационной сушки / заморозки Labconco, Labconco Corp., Канзас-Сити, Миссури, США).
3.3. Определение физико-химических свойств
Содержание влаги в БГ определяли в соответствии с методиками, описанными официальным методом AOAC [ 28 ]. PH BG измеряли с помощью калиброванного pH-метра (Corning 530, Corning Inc., Corning, NY, USA). Общее содержание кислоты в БГ анализировали путем титрования образца 0,1 н. NaOH до рН 8,3 и выражали в процентах от винной кислоты [ 28 ]. Снижение содержания сахара анализировали методом DNS [ 29 ].
3.4. Измерения цвета
Цветовые значения BG выполняли с использованием спектроколориметра (JS-555 Color Techno System Co. Ltd., Токио, Япония), анализатора цвета tristimulus, откалиброванного с эталонной пластиной из белого фарфора. Цветовые координаты однородного цветового пространства CIE-LAB L *, a *, b * определялись по его отражательной способности и цветности. Значение L * указывает яркость в диапазоне от черного (L * = 0) до белого (L * = 100). Значение a * указывает на красноту в диапазоне от -60 (зеленый) до 60 (красный), а значение b * в диапазоне от -60 (синий) до 60 (желтый). Кроме того, чтобы подтвердить развитие BG потемнения, УФ-видимые спектры BG измеряли по поглощению в диапазоне 200–700 нм с использованием спектрофотометра (модель 1800, Shimadzu, Киото, Япония).
3.5. Определение аминокислот
Аминокислоты BG определяли с использованием жидкостного хроматографа HP 1100 (Hewlett Packard Wilmington, DE, USA) с детектором с переменной длиной волны (VWD HP 1100), работающим при 338 нм (возбуждение = 340 нм). Разделение проводили с помощью колонки быстрого разрешения Zorbax Eclipse AAA (внутренний диаметр 150 × 4,6 мм, размер частиц 5 мкм, Agilent Technologies, Пало-Альто, Калифорния, США). Профиль линейного градиента подвижной фазы, содержащий 40 мМ Na 2 HPO 4, pH 7,8 (растворитель A) и CAN / MeOH / вода 45:45:10 (об. / об. / об.) (растворитель B), 0% B (0–1,9 мин), 0% –57% (1,9–18,1 мин.), 57% –100% (18,1–18,8 мин), 100% (18,8–22,3 мин), 100% –0% (22,3–23,2 мин) и 0% (23,2–26 мин) применялись при скорости потока 2,0 мл / мин Колонку уравновешивали в течение 5 мин в начальных условиях до введения следующих образцов. Температура колонки составляла 40 ° С. Для определения содержания аминокислот в BG использовали предколоночную дериватизацию с о -фталевым альдегидом (OPA) и порциями по 0,5 мкл вводили в систему ВЭЖХ. Анализ данных проводился с использованием программного обеспечения Chemstation (Hewlett Packard).
3,6. Определение содержания антиоксиданта
Общее содержание полифенолов в BG определяли по методике, описанной Arnous et al. [ 30 ]. Вкратце, аликвоту разбавленной BG (2,4 мл) смешивали с реагентом Фолина-Чокальтеу (0,15 мл) с последующим добавлением 1 М раствора NaCO 3 (0,45 мл). Затем реакции давали протекать в течение 1 мин. Поглощение при 750 нм измеряли через 30 мин при комнатной температуре в темноте. Общее содержание полифенолов выражали в миллиграммах эквивалентов галловой кислоты (GAE).
Общее содержание флавоноидов анализировали в соответствии со способом, описанным Shen et al. [ 31 ]. Деионизированную воду (2 мл) и 0,5 М раствор NaNO 2 (0,15 мл) смешивали с BG (0,5 мл) и оставляли реагировать при комнатной температуре в течение 5 минут. Затем добавляли 0,4 М раствор AlCl 3· 6H 2 O (0,15 мл) и образцы инкубировали в течение 5 минут перед добавлением 1 М раствора NaOH (1 мл). Поглощение измеряли при 415 нм после 15 мин инкубации. Общее содержание флавоноидов выражали в эквивалентах рутина (RE).
3,7. Определение антиоксидантной активности
Активность поглощения свободных радикалов BG, основанная на активности поглощения стабильного свободного радикала DPPH (2,2-дифенил-1-пикрилгидразил), определяли с использованием метода, описанного Brand-Willian et al. [ 32 ] с небольшими изменениями. Образец BG (0,2 мл) добавляли к 0,2 мМ DPPH, растворенному в растворе этанола (0,5 мл). После инкубации раствора при комнатной температуре в темноте в течение 30 минут измеряли поглощение при 517 нм, и активность по поглощению радикалов выражали в процентах ингибирования:
Ингибирование DPPH (%) = ([AC - AS] / AC) × 100
(1)
где AC - абсорбция контроля (холостой), а AS - абсорбция экстракта.
Активность поглощения свободных радикалов BG, основанная на поглощающей активности стабильного свободного радикала ABTS • + [2,2-азинобис- (3-этилбензотиазолин-6-сульфат]], также определяли с использованием метода, описанного Re et. al. [ 33] с небольшими изменениями. Смесь окислителя (2,45 мМ персульфата калия) и 7 мМ раствора ABTS, растворенного в 20 мМ натрий-ацетатном буфере (рН 4,5), инкубировали при комнатной температуре в темноте в течение 12-16 ч для создания стабильного темно-сине-зеленого цвета. радикальное решение. Затем раствор разбавляли раствором PBS (фосфатный буферный раствор) до оптической плотности 0,70 ± 0,02 при 734 нм, чтобы создать тестовый реагент в качестве рабочего раствора. Затем к 3 мл рабочего раствора добавляли 0,03 мл разбавленной BG. После инкубации раствора при комнатной температуре в темноте в течение 30 минут измеряли поглощение при 734 нм, и активность по поглощению радикалов выражали в ммоль / л эквиваленте Trolox на грамм BG.
Антиоксидантная способность BG была определена с использованием анализа антиоксидантной силы железа (FRAP), описанного Benzie и Strain [ 34 ] с некоторыми модификациями. Маточные растворы включали 300 ммоль / л ацетатного буфера (рН 3,6), 10 мМ TPTZ (2,4,6-tripyridyl- с раствором триазин), растворенного в 40 мМ HCl, и 20 мМ FeCl 3 · 6H 2 Раствор O. Рабочий раствор готовили путем смешивания ацетатного буфера (25 мл), раствора TPTZ (2,5 мл) и 20 мМ FeCl 3 · 6H 2.О раствор (2,5 мл). Черный раствор чеснока (0,05 мл) добавляли к раствору FRAP (0,75 мл) и инкубировали при комнатной температуре в темноте в течение 30 минут. Затем измеряли изменения цвета при 593 нм, и стандартная кривая была линейной от 0 до 200 мкМ Trolox. Результат выражали в ммоль / л эквивалента Trolox на грамм BG.
Восстанавливающая способность BG измерялась по методике, описанной Ояидзу [ 35 ], с небольшими изменениями. Вкратце, BG (0,1 мл) смешивали с 200 мМ натрий-фосфатным буфером (рН 6,6, 0,25 мл) и 1% ферроцианидом калия (0,25 мл). Смесь инкубировали на водяной бане (50 ° С) в течение 20 минут и затем добавляли к 0,62 М раствору трихлоруксусной кислоты (ТСА, 0,2 мл) для прекращения реакции. Затем смесь смешивали с деионизированной водой (0,2 мл) и 6,17 мМ раствором хлорида железа (0,5 мл). Поглощение полученного раствора измеряли при 700 нм с использованием деионизированной воды в качестве холостого раствора. Восстановительный потенциал образца определяли по стандартной кривой Trolox (0–200 мкМ). Результаты выражали в ммоль / л эквивалента Trolox на грамм BG.
3,8. Статистический анализ
Все эксперименты были выполнены в трех экземплярах, и данные были выражены как среднее ± стандартное отклонение (SD) с использованием версии SPSS 17.0 (SPSS Institute, Чикаго, Иллинойс, США). Односторонний дисперсионный анализ (ANOVA) и тест множественного сравнения Дункана были использованы для определения значимости различий между образцами с уровнем значимости 0,05.
Выводы
Чёрный чеснок (BG), получаемый при старении целых луковиц чеснока (Allium sativum) L.) при 70 ° C и относительной влажности 90% в течение 35 дней показали более высокие антиоксидантные свойства по сравнению с сырым чесноком. Содержание влаги, снижение сахара и общая кислотность BG значительно увеличивались до 21-го дня старения. При этом значения легкости и желтизны БГ резко снижались до 21-го дня старения. Максимальная абсорбция BG на 21-м и 28-м днях находилась в видимых диапазонах около 450 нм, связанных с заключительной стадией реакции Браунинга Майяра. Содержание общего полифенола и общего флавоноидов в БГ значительно увеличивалось до 21-го дня старения и после этого изменялось лишь незначительно. Антиоксидантная активность BG в течение периода старения соответствовала антиоксидантным компонентам, измеренным с использованием DPPH, ABTS, FRAP и снижающей способности. Следовательно,
Подтверждения
Это исследование было поддержано исследовательскими грантами Университета Кёнг Хи (20100630) в 2010 году.
Вклад автора
Все авторы внесли свой вклад в исследование через дизайн исследования, провели эксперименты, проанализировали данные или написали статью. ISC и YSL разработали исследование; HSC и ISC выполнили экспериментальную работу; HSC и ISC написали рукопись. Все авторы обсудили, отредактировали и утвердили окончательный вариант.
Конфликт интересов
Авторы объявили, что нет никаких конфликтов интересов.
Рекомендации
1. Банерджи, СК; Маулик С.К. Влияние чеснока на сердечно-сосудистые нарушения: обзор. Nutr. J. 2002, 1, 1–14. [ Google Scholar ] [ CrossRef ]
2. Рахман, К.; Лоу, Г. М. Чеснок и сердечно-сосудистые заболевания: критический обзор. J. Nutr. 2006, 136, 736S – 740S. [ Google Scholar ]
3. Корсо-Мартинес, М.; Corzo, N.; Вильямиель М. Биологические свойства лука и чеснока. Trends Food Sci. Technol. 2007, 18, 609–625. [ Google Scholar ] [ CrossRef ]
4. Amagase, H.; Petsch, BL; Мацуура Х.; Касуга, К.; Итакура Ю. Потребление чеснока и его биологически активных компонентов. J. Nutr. 2001, 131, 955S – 962S. [ Google Scholar ]
5. Итикава, М.; Рю, К.; Йошида, Дж.; Ide, N.; Yoshida, S.; Сасаока, Т.; Суми С.И. Антиоксидантное действие производных тетрагидро-β-карболина, выявленных в выдержанном экстракте чеснока. BioFactors 2002, 16, 57–72. [ Google Scholar ] [ CrossRef ]
6. Колин-Гонсалес, Алабама; Сантана, РА; Сильва-Ислас, Калифорния; Chanez-Cardenas, ME; Сантамария, А.; Maldonad, PD. Антиоксидантные механизмы, лежащие в основе защиты от чеснока и S- аллилцистеина. Окислительный Мед. Cell. Longev. 2012, 2012, 1–16. [ Google Scholar ] [ CrossRef ]
7. Итикава, М.; Йошида, Дж.; Ide, N.; Сасаока, Т.; Yamaguchi, H.; Оно, К. Производные тетрагидро-β-карболина в выдержанном чесночном экстракте проявляют антиоксидантные свойства. J. Nutr. 2006, 136, 726S – 731S. [ Google Scholar ]
8. Сато, Э.; Коно, М.; Нивано Ю. Повышенный уровень производных тетрагидро-β-карбокина в кратковременном ферментированном чесноке. Plant Food Hum. Nutr. 2006, 61, 175–178. [ Google Scholar ] [ CrossRef ]
9. Ким, JH; Nam, SH; Рико, CW; Кан, М.Ю. Сравнительное исследование антиоксидантной и противоаллергической активности экстрактов свежего и выдержанного черного чеснока. Int. J. Food Sci. Technol. 2012, 47, 1176–1182. [ Google Scholar ] [ CrossRef ]
10. Ли, Ю.М. Гвеон, штат Огайо; Сео, YJ; Я, Дж.; Кан, МДж; Ким, MJ; Ким Дж. И. Антиоксидантный эффект чеснока и выдержанного черного чеснока на животной модели сахарного диабета 2 типа. Nutr. Местожительство Практ. 2009, 3, 156–161. [ Google Scholar ] [ CrossRef ]
11. Ким, МЗ; Ким, MJ; Ли, JH; Хан, ЖЖ; Ким, JH; Сок, DE; Ким М.Р. Гепатопротективное действие выдержанного черного чеснока на хроническое алкогольное повреждение печени у крыс. J. Med. Продукты питания. 2011, 14, 732–738. [ Google Scholar ] [ CrossRef ]
12. Ли, EN; Чо, YW; Ким, HK; Парк, JK; Ким, HJ; Ким, MJ; Ли, HW; Ким, КХ; Бае, СС; Ким Б.С. и другие. Хлороформный экстракт выдержанного черного чеснока ослабляет индуцированную TNF-α выработку АФК, экспрессию VCAM-1, активацию NF-κB и адгезивность к моноцитам в эндотелиальных клетках пупочной вены человека. Phytother. Местожительство 2011, 25, 92–100. [ Google Scholar ] [ CrossRef ]
13. Ким, HK; Чой, YW; Ли, EN; Парк, JK; Ким С.Г.; Парк, диджей; Ким Б.С. Лим, YT; Yoon, S. 5-Гидроксиметилфурфурол из экстракта черного чеснока, предотвращает TNFα-стимулированную адгезию моноцитарных клеток к HUVEC путем подавления экспрессии молекулы адгезии сосудистых клеток-1, образования активных форм кислорода и активации NF-κB. Phytother. Местожительство 2011, 25, 965–974. [ Google Scholar ] [ CrossRef ]
14. Ким, я.; Ким, JY; Хван, YJ; Hwang, KA; Ом, AS; Ким, JH; Чо, К.Дж. Благотворное влияние выдержанного экстракта черного чеснока на ожирение и гиперлипидемию у крыс, получавших рацион с высоким содержанием жиров. J. Med. Растения Res. 2011, 5, 3159–3168. [ Google Scholar ]
15. Шин, JH; Чой, DJ; Чунг, МДж; Кан, МДж; Сунг Н.Я. Изменения физико-химических компонентов и антиоксиданта выдержанного чеснока при разных температурах. J. Korean Soc. Food Sci. Nutr. 2008, 37, 1174–1181. [ Google Scholar ] [ CrossRef ]
16. Чой, DJ; Ли, SJ; Кан, МДж; Чо, ХС; Сунг, Нью-Джерси; Шин Дж. Х. Физико-химические характеристики черного чеснока (Allium sativum L.). J. Korean Soc. Food Sci. Nutr. 2008, 37, 465–471. [ Google Scholar ] [ CrossRef ]
17. Нюрстен, Х. Реакция Майяра: химия, биохимия и ее значение; Королевское химическое общество: Кембридж, Великобритания, 2005; с. 2–4. [ Google Scholar ]
18. Billaud, C.; Маращин, С.; Николас Дж. Ингибирование полифенолоксидазы из яблок продуктами реакции Майяра, приготовленными из глюкозы или фруктозы с 1- цистеином, при различных условиях рН и температуры. LWT-Food Sci. Technol. 2004, 37, 69–78. [ Google Scholar ] [ CrossRef ]
19. Харди, Дж.; Парментье, М.; Фанни Дж. Функциональность питательных веществ и термическая обработка пищи. Proc. Nutr. Soc. 1999, 58, 579–585. [ Google Scholar ] [ CrossRef ]
20. Amagase, H. Разъяснение биологически активных компонентов чеснока. J. Nutr. 2006, 136, 716S – 725S. [ Google Scholar ]
21. Хван, И.Г.; Ким, HY; Ву, KS; Ли, Дж.; Jeong, HS Биологические активности продуктов реакции Майяра (MRPs) в модельной системе сахар-аминокислота. Food Chem. 2011, 126, 221–227. [ Google Scholar ] [ CrossRef ]
22. Ким, JS; Кан, КДж; Gweon, OC Сравнение фенольных кислот и флавоноидов в черном чесноке на разных стадиях термической обработки. J. Funct. Foods 2013, 5, 80–86. [ Google Scholar ] [ CrossRef ]
23. Сюй, Г.; Ye, X.; Chen, J.; Лю Д. Влияние термической обработки на фенольные соединения и антиоксидантную способность экстракта кожуры цитрусовых. J. Agric. Food Chem. 2007, 55, 330–335. [ Google Scholar ] [ CrossRef ]
24. Gorinstein, S.; Леонтович, Х.; Леонтович, М.; Намисник, J.; Наджман, К.; Drzewiecki, J.; Цвикрова, М.; Martincova, O.; Katrich, E.; Трахтенберг С. Сравнение основных биоактивных компонентов и антиоксидантной активности чеснока, белого и красного лука после протоколов обработки. J. Agric. Food Chem. 2008, 56, 4418–4426. [ Google Scholar ] [ CrossRef ]
25. Nijveldt, RJ; Ван Нуд, Э.; ван Хоорн, DE; Boelens, PG; Ван Норрен, К.; Ван Леувен, П. А. Флавоноиды: обзор вероятных механизмов действия и потенциальных приложений. Am. J. Clin. Nutr. 2001, 74, 418–425. [ Google Scholar ]
26. Яноу, я.; Хафса, я.; Hamdi, S.; Charbonnel, C.; Ghoul, M. Обзор влияния обработки и приготовления пищи на поведение флавонола и антоцианов. J. Food Eng. 2012, 111, 208–217. [ Google Scholar ] [ CrossRef ]
27. MacDonald-Wicks, LK; Вуд, LG; Гарг М.Л. Методика определения биологической антиоксидантной способности in vitro: обзор. J. Sci. Food Agric. 2006, 86, 2046–2056. [ Google Scholar ] [ CrossRef ]
28. АОХА. Официальные методы анализа AOAC International, 15-е изд.; Ассоциация Официальной Аналитики Официальных Аналитических Сообществ: Вашингтон, округ Колумбия, США, 1990. [ Google Scholar ]
29. Миллер Г.Л. Применение реагента динитросалициловой кислоты для определения редуцирующего сахара. Анальный. Химреагент 1959, 31, 426–428. [ Google Scholar ] [ CrossRef ]
30. Arnous, A.; Макрис, ДП; Кефалас П. Влияние основных полифенольных компонентов на антиоксидантные свойс








