Энергетические эффекты химических процессов
Термохимические расчеты. Закон Гесса
Термохимические уравнения отличаются от обычных уравнений по трем признакам.
Н2 +Cl2 = 2НCl
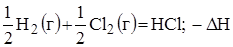 .
.
1. Указывают фазовый состав веществ (газообразное, жидкое, твердое), аллотропную модификацию;
2. Дробные коэффициенты перед формулами исходных веществ, чтобы отнести  к 1 моль продукта;
к 1 моль продукта;
3. Указывают тепловой эффект реакции.
По термохимическим уравнениям проводят расчеты, которые основаны на том, что величина  в химической реакции прямо пропорциональна количеству веществ, вступивших в химическую реакцию или образовавшихся в результате реакции.
в химической реакции прямо пропорциональна количеству веществ, вступивших в химическую реакцию или образовавшихся в результате реакции.
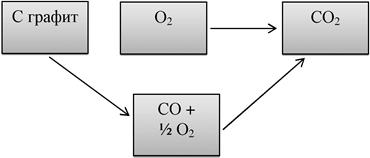
Гесс в 1840 г. установил, что при постоянных температуре и давлении тепловой эффект химической реакции зависит от природы и состояния исходных веществ, но не зависит от числа промежуточных стадий.

| 
|
|
Л.О. Гесс
|
 298° (1) 298° (1)  298° (2) 298° (2)
|
Из закона Гесса следует:
Теплота образования сложного вещества равна теплоте его разложения, но противоположна её по знаку или тепловой эффект прямой реакции равен по величине тепловому эффекту обратной реакции, но противоположен ей по знаку.
В изобарно-изотермических условиях (р, t – const) тепловой эффект химической реакции равен сумме теплоты образования продуктов за вычетом суммы теплоты образования исходных веществ, с четом стехиометрических коэффициентов
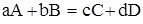 ;
;
 °298х.р. = (c
°298х.р. = (c  °298(C) + d
°298(C) + d  °298(D)) – (a
°298(D)) – (a  °298(A) + b
°298(A) + b  °298(B)).
°298(B)).
Второе следствие позволяет рассчитывать  в химических реакциях и
в химических реакциях и  образования веществ, которые экспериментально трудно определяются.
образования веществ, которые экспериментально трудно определяются.
Скорость химических реакций
Термодинамика прогнозирует только возможность и невозможность процесса, но не говорит, как быстро будет идти реакция.
Наука о скоростях химических реакциях и факторах на их влияющих, называется химической кинетикой.
Под скоростью химических реакций понимают число элементарных актов реакций, проходящих в единицу времени в единицу объема (для гомогенных реакций), и на единицу поверхности (для гетерогенных реакций). Различают среднюю и мгновенную скорости реакции.
Средняя скорость гомогенной химической реакции определяется изменением количества какого-либо из веществ, участвующих в реакции, в единицу времени (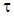 ) в единице объема (или изменением концентрации какого-либо вещества за единицу времени):
) в единице объема (или изменением концентрации какого-либо вещества за единицу времени):
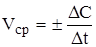 .
.
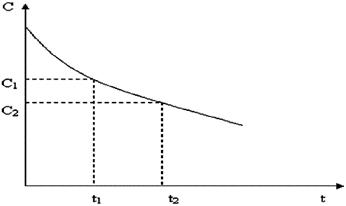
Истинная скорость химической реакции рассматривается как производная концентрации от времени. Скорость в данный момент времени (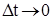 ) называется мгновенной скоростью:
) называется мгновенной скоростью:
 .
.
Скорость химических реакций зависит от многих факторов:
1. Природа реагирующих веществ:
H2 + F2 → 2HF (мгновенно);
H2 + CL2 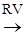 2HCI (на свету);
2HCI (на свету);
H2 + Bt2  2HBt;
2HBt;
H2 + I2 ⇄ HI.
2. Концентрация (давление для газа).
3. Температура.
4. Природа растворителя для реакций, протекающих в растворах.
5. Катализатор.
6. Поверхность раздела для гетерогенных реакций.
 Зависимость скорости химической реакции от концентрации подчиняется закону действия масс. Закон открыт Гульдбергом и Вааге (1876 г.).
Зависимость скорости химической реакции от концентрации подчиняется закону действия масс. Закон открыт Гульдбергом и Вааге (1876 г.).
Согласно этому закону, мгновенная (истинная) скорость реакции пропорциональна произведению концентрации реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам.
В реакции
аА + вВ = еАВ, (1)
протекающей в закрытом сосуде, скорость взаимодействия веществ в соответствии с законом выражается уравнением:
ʋ = k ´ САа ´ СВв,
где k – коэффициент пропорциональности, называемый константой скорости реакции; СА и СВ – концентрации веществ А и В; а и в стехиометрические коэффициенты.
Запись закона действующих масс для данной реакции называют основным кинетическим уравнением реакции. В основном кинетическом уравнении k – константа скорости реакции; она зависит от природы реагирующих веществ и температуры. При концентрации реагирующих веществ, равных 1 моль/дм3, ʋ = k, поэтому физический смысл константы скорости реакции – это скорость химической реакции при концентрациях реагентов 1 моль/дм3.
Скорость химических реакций, протекающих с участием газообразных веществ, зависит от давления. Если в системе увеличить давление путем сжатия, то объем системы уменьшится, концентрация взаимодействующих веществ увеличится, скорость реакции возрастет.
ʋ = k ´ РАa ´ РB в,
где РА, РВ – парциальное давление (то давление, которое оказывал бы газ если находился в сосуде бы один); а и в – стехиометрические коэффициенты.
Если газообразные или жидкие вещества реагируют с твердыми, то скорость реакции зависит от концентрации веществ в газообразном или жидком состоянии, но не зависит от концентрации веществ в твердом состоянии, например, для реакции
Н2(г) + S(тв) = Н2S(г); w = k ´ [Н2].
По числу молекул, участвовавших в каждом элементарном акте реакции, они делятся на одно-, двух- и трехмолекулярные. Так как вероятность одновременного становления трех молекул ничтожно мала, то порядок реакции больше трех не бывает. Если сумма коэффициентов в уравнении аА + вВ = еАВ больше трех, это говорит о том, что уравнение реакции формальное и не отражает механизма процесса.
Реакции могут протекать параллельноА + В, А + D; последователь-но – из А → В → D; сопряженно, т.е. реакция между А и В идет тогда, когда А вступит в реакцию с Е.
Сумма коэффициентов в уравнении 1 определяет порядок реакции.
Порядок реакции может быть нулевым, дробным, первым, вторым и третьим. (Порядок и молекулярность реакции совпадают крайне редко).
Катализ
Явление изменения скорости процесса в присутствии некоторых веществ (катализаторов) называется катализом.
Катализаторы это вещества, изменяющего скорость химической реакции за счет участия в элементарных актах реакции и восстанавливающее свой химический состав после акта химической реакции.
Катализаторы или увеличивают скорость реакции (они называются активаторами или положительными катализаторами), или замедляют реакции (они называются ингибиторами или отрицательными катализаторами).
1. Действия катализатора строго специфичны.
2. Количество катализатора мало по сравнению с массой и объемом реагирующих веществ.
3. Посторонние вещества могут быть по отношению к катализатору промоторами и ядами.
4. Катализатор не смещает равновесия, он изменяет ход процесса.
Механизм гомогенного катализа находит объяснение в теории промежуточных соединений, согласно которой в присутствии катализатора образуются активированные комплексы, энергия активации которых меньше, чем энергия активации активированных комплексов, образующихся без катализатора.
А + В → АВ* → С;
А + В + К = АВК* → С.
Увеличение скорости реакции в присутствии катализатора связано с меньшей энергией активации нового пути процесса.
Более сложен механизм гетерогенного катализа, в котором ускоряющее действие катализатора также связано с образованием промежуточных соединений.

В каждой гетерогенной каталитической реакции можно выделить следующие стадии:
1. Диффузии исходных веществ к поверхности катализатора.
2. Адсорбция исходных веществ на поверхности катализатора с образованием промежуточного соединения А + В + К = АВК.
3. Активация адсорбированного соединени (необходимая для этого энергия и есть энергия активации) АВК → АВК*.
4. Распад активированного комплекса с образованием продуктов реакции АВК*→ СК.
4. Десорбция продуктов реакции с поверхности катализатора СК→ С + К.
5. Диффузии продуктов реакции от поверхности катализатора в объём.
Специфической особенностью гетерогенных каталитических процессов является способность катализаторов к промотированию и отравлению.
Для объяснения этих особенностей Г. Тайлором было высказано предположение о том, что каталитически активной является не вся поверхность катализатора а лишь отдельные участки, называющихся активными центрами, ими являются частицы с диффектами кристаллической структуры.
Химическое равновесие
Большинство химических реакций не доходят до конца. Пределом протекания таких реакций является достижение химического равновесия. Предположим, что реакция идет по уравнению:
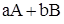 ⇄
⇄ 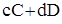
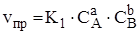
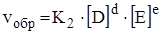
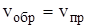 наступает химическое равновесие, когда концентрация веществ при неизменных внешних условиях остается постоянной. Такая концентрация называется равновесной и обозначается [A], [B]. Поэтому
наступает химическое равновесие, когда концентрация веществ при неизменных внешних условиях остается постоянной. Такая концентрация называется равновесной и обозначается [A], [B]. Поэтому
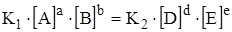 .
.
Отсюда:
 ,
,
где k1 и k2 – постоянные их отношение есть величина постоянная (константа равновесия). Константа равновесия зависит от природы реагирующих веществ, температуры, но не зависит от концентрации.
При изменении внешних условий равновесие нарушается и устанавливается при новых равновесных концентрациях или давлениях. Влияние внешних факторов на равновесие установил принцип Ле-Шателье:
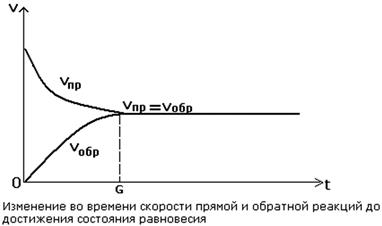
– если на систему, находящуюся в равновесии, оказывают внешнее воздействие, т.е. изменяется концентрация, давление, температура, то равновесие сменяется в строну, противоположную произведенному воздействию. Рассмотрим реакцию синтеза аммиака
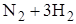 ⇄
⇄ 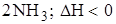 .
.
1. Концентрация 
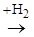
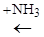 :
:
Увеличение концентрации Н2 в большей степени смещается химическое равновесие, т.к. его концентрация входит в выражение константы равновесия в 3 степени.
2. Температура:
При повышени температуры равновесие смещается в право, если реакция эндотермическая 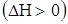 и влево если реакция экзотермическая
и влево если реакция экзотермическая 
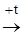 .
.
3. Давление:
При повышении давления равновесие смещается в сторону меньших объёмов газообразных веществ 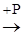 .
.
Энергетические эффекты химических процессов



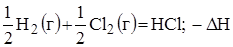 .
. к 1 моль продукта;
к 1 моль продукта;

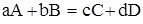 ;
;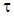 ) в единице объема (или изменением концентрации какого-либо вещества за единицу времени):
) в единице объема (или изменением концентрации какого-либо вещества за единицу времени):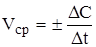 .
.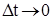 ) называется мгновенной скоростью:
) называется мгновенной скоростью: .
.
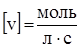
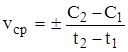
 2HCI (на свету);
2HCI (на свету); 2HBt;
2HBt; Зависимость скорости химической реакции от концентрации подчиняется закону действия масс. Закон открыт Гульдбергом и Вааге (1876 г.).
Зависимость скорости химической реакции от концентрации подчиняется закону действия масс. Закон открыт Гульдбергом и Вааге (1876 г.).
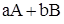 ⇄
⇄ 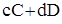
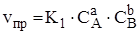
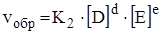
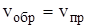 наступает химическое равновесие, когда концентрация веществ при неизменных внешних условиях остается постоянной. Такая концентрация называется равновесной и обозначается [A], [B]. Поэтому
наступает химическое равновесие, когда концентрация веществ при неизменных внешних условиях остается постоянной. Такая концентрация называется равновесной и обозначается [A], [B]. Поэтому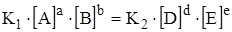 .
. ,
,
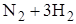 ⇄
⇄ 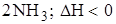 .
.
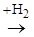
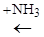 :
: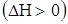 и влево если реакция экзотермическая
и влево если реакция экзотермическая 
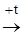 .
.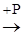 .
.

