Тот факт, что при реакциях окисления и горения, при реакциях нейтрализации энергия всегда выделяется, говорит о том, что ещё до реакции вещества обладали запасом энергии Е.
Энергия Е, скрытая в веществе и выделившаяся при химических процессах, называется внутренней энергией (U, кДж/моль).
Внутренняя энергия зависит от температуры и объёма, различают энергию потенциальную и энергию кинетическую.
U = Uпот. + Uкин.
Uпот. – энергия взаимодействия всех частиц вещества, обусловленная силами притяжения и отталкивания.
Uкин. – энергия движения элементарных частиц ядра, колебаний ядер атомов, движения электронов, молекул вещества.
Определить или рассчитать абсолютное значение внутренней энергии U не представляется возможным, так как это нельзя экспериментально определить. Но можно определить разницу (изменение U)
 .
.
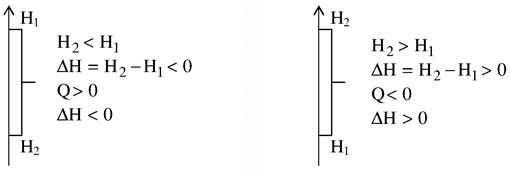
Пусть вещества (химические системы) переходят из состояния 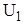 в состояние
в состояние 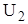 . Допустим, при этом системы поглощают тепло, процесс будет эндотермическим, тогда тепло, поглощенное системой будет затрачиваться на совершение работы расширения Qпогл.
. Допустим, при этом системы поглощают тепло, процесс будет эндотермическим, тогда тепло, поглощенное системой будет затрачиваться на совершение работы расширения Qпогл.
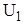 →
→ 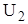 ;
;
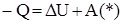 .
.
Уравнение указывает, что если к системе подводится теплота Q, то, в общем случае, она расходуется на изменение её внутренней энергии 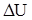 и на совершение работы A.
и на совершение работы A.
Под внутренней энергией системы подразумевается общий её запас, включая энергию поступательного и вращательного движения молекул, энергию движения электронов в атоме, внутриядерную энергию, то есть все виды энергии, кроме кинетической и потенциальной. Под величиной А понимают работу против всех сил, действующих на систему (внешнее давление, электрическое и магнитное поля).
В изохорном состоянии при V = const
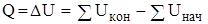 ;
;
Ap = 0.
Поэтому, в этом процессе 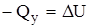 .
.
Для экзотермических процессов 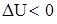 , для эндотермических процессов
, для эндотермических процессов 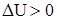 .
.
В изобарных условиях при р = const
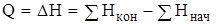 ;
;
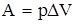 .
.
Подставим значения работы в (*) и получим первый закон сохранения энергии
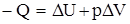 .
.
Тепло, поглощенное системой, затрачивается на приращение внутренней энергии 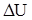 и на совершение работы внешних сил.
и на совершение работы внешних сил.
Закон сохранения энергии:
Энергия не может ни создаваться, ни исчезать. Она может только переходить из одной формы в другую. Она не исчезает бесследно.
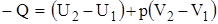 ;
;
 .
.
Сумма внутренней энергии и произведение давления на объем в термодинамике называется энтальпией.
 , [H] = кДж/моль;
, [H] = кДж/моль;
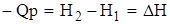 .
.
Тепловой эффект при р – const равен изменению энтальпии, но противоположен ей по знаку.
Энтальпию H невозможно определить и посчитать, но можно определить её изменение  при химических процессах.
при химических процессах.
Энтальпия H – это сложная термодинамическая функция состояния системы, характеризующая полный запас энергии системы.
| 
|
| Экзотермический
| Эндотермический
|
Теплота образования сложных веществ
Изменение энтальпии H при образовании одного моля сложного вещества из одного моля простых веществ при стандартных условиях (р = 101,3 кПа, Т = 298 К) называется теплотой образования вещества. Обозначается  °298°обр.
°298°обр.

 может принимать положительные и отрицательные значения.
может принимать положительные и отрицательные значения.  простых веществ равно нулю (
простых веществ равно нулю ( = 0). Чем отрицательнее значение принимает
= 0). Чем отрицательнее значение принимает  °298, тем больше выделяется тепла при образовании вещества, тем меньшим запасом обладает образовавшееся вещество и тем оно более устойчивое. Если
°298, тем больше выделяется тепла при образовании вещества, тем меньшим запасом обладает образовавшееся вещество и тем оно более устойчивое. Если  > 0, то такое вещество является термодинамически неустойчивым.
> 0, то такое вещество является термодинамически неустойчивым.



 .
.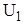 в состояние
в состояние 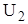 . Допустим, при этом системы поглощают тепло, процесс будет эндотермическим, тогда тепло, поглощенное системой будет затрачиваться на совершение работы расширения Qпогл.
. Допустим, при этом системы поглощают тепло, процесс будет эндотермическим, тогда тепло, поглощенное системой будет затрачиваться на совершение работы расширения Qпогл.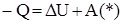 .
.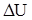 и на совершение работы A.
и на совершение работы A.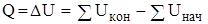 ;
;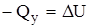 .
.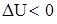 , для эндотермических процессов
, для эндотермических процессов 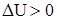 .
.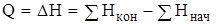 ;
;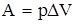 .
.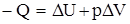 .
.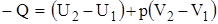 ;
; .
. , [H] = кДж/моль;
, [H] = кДж/моль;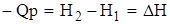 .
. при химических процессах.
при химических процессах.




