

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Американский ученый Гиббс установил, что чем больше разница между энтальпийным и энтропийным факторами, тем дальше система находится от состояния равновесия и тем интенсивнее протекает химический процесс. Разницу между 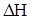 и T
и T 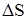 Гиббс предложил назвать изобарно-изотермическим потенциалом. В честь ученого потенциал называют энергией Гиббса.
Гиббс предложил назвать изобарно-изотермическим потенциалом. В честь ученого потенциал называют энергией Гиббса.
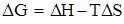 .
.
При образовании 1 моль сложного вещества:
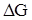 °298 = 0 °298 = 0
| В системе равновесие |
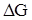 °298 < 0 °298 < 0
| Процесс идет самопроизвольно |
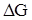 °298 > 0 °298 > 0
| Процесс идет в обратном направлении |
Условием принципиальной возможности процесса является неравенство 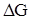 р.т. < 0 – увеличение энергии Гиббса и, если
р.т. < 0 – увеличение энергии Гиббса и, если 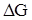 р.т. > 0 – указывает на невозможность самопроизвольного течения процесса. Если
р.т. > 0 – указывает на невозможность самопроизвольного течения процесса. Если 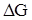 = 0, то система находится в химическом равновесии.
= 0, то система находится в химическом равновесии.
Абсолютное значение G вычислить нельзя, поэтому определяют разность значений 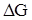 для различных процессов.
для различных процессов.
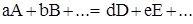
Энергия Гиббса
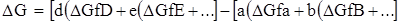 .
.
Значения 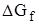 простых веществ равны нулю
простых веществ равны нулю 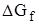 = 0).
= 0).
Величина 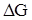 связана с
связана с 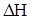 и
и 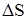 соотношением
соотношением
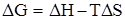 .
.
Протеканию процесса способствует сочетание условий, когда 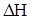 < 0 и
< 0 и 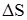 > 0, при этом следует учитывать, что
> 0, при этом следует учитывать, что 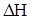 мало зависит от температуры, а
мало зависит от температуры, а 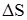 T с повышением температуры сильно растет.
T с повышением температуры сильно растет.
При низких температурах большее значение имеет энтальпийный фактор, при высоких – энтропийный.
Согласно уравнению (**) влияние температуры на 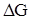 определяется знаком и величиной
определяется знаком и величиной 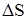 , если при протекании процесса S не изменяется, то значение
, если при протекании процесса S не изменяется, то значение 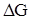 от температуры не зависит.
от температуры не зависит.
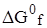 простого вещества при стандартных условиях равна 0 (
простого вещества при стандартных условиях равна 0 (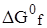 = 0).
= 0).
|
|
Имея дело с 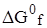 необходимо помнить, что о принципиальной возможности процесса можно говорить, если
необходимо помнить, что о принципиальной возможности процесса можно говорить, если 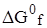 << 0 и невозможности, если
<< 0 и невозможности, если 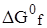 >> 0.
>> 0.
Нельзя считать, что система находится в равновесии, если 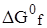 = 0.
= 0.
Глава 5. Химическая кинетика
Скорость химических реакций
Термодинамика прогнозирует только возможность и невозможность процесса, но не говорит, как быстро будет идти реакция.
Наука о скоростях химических реакциях и факторах на их влияющих, называется химической кинетикой.
Под скоростью химических реакций понимают число элементарных актов реакций, проходящих в единицу времени в единицу объема (для гомогенных реакций), и на единицу поверхности (для гетерогенных реакций). Различают среднюю и мгновенную скорости реакции.
Средняя скорость гомогенной химической реакции определяется изменением количества какого-либо из веществ, участвующих в реакции, в единицу времени (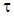 ) в единице объема (или изменением концентрации какого-либо вещества за единицу времени):
) в единице объема (или изменением концентрации какого-либо вещества за единицу времени):
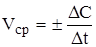 .
.
Истинная скорость химической реакции рассматривается как производная концентрации от времени. Скорость в данный момент времени (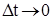 ) называется мгновенной скоростью:
) называется мгновенной скоростью:
 .
.
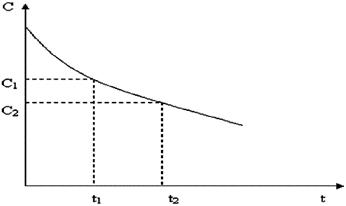
| 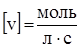
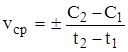
|
Скорость химических реакций зависит от многих факторов:
1. Природа реагирующих веществ:
H2 + F2 → 2HF (мгновенно);
H2 + CL2  2HCI (на свету);
2HCI (на свету);
H2 + Bt2  2HBt;
2HBt;
H2 + I2 ⇄ HI.
2. Концентрация (давление для газа).
3. Температура.
4. Природа растворителя для реакций, протекающих в растворах.
5. Катализатор.
6. Поверхность раздела для гетерогенных реакций.
 Зависимость скорости химической реакции от концентрации подчиняется закону действия масс. Закон открыт Гульдбергом и Вааге (1876 г.).
Зависимость скорости химической реакции от концентрации подчиняется закону действия масс. Закон открыт Гульдбергом и Вааге (1876 г.).
Согласно этому закону, мгновенная (истинная) скорость реакции пропорциональна произведению концентрации реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам.
|
|
В реакции
аА + вВ = еАВ, (1)
протекающей в закрытом сосуде, скорость взаимодействия веществ в соответствии с законом выражается уравнением:
ʋ = k ´ САа ´ СВв,
где k – коэффициент пропорциональности, называемый константой скорости реакции; СА и СВ – концентрации веществ А и В; а и в стехиометрические коэффициенты.
Запись закона действующих масс для данной реакции называют основным кинетическим уравнением реакции. В основном кинетическом уравнении k – константа скорости реакции; она зависит от природы реагирующих веществ и температуры. При концентрации реагирующих веществ, равных 1 моль/дм3, ʋ = k, поэтому физический смысл константы скорости реакции – это скорость химической реакции при концентрациях реагентов 1 моль/дм3.
Скорость химических реакций, протекающих с участием газообразных веществ, зависит от давления. Если в системе увеличить давление путем сжатия, то объем системы уменьшится, концентрация взаимодействующих веществ увеличится, скорость реакции возрастет.
ʋ = k ´ РАa ´ РB в,
где РА, РВ – парциальное давление (то давление, которое оказывал бы газ если находился в сосуде бы один); а и в – стехиометрические коэффициенты.
Если газообразные или жидкие вещества реагируют с твердыми, то скорость реакции зависит от концентрации веществ в газообразном или жидком состоянии, но не зависит от концентрации веществ в твердом состоянии, например, для реакции
Н2(г) + S(тв) = Н2S(г); w = k ´ [Н2].
По числу молекул, участвовавших в каждом элементарном акте реакции, они делятся на одно-, двух- и трехмолекулярные. Так как вероятность одновременного становления трех молекул ничтожно мала, то порядок реакции больше трех не бывает. Если сумма коэффициентов в уравнении аА + вВ = еАВ больше трех, это говорит о том, что уравнение реакции формальное и не отражает механизма процесса.
Реакции могут протекать параллельноА + В, А + D; последователь-но – из А → В → D; сопряженно, т.е. реакция между А и В идет тогда, когда А вступит в реакцию с Е.
Сумма коэффициентов в уравнении 1 определяет порядок реакции.
Порядок реакции может быть нулевым, дробным, первым, вторым и третьим. (Порядок и молекулярность реакции совпадают крайне редко).
|
|
|
|
|

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!