ВВЕДЕНИЕ
Для поддержания работоспособности и жизнедеятельности человек нуждается в ежедневном пополнении энергии. В качестве энергии выступает пищевая продукция, которая включат в себя нутриенты, то есть необходимые для жизнедеятельности питательные вещества. Нутриенты в свою очередь делятся на макронутриенты (содержание которых в живых организмах составляет больше 0,001 %) и микронутриенты (содержание менее 0,001 %). Макронутриенты включают в себя углеводы, жиры, белки и воду; микронутриенты – витамины и минералы. Так как пищевая продукция занимает главенствующее положение в жизни человека, то необходим соответствующий контроль её качества. Контроль заключается в оценке внешнего вида продукции и содержания макронутриентов и микронутриентов.
В данном курсовом проекте представлена общая характеристика углеводов и их основные химические свойства, а также методы их количественного определения различными методами анализа.
ЛИТЕРАТУРНЫЙ ОБЗОР
Общая характеристика углеводов
Углеводы – это органические вещества с общей формулой Сn(H2O)m, то есть многоатомные альдегидо− или кетоспирты (полиоксикарбональные соединения) и их производные.
Углеводы широко распространены в природе, являются компонентами продуктов питания. Сахар, мед, крахмал представляют собой чистые углеводы. В организмах растений и животных углеводы выполняют опорную, энергетическую, дыхательную функции. Важную роль играют соединения углеводов с другими классами веществ, такие как гликопротеиды, нуклеотиды.
Животные организмы не способны синтезировать углеводы и получают их с продуктами растительного происхождения. Растения и некоторые бактерии образуют углеводы из углекислого газа и воды в процессе фотосинтеза, общая схема которого может быть представлена уравнением:
hν
 6CO2↑ + 6H2O C6H12O6 + 6O2↑
6CO2↑ + 6H2O C6H12O6 + 6O2↑
Ежегодно в результате фотосинтеза образуется около 100 млрд т органического вещества (более 15 т на каждого жителя планеты).
Классификация углеводов
Углеводы делятся на две большие группы простые (моносахариды) и сложные (полисахариды).
Моносахариды – простые углеводы, которые в растворе не гидролизируют, кроме гидроксильных и карбонильных групп, они могут содержать тиольные, карбоксильные и аминогруппы. К моносахаридам принято относить также продукты их окисления или восстановления, лишенные карбонильной группы.
Олигосахариды составляют промежуточный класс между моносахаридами и полисахаридами и содержат от двух до десяти моносахаридных остатков, соединенных гликозидными связями.
Дисахариды разделяют на восстанавливающие и невосстанавливающие дисахариды. К восстанавливающим относят дисахариды, имеющие свободный полуацетальный гидроксил, это мальтоза, целлобиоза, лактоза. К невосстаннавливающим относят дисахариды, у которых в образовании гликозидной связи участвует два полуацетальных гидроксила, это дисахариды сахароза и трегалоза.
В состав мальтозы входит α-D-глюкопираноза связь 1,4. Мальтоза образуется в качестве промежуточного продукта гидролиза крахмала или гликогена.
В состав лактозы входит ß-D-галактопираноза и α-D-глюкопираноза связь 1,4.
В состав сахарозы входит ß -D- фруктофураноза и α -D-глюкопираноза связь 1,2.
Полисахариды представляют собой продукты поликонденсации моносахаридов. Это типичные полимеры, часто построенные из тысяч моносахаридных остатков, причем молекулярная масса отдельных молекул, входящих в состав образца, может существенно различаться. К полисахаридам относят: крахмал, гликоген, целлюлоза.
Крахмал состоит из остатков α -D-глюкопиранозы. Связь 1,4 у линейной структуры крахмала, которая называется амилоза и связи 1,4 и 1,6 у разветвленной структуры крахмала, которая называется амилопектин.
Гликоген состоит из остатков α-D-глюкопиранозы, связь 1,4 и 1.6, разветвление у гликогена находятся через каждые 3-4 звена глюкозы.
Целлюлоза или клетчатка состоит из остатков ß-D-глюкопиранозы связь 1,4.
В свою очередь моносахариды классифициются:
а) по наличию альдегидной или кетонной группы моносахариды делят на альдозы и кетозы;
б) по числу углеродных атомов различают триозы (n = 3), тетрозы (n = 4), пентозы (n = 5), гексозы (n = 6). К пентозам относят: арабинозу, ксилозу, рибозу. К гексозам: глюкозу, фруктозу, галактозу;
в) по химической природе различают:
1) нейтральные сахара, содержащие только карбонильные и спиртовые группы;
2) аминосахара, обладающие помимо карбонильных и спиртовых групп еще и аминогруппой, обусловливающей основные свойства этих соединений;
3) кислые сахара, содержащие помимо обычных для этих соединений карбонильных и спиртовых групп еще карбоксильные группы.
Номенклатура моносахаридов
Номенклатура моносахаридов основывается на соединениях с не разветвленной цепью атомов углерода. Углеродные атомы нумеруют таким образом, чтобы карбонильный углерод имел наименьший номер. Заместители (атомы, функциональные группы) получают тот же номер, что и углеродный атом, с которым они соединены. Если в молекуле имеется более одной функциональной группы, они перечисляются в алфавитном порядке. Отсутствие ОН – группы отражается префиксом «дезокси».
 Н – C = O H – C = O
Н – C = O H – C = O
H NH2 H OAc
HO H AcO H
H OH AcO H
H OH H OH
CH2 –OH CH2 –OTr
2 – амино – 2 – дезокси – D – глюкоза 2, 3, 4 – три – О – ацетил –
(D – глюкоэамин) 6 – О – тритил – D – глюкоза
Нередко при написании моносахаридных звеньев (прежде всего в олиго– и полисахаридах) используют буквенные обозначения:
| Ага − Арабиноза
| GlcA – Глюкуроновая кислота
|
| GalNAc – N – Ацетилгалактозамин
| Xyl – Ксилоза
|
| GlcNAc – N – Ацетилглюкозамин
| Man – Манноза
|
| ManNAc – N – Ацетилманнозамин
| Rha – Рамноза
|
| MurNAc – N – Ацетилмурамовая кислота
| Rib – Рибоза
|
| NeuNAc – N – Ацетилнейраминовая кислота
| Fru – Фруктоза
Fuc – Фукоза
|
| Gal – Галактоза
|
|
| Glc – Глюкоза
|
|
Стереоизомерия углеводов
Стереоизомерия или оптическая изомерия является одним из видов пространственной изомерии. Она обусловлена наличием хиральных центров и проявляется в способности некоторых соединений вращать плоскость поляризованного луча света в разные стороны. Наиболее распространенным хиральным центром является асимметрический атом углерода, т. е. углеродный атом, связанный с четырьмя различными заместителями. При наличии одного асимметрического атома углерода молекула может существовать в виде двух изомеров, относящихся друг к другу как несимметричный предмет к своему отражению:
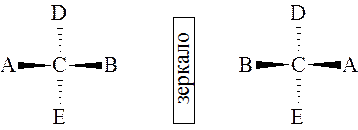
Такие изомеры называются оптическими антиподами или энантиомерами. Один из них вращает плоскость поляризованного луча влево (L- или (-)−форма), другой на такой же угол вправо (D− или (+)−форма). Принадлежность моносахарида к тому или иному генетическому ряду определяется по конфигурации его наиболее удаленного от альдегидной группы асимметрического углеродного атома. Если она соответствует конфигурации D−глицеринового альдегида, то моноза относится к D−ряду, если L−глицеринового альдегида – к L−ряду.

 Н – С = О Н – С = О
Н – С = О Н – С = О
СН2−ОН СН2−ОН
D – глицериновый альдегид L – глицериновый альдегид
Энантиомеры одинаковы по всем физическим и химическим свойствам и отличаются только отношением к плоскополяризованному свету. Смесь энантиомеров в соотношении 1:1 оптической активностью не обладает и называется рацемической. Общее число оптических изомеров можно определить по формуле Фишера: N = 2n, где n - число оптических изомеров.
 Н – С = О
Н – С = О
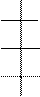 Н – С = О Н * ОН
Н – С = О Н * ОН
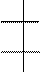 Н – С = О Н * ОН Н * ОН
Н – С = О Н * ОН Н * ОН
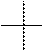 Н – C = О Н * ОН Н * ОН Н * ОН
Н – C = О Н * ОН Н * ОН Н * ОН
Н * OH Н * ОН Н * ОН Н * ОН
CH2−OH CH2−OH CH2−OH CH2−OH
альдотриозы альдотетрозы альдопентозы альдогексозы
N = 2 N = 22 = 4 N = 23 = 8 N = 24 = 16
Знак вращения или абсолютная конфигурация определяется методом рентеноструктурного анализа и помимо природы самого хирального соединения может зависеть от природы растворителя, температуры и др.
Пространственные изомеры с несколькими хиральными центрами, часть которых имеет одинаковую конфигурацию, называют диастереомерами. Пары диастеремеров, отличающиеся конфигурацией только асимметрического атома, называют эпимерами.
Асимметрия молекул приводит к тому, что низшие моносахариды трудно кристаллизуются. Действительно, для включения молекулы в кристаллическую решетку требуется ее единственная конфигурация, а в рацемической смеси присутствует набор по-разному ориентированных молекул.
Ниже приведен генетический D − ряд альдоз, родоначальником которых является D–глицериновый альдегид (данное деление генетического ряда можно осуществить экспериментально с помощью реакции Килиани−Фишера).

Простейшей кетозой, обладающей асимметрическим атомом углерода, является тетроза – D – тетрулоза. Ниже приведен генетический D – ряд кетоз.

Мутаротация
Фуранозные и пиранозные циклы, а также a− и b−аномеры обладают различной термодинамической устойчивостью. Однако в растворе моносахариды существуют как в открытой форме, так и во всех возможных циклических формах. Соотношение этих форм зависит от строения открытой формы моносахарида, природы растворителя и других факторов. В целом пиранозные циклы более устойчивы, чем фуранозные, а в полярных растворителях более устойчивы b−аномеры благодаря экваториальной конформации заместителей.
В водном растворе возможны взаимные превращения фуранозных циклов в пиранозные, а a−аномеров в b−аномеры и наоборот. Такое динамическое равновесие между открытой и циклическими формами моносахарида называется цикло−оксо−таутомерией. Взаимопревращение a− и b−аномеров называется аномеризацией.
Изменение угла вращения свежеприготовленных растворов сахаров, связанное с переходом одних таутомерных форм в другие до наступления состояния равновесия, называется мутаротацией.

Реакции карбонильной группы
а) Удлинение и укорачивание цепи моносарида
Несмотря на то, что в смеси таутомерных форм равновесие сдвинуто в сторону образования циклических форм, в растворе моносахарида присутствует некоторое количество ациклической (открытой) формы, что позволяет ему вступать в реакции, характерные для альдегидов и кетонов. Так, при взаимодействии сахаридов с гидроксиламином образуется смесь оксимов циклических и ациклических форм. При действии на них уксусного ангидрида одновременно происходят ацетилирование и дегидратация с образованием нитрила. Обработка полученного нитрила метилатом натрия приводит к дезацетилированию и отщеплению молекулы HCN:
 Таким путем углеродная цепь альдозы укорачивается на один атом углерода.
Таким путем углеродная цепь альдозы укорачивается на один атом углерода.
Удлинение углеродной цепи можно осуществить циангидринным методом. Взаимодействие альдозы с цианидом натрия приводит к образованию смеси двух изомерных нитрилов, которые легко гидро−лизуются в альдоновые кислоты. Последние при восстановлении амальгамой натрия дают альдозы:
 б) Реакции окисления – восстановления
б) Реакции окисления – восстановления
При восстановлении альдегидной или кето−группы моносахаридов образуются многоатомные спирты. Восстановление проводят водородом в присутствии металлического катализатора (Ni, Pd):

Альдозы образуют один полиол, кетозы дают смесь двух стереоизомеров. Так, из D−фруктозы образуются D−сорбит и D−маннит:

В щелочной среде моносахариды окисляются реактивами Толленса, Бенедикта и Фелинга. Окисление в щелочной среде, как правило, приводит к разрушению молекулы моносахарида, поэтому эти реакции используются для качественного обнаружения углеводов.
Реакция Фелинга
Реактив Фелинга — это смесь раствора №1 - сульфата меди и раствора №2 - щелочного раствора сегнетовой соли. Растворы хранятся отдельно друг от друга, а при использовании смешиваются в соотношении 1:1. При добавлении небольшого количества реактива Фелинга раствор глюкозы дает ярко-синее окрашивание. В данном случае глюкоза растворяет Сu(ОН)2 и ведет себя как многоатомный спирт. При дальнейшем нагревании цвет раствора меняется до желтой окраски, что свидетельствует об образовании CuOH, с последующим переходом в осадок краснокирпичного цвета-образование закиси меди Cu2O. Глюкоза при этом окисляется до глюконовой кислоты. Избыток Сu(ОН)2 при нагревании приводит к образованию окиси меди-осадок черного цвета.
Реакция Бенедикта
Реактив Бенедикта – это смесь сульфата меди, раствора карбоната натрия и цитрата натрия.
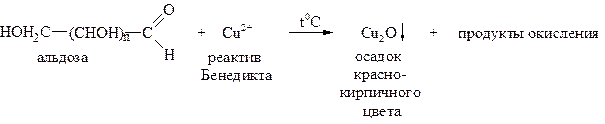 Реакция Толленса (реакция серебряного зеркала)
Реакция Толленса (реакция серебряного зеркала)
Реактив Толленса – смесь растворов нитрата серебра, щелочи и аммиака. Растворы готовятся непосредственно перед определением углеводов и смешиваются в соотношении 1:1. Раствор аммиачного серебра при взаимодействии с глюкозой дает зеркальный налет металлического серебра.

Окисление в нейтральной или кислой среде позволяет сохранить углеродный скелет. Окисление в мягких условиях, например, бромной водой, позволяет окислить карбонильную группу до карбоксильной, не затрагивая гидроксильные группы. Образующиеся при этом кислоты называют альдоновыми.

Использование сильного окислителя, например, разбавленной азотной кислоты, позволяет окислить обе концевые группы - карбонильную и первичную спиртовую до карбоксильных. Образующиеся при этом кислоты называют альдаровыми. Продукт такого окисления D−глюкозы называется D−глюкаровой кислотой:
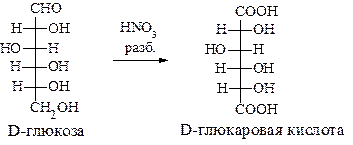
При окислении D−галактозы азотной кислотой образуется
D−галактаровая или слизевая кислота, которая мало растворима в воде. Это позволяет использовать азотную кислоту для обнаружения D−галактозы.
Окисление моносахаридов в биологических системах носит более сложный характер. Так, при аэробном окислении D−глюкозы, катализируемом ферментом глюкозооксидазой, окислению подвергается не открытая, а циклическая форма. Глюкозооксидаза специфична к b−D−глюкопиранозе, которая вначале окисляется до d−лактона:

В кислой среде d−лактон легко превращается в g−лактон. Взаимные превращения лактонов приводят к мутаротации раствора глюконовой кислоты.
При окислении первичной спиртовой группы без затрагивания альдегидной образуются гликуроновые (уроновые) кислоты. Ввиду более легкой окисляемости альдегидной группы получение уроновых кислот представляет собой довольно сложную задачу. В этой связи окислению подвергают моносахарид с защищенной альдегидной группой, например, в виде гликозида:
 Уроновые кислоты имеют большое значение. Они входят в состав различных полисахаридов. Так, глюкуроновая кислота является структурной единицей гепарина, гиалуроновой кислоты и др. Пектиновые вещества плодов и ягод являются полиуронидами.
Уроновые кислоты имеют большое значение. Они входят в состав различных полисахаридов. Так, глюкуроновая кислота является структурной единицей гепарина, гиалуроновой кислоты и др. Пектиновые вещества плодов и ягод являются полиуронидами.
В организме уроновые кислоты выполняют важную функцию: они связывают посторонние и токсические вещества и в виде глюкуронидов выводят их из организма вместе с мочой:
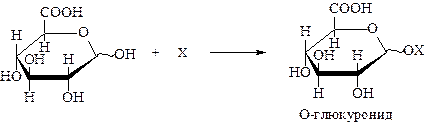
Реакции гидроксильных групп
а) Углеродная цепь любого моносахарида содержит большое число OH−групп, обладающих электроноакцепторными свойствами. По этой причине гидроксильные группы в молекулах моносахаридов обладают большей кислотностью по сравнению со спиртами. В результате моносахариды могут образовывать алкоголяты (сахараты) не только с щелочными и щелочноземельными металлами, но и с их гидроксидами:


б) Образование простых эфиров
Образование простых эфиров в первую очередь происходит по гидроксилу, связанному с С1 (гликозидный, или полуацетальный гидроксил); такие эфиры носят название гликозидов. Гликозиды – широко распространенные природные соединения.
 В более жестких условиях в реакцию вступают все гидроксильные группы углевода:
В более жестких условиях в реакцию вступают все гидроксильные группы углевода:
 Простые эфиры не гидролизуются в слабокислой и щелочной средах. В то же время ацетали легко гидролизуются при кипячении с кислотой:
Простые эфиры не гидролизуются в слабокислой и щелочной средах. В то же время ацетали легко гидролизуются при кипячении с кислотой:
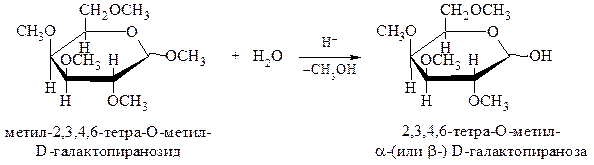 В результате кислотного гидролиза образуется полуацеталь, способный к аномеризации, и раствор такого сахарида мутаротирует.
В результате кислотного гидролиза образуется полуацеталь, способный к аномеризации, и раствор такого сахарида мутаротирует.
в) Образование сложных эфиров
При действии на глюкозу ангидридов кислот образуются сложные эфиры:

Сложные эфиры моносахаридов легко гидролизуются и в кислой, и в щелочной средах. Это объясняется меньшей прочностью сложноэфирной связи по сравнению с простой эфирной связью.
Среди сложноэфирных производных моносахаридов наибольшее значение имеют фосфаты (сложные эфиры фосфорной кислоты):
 3) Кето – енольная таутомерия
3) Кето – енольная таутомерия
В разбавленных щелочных растворах при комнатной температуре моносахариды способны к кето – енольной таутомерии, обусловленной миграцией двойной связи. При переходе от ендиольной формы в кето – форму возможна перегруппировка заместителей у аномерного и соседнего с ним атомов углерода:
 Следствием этого процесса является появление в растворе равновесной смеси эпимеров данного моносахарида.
Следствием этого процесса является появление в растворе равновесной смеси эпимеров данного моносахарида.
При высоких температурах и высоких концентрациях щелочей моносахариды подвергаются расщеплению и полимеризации с образованием различных продуктов, в том числе молочной и муравьиной кислот.
Реакция Молиша
Реакция Молиша является качественной реакцией на углеводы.
В концентрированных растворах кислот при нагревании моносахариды подвергаются дегидратации. Отщепляя по три молекулы воды, альдопентозы образуют фурфурол, а альдо– и кетогексозы - 5–гидроксиметилфурфурол:
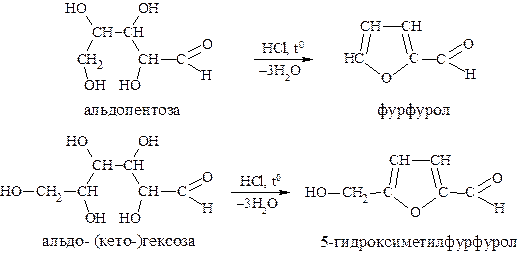
Фурфурол и 5−гидроксиметилфурфурол вступают в характерные реакции с замещенными бензолами с образованием окрашенных продуктов. С двумя молекулами фенола или α-нафтола, резорцина или тимола – образуются соединения фиолетового и красного окрашивания соответственно.
Реакция Селиванова
Обнаружение фруктозы в растворе по методу Селиванова проводят следующим образом. Сначала фруктозу переводят в 5–гидроксиметилфурфурол нагреванием с концентрированной HCl, затем добавляют резорцин (1,3–дигидроксибензол). Образующееся конденсированное соединение в кислой среде отщепляет воду, переходя в структуру с большим числом сопряженных двойных связей. Подобное строение имеют многие индикаторы кислотно–основного типа (фенолфталеин, метилоранж и др.). Присоединяя или отщепляя протон H+, они меняют свою окраску в зависимости от активной реакции среды.
 Реакция Селеванова является качественной реакцией на фруктозу, которая при нагревании смеси дает красное окрашивание раствора.
Реакция Селеванова является качественной реакцией на фруктозу, которая при нагревании смеси дает красное окрашивание раствора.
Реакции брожения
Важным свойством моносахаридов является их ферментативное брожение. Брожению подвергаются в основном гексозы. Молекулы глюкозы способны к расщеплению под действием различных микроорганизмов. Основные виды брожения:
а) спиртовое брожение
Спиртовое брожение протекает под влиянием различных микроорганизмов или фермента зимазы, который содержится, например, в кожуре винограда. В результате спиртового брожения гексоз (для пентоз эта реакция не характерна) образуется этиловый спирт:
 С6Н12О6 2С2Н5ОН + 2СО2
С6Н12О6 2С2Н5ОН + 2СО2
этиловый спирт
б) молочнокислое брожение
Молочнокислое брожение протекает при выработке различных молочнокислых продуктов, при солении огурцов, квашеной капусты и силосовании кормов:
 С6Н12О6 2СН3−СН(ОН)−СООН
С6Н12О6 2СН3−СН(ОН)−СООН
молочная кислота
в) маслянокислое брожение
 С6Н12О6 С3Н7−СООН + 2СО2 + 2Н2
С6Н12О6 С3Н7−СООН + 2СО2 + 2Н2
масляная кислота
г) лимоннокислое брожение
Лимоннокислое брожение протекает в присутствии особых плесневых грибков. Этот процесс используют для получения лимонной кислоты.

Реакция Майяра
Реакция Майяра— химическая реакция между аминокислотой и сахаром, которая, как правило, происходит при нагревании.
При взаимодействии аминогрупп белков и аминокислот с карбонильными группами углеводов происходит реакция меланоидинообразования. Это окислительно – восстановительный процесс с образованием различных промежуточных продуктов, конечные продукты реакции – меланоидины имеют коричневый цвет, влияют на цвет и вкус готовых продуктов. Реакция Майяра происходит при сушке солода, при кипячении сусла с хмелем, при выпечке хлеба, при варке сахарных сиропов, при переработке овощей и фруктов. Скорость и глубина реакции меланоидинообразования зависит от состава продукта, уровня рН среды (более благоприятна слабощелочная среда), температура, влажность. Меланоидинообразование снижает активность витаминов и ферментов, что приводит к снижению пищевой ценности продуктов.
Начальная стадия реакции Майяра:

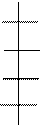

 Н – C = O H – C = NR H – C = NNR H2 – C – NNR
Н – C = O H – C = NR H – C = NNR H2 – C – NNR
H OH +H2NR HO H H OH = O


 HO H –H2O HO H HO H HO H
HO H –H2O HO H HO H HO H
H OH H OH HO H H OH
H OH H OH H OH H OH
CH2 – OH CH2 – OH CH2 – OH CH2 – OH
глюкоза основание Шиффа енаминол соединение Амадори
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Методика фотоколориметрического определения общего сахара в кондитерских изделиях
Общая характеристика метода
Определение состава вещества и контроль его чистоты являются важнейшими факторами при производстве пищевых продуктов. Наряду с химическими методами анализа в настоящее время широко применяются физические методы. Они позволяют осуществлять как быстрый контроль (в течении нескольких минут) больших партий продукции, так и специфический анализ продуктов, витаминов, упаковочных материалов, лекарств и т.д. Одним из таких физических методов является спектральный анализ, основанный на взаимодействии лучистой энергии с исследуемым образцом – метод абсорбционной спектрофотоколориметрии. Методы абсорбционной спектроскопии имеют высокую чувствительность (низкий предел обнаружения), они избирательны и точны. Методы могут быть применены для анализа больших и малых содержаний, но особенно ценной особенностью является возможность определения примесей (до 10−5 – 10−6 %). Важное значение имеет избирательность многих фотометрических методов, позволяющая проводить определения элементов в сложных пробах без химического разделения компонентов. Погрешность фотометрических методов обычно составляет 3 – 5%, уменьшаясь в благоприятных случаях до 1 – 2% и нередко до 0,5 – 1,0%.
Выбор светофильтра
Для того, чтобы выделить лучи определенной длины волны, на пути светового потока помещают светофильтры. Светофильтры пропускают лучи лишь в определенном интервале длин волн и практически полностью поглощают лучи других длин волн. В качестве светофильтров применяют цветные стекла, пленки, окрашенные растворы.
Для каждого конкретного анализа светофильтр выбирают, исходя из спектра поглощения, таким образом, чтобы область максимального поглощения лучей исследуемым раствором и область максимального пропускания лучей светофильтром были одинаковы. При проведении анализа светофильтр подбирают экспериментально. Для этого приготавливают две пробы исследуемого раствора различной концентрации и измеряют их оптические плотности со всеми имеющимися светофильтрами. Затем для каждого светофильтра находят разность оптической плотности ∆А, соответствующую разности концентраций ∆С исследуемых проб. Тот светофильтр, для которого ∆А получается максимальной, выбирают для фотометрирования данного окрашенного раствора. Иногда используют менее точный, но более быстрый прием: выбирают светофильтр по цвету исследуемого раствора.
Таблица 2.1 – Выбор светофильтра по цвету исследуемого раствора
| Цвет раствора
| Область максимального поглощения лучей раствором, нм
| Цвет светофильтра
|
| Желто − зеленый
| 400 – 450
| Фиолетовый
|
| Желтый
| 450 – 480
| Синий
|
| Оранжевый
| 480 – 490
| Зелено − синий
|
| Красный
| 490 – 500
| Сине − зеленый
|
| Пурпурный
| 500 – 560
| Зеленый
|
| Фиолетовый
| 560 – 575
| Желто − зеленый
|
| Синий
| 575 – 590
| Желтый
|
| Зелено − синий
| 590 – 625
| Оранжевый
|
| Сине − зеленый
| 625 − 700
| Красный
|
Оборудование
1) Колориметр КФК − 2МП;
2) Аналитические весы;
3) Фарфоровая ступка с пестиком;
4) Колбы мерные объемом 250 см3 (1 шт.) и 50 см3 (5 шт.);
5) Баня водяная;
6) Пипетки объемом 5 см3 и 10 см3;
7) Химический стакан объемом 100 см3;
8) Фильтры бумажные.
Применяемые реактивы
1) Стандартный раствор сахарозы с концентрацией 4 мг/см3. Навеску 1 г сахарозы х.ч. количественно перенести в мерную колбу на 250 см3 через воронку, заполнить на ¾ дистиллированной водой и перемешать содержимое колбы до полного растворения сахарозы, объем колбы довести до метки дистиллированной водой.
2) Сернокислый раствор дихромата калия. Раствор №1 − навеску 49 г К2Сr2O7 растворить в 300 см3 дистиллированной воды. Раствор №2 − отдельно растворить 300 см3 H2SO4 (ρ = 1,84 г/ см3) в 300 см3 дистиллированной воды. Полученный раствор 1 и раствор 2 смешать при медленном и постепенном сливании, так как смешивание растворов сопровождается выделением тепла.
3) Раствор сульфата цинка.
4) Раствор гидроксида натрия.
5) Дистиллированная вода.
6) Карамель.
Колориметр фотоэлектрический концентрационный КФК−2МП
Колориметр фотоэлектрический концентрационный КФК−2МП предназначен для измерения оптической плотности растворов в отдельных участках диапазона длин волн 315 – 980 нм, выделяемых светофильтрами.
Принцип действия колориметра основан на поочередном измерении светового потока, прошедшего через растворитель (контрольный раствор), и потока, прошедшего через исследуемую среду. Внешний вид прибора представлен в соответствии с рисунком 2.5.

Рисунок 2.5 – Колориметр КФК − 2МП
1 – колориметрический блок с осветителем; 2 – вычислительный блок; 3 – ручка переключения фотоэлементов фотоколориметрического устройства; 4 – ручка перемещения кювет: в положении 1 в световой поток вводится кювета с растворителем (контрольным раствором), в положении 2 в световой поток вводится кювета с исследуемым раствором; 5 – крышка кюветного отделения; 6 – ручка переключения фотоэлементов колориметрического блока.
Выполнение работы
1) Подготовка образца к анализу
Навеску 1 г измельченного и хорошо перемешанного продукта (карамель) растворяют в химическом стаканчике с дистиллированной водой, нагретой до 60 – 70°С. Внимание! Далее в зависимости от состава изделия выполняют пункты (А) или (Б).
(А) Если изделие полностью растворимо, то полученный раствор охлаждают до комнатной температуры и переносят в мерную колбу объемом 250 см3, доводят дистиллированной водой до метки. Затем в мерную колбу объемом 50 см3 отбирают 5 см3 полученного раствора конфеты, 8 см3 дистиллированной воды и 13 см3 сернокислого раствора К2Cr2O7. Маркируют колбу цифрой 5.
(Б) Если изделие в своем составе имеет вещества, не растворимые в воде, то полученную охлажденную взвесь переносят в мерную колбу на 250 см3, тщательно смывая нерастворимые частицы дистиллированной водой в колбу, заполняя ее примерно до половины объема. Колбу помещают на водяную баню, нагретую до 60°С, выдерживают 15 мин., периодически помешивая содержимое. Далее раствор охлаждают, прибавляют 10 см3 раствора ZnSO4 и экспериментально установленный объем NaOH. Содержимое колбы перемешивают, доводят дистиллированной водой до метки, и фильтруют в чистую колбу. Затем в мерную колбу на 50 см3 отбирают 5 см3 полученного раствора конфеты, 8 см3 дистиллированной воды и 13 см3 сернокислого раствора К2Cr2O7.
2) Приготовление растворов для градуировочного графика
Растворы для градуировочного графика готовят в соответствии с таблицей 2.2.
Таблица 2.2 – Приготовление градуировочных растворов
| № колбы
| V (стандартного раствора сахарозы), см3
| V (Н2Одист), см3
| V (раствора K2Cr2O7), см3
|
|
| –
| 13,00
| 13,00
|
|
| 1,00
| 12,00
| 13,00
|
|
| 3,00
| 10,00
| 13,00
|
|
| 5,00
| 8,00
| 13,00
|
3) Проведение цветной реакции и измерения оптической плотности растворов
Поместить все колбы объемом 50 см3 (5 шт.), содержащие градуировочные растворы, контрольный и исследуемый растворы, в кипящую водяную баню на 10 мин. Затем охладить содержимое колб до комнатной температуры под водопроводной водой и довести дистиллированной водой до метки. Каждый раствор тщательно перемешать и измерить оптическую плотность с помощью КФК −2 − МП так, как указано в разделе «Порядок боты фотоколориметра» при λ = 670 нм в кюветах шириной 30 мм. Результаты записать в таблицу 2.3.
4) Обработка результатов эксперимента.
а) Рассчитать массу сахарозы в колбах 2 – 4 по формуле (2.6):
где С– концентрация стандартного раствора;
V– объем стандартного раствора сахарозы, внесенного в колбу.
Таблица 2.3 – Результаты эксперимента
| № колбы
| Масса сахарозы, мг
| Значение оптической плотности
|
| А1
| А2
| А3
| Аср
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| –
|
|
|
|
|
б) По данным таблицы 2.3 построить градуировочный график в координатах А = f(m).
в) Массовую долю общего сахара рассчитывают двумя способами:
1) по градуировочному графику
Используя градуировочный график и полученное значение оптической плотности раствора в колбе № 5, находят массу сахара m1 (мг) и рассчитывают массовую долю общего сахара в процентах по формуле (2.7):
|
| 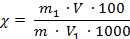
| (2.7)
|
где χ – массовая доля общего сахара, %;
m – масса навески, г;
m1 – найденная масса сахара, мг;
V – вместимость мерной колбы, где растворяли навеску продукта, см3;
V1 – объем образца, взятого непосредственно для проведения реакции, см3.
2) с помощью вычислительного блока ФЭК.
По градуировочному графику определить коэффициенты «с» и «В»: с = D0, так как при концентрации С = 0 оптическая плотность D = 0, то и «с» = 0 (градуировочная кривая выходит из начала координат).
|
| 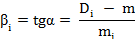
| (2.8)
|
где α – угол между градуировочной прямой и осью концентраций;
Di, mi – результаты, полученные для каждой точки градуировочного графика.
По полученным значениям рассчитать Вср. Ввести в память вычислительного блока коэффициенты «с» и «Вср». Для этого нажать соответствующую клавишу («с» или «В»), затем клавишу «СБР». При этом на цифровом табло слева высветится соответствующий символ. Далее набрать с помощью клавиатуры расчетные значения коэффициентов и нажать клавишу «УТВ». Измерить концентрацию исследуемого раствора. Для этого установить положение кюветодержателя 1 (контрольный раствор), нажать клавишу «К(1)».Установить положение кюветодержателя 2 (исследуемый раствор), нажать клавишу «С(4)». Измерения повторить дважды и вычислить средний арифметический результат.
Рассчитать массовую долю общего сахара в процентах по формуле (2.9):
|
| 
| (2.9)
|
где mприб – найденная масса сахара в аликвоте по измерительному блоку прибора КФК − 2МП с использованием коэффициентов.
Остальные величины в формуле те же, что и в предыдущей формуле.
г) Сравнить значения массовой доли общего сахара, вычисленные двумя способами.
Общая характеристика метода
Поляриметрический анализ основан на измерении изменения плоскости поляризации света оптически активными веществами, т.е. на способности некоторых веществ изменять направление поляризованных лучей света.
Оптическая активность кристаллов. В 1874 г. установлено, что четыре связи, образуемые атомом углерода, направлены в пространстве к четырем углам тетраэдра. Это открытие было сделано при попытках объяснить явление, которое наблюдается при прохождении поляризованного света через некоторые вещества.
Луч естественного света (см. рисунок 2.7, а), колеблющийся во всех направлениях, пройдя через некоторые кристаллы (кальцит, исландский шпат, турмалин), расщепляется на два луча (см. рисунок 2.7, б); каждый из них представляет собой плоскополяризованный свет.
 а
а
| 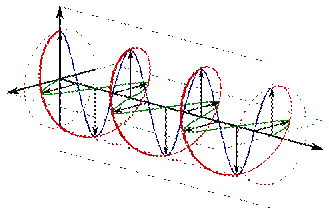 б
б
|
Рисунок 2.7 – Схема колебаний луча света (а – обычный свет, б – п





 6CO2↑ + 6H2O C6H12O6 + 6O2↑
6CO2↑ + 6H2O C6H12O6 + 6O2↑
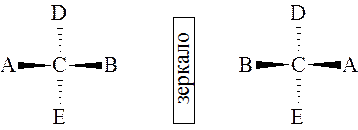

 Н – С = О Н – С = О
Н – С = О Н – С = О Н – С = О
Н – С = О Н – С = О Н * ОН
Н – С = О Н * ОН Н – С = О Н * ОН Н * ОН
Н – С = О Н * ОН Н * ОН Н – C = О Н * ОН Н * ОН Н * ОН
Н – C = О Н * ОН Н * ОН Н * ОН


 Таким путем углеродная цепь альдозы укорачивается на один атом углерода.
Таким путем углеродная цепь альдозы укорачивается на один атом углерода. б) Реакции окисления – восстановления
б) Реакции окисления – восстановления

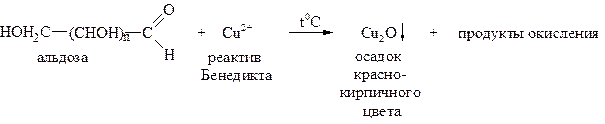 Реакция Толленса (реакция серебряного зеркала)
Реакция Толленса (реакция серебряного зеркала)

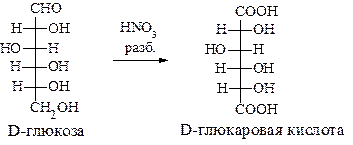

 Уроновые кислоты имеют большое значение. Они входят в состав различных полисахаридов. Так, глюкуроновая кислота является структурной единицей гепарина, гиалуроновой кислоты и др. Пектиновые вещества плодов и ягод являются полиуронидами.
Уроновые кислоты имеют большое значение. Они входят в состав различных полисахаридов. Так, глюкуроновая кислота является структурной единицей гепарина, гиалуроновой кислоты и др. Пектиновые вещества плодов и ягод являются полиуронидами.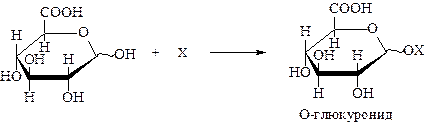


 В более жестких условиях в реакцию вступают все гидроксильные группы углевода:
В более жестких условиях в реакцию вступают все гидроксильные группы углевода: Простые эфиры не гидролизуются в слабокислой и щелочной средах. В то же время ацетали легко гидролизуются при кипячении с кислотой:
Простые эфиры не гидролизуются в слабокислой и щелочной средах. В то же время ацетали легко гидролизуются при кипячении с кислотой: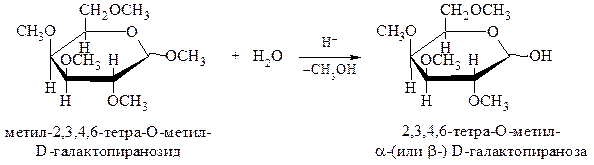 В результате кислотного гидролиза образуется полуацеталь, способный к аномеризации, и раствор такого сахарида мутаротирует.
В результате кислотного гидролиза образуется полуацеталь, способный к аномеризации, и раствор такого сахарида мутаротирует.
 3) Кето – енольная таутомерия
3) Кето – енольная таутомерия Следствием этого процесса является появление в растворе равновесной смеси эпимеров данного моносахарида.
Следствием этого процесса является появление в растворе равновесной смеси эпимеров данного моносахарида.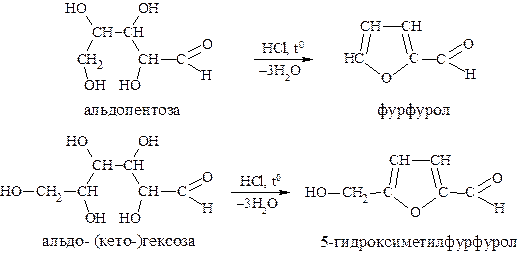
 Реакция Селеванова является качественной реакцией на фруктозу, которая при нагревании смеси дает красное окрашивание раствора.
Реакция Селеванова является качественной реакцией на фруктозу, которая при нагревании смеси дает красное окрашивание раствора. С6Н12О6 2С2Н5ОН + 2СО2
С6Н12О6 2С2Н5ОН + 2СО2 С6Н12О6 2СН3−СН(ОН)−СООН
С6Н12О6 2СН3−СН(ОН)−СООН С6Н12О6 С3Н7−СООН + 2СО2 + 2Н2
С6Н12О6 С3Н7−СООН + 2СО2 + 2Н2




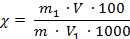
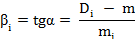

 а
а
 б
б


