

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
РАСЧЕТ ИЗМЕНЕНИЯ ИЗОБАРНОГО ПОТЕНЦИАЛА
МЕТАЛЛУРГИЧЕСКИХ РЕАКЦИЙ
Для заданной металлургической реакции (табл. 2) построить изобарные потенциалы: приближенным методом или методом Темкина-Шварцмана и оценить направление реакции. Построить графики  .
.
Необходимые теплофизические параметры веществ представлены в [1] или взять из Интернета.
Таблица 2
Металлургические реакции
| № вар. | № вар. | ||
| Fe + CO2 = FeO +CO | 3Fe + SO2 = FeS + 2FeO | ||
| CaCO3 = CaO + CO2 | Si +O2 = SiO2 | ||
| 2Fe +O2 = 2FeO | 2C + O2 = 2CO | ||
| 2Mn + O2 = 2MnO | C +H2O = CO + H2 | ||
| C + CO2 = 2CO | Si + 2CO2 = SiO2 + 2CO | ||
| Fe + ½ O2= FeO | Mn + CO2 = MnO + CO | ||
| Si + 2H2O = SiO2 + 2H2 | Si + 2FeO = SiO2 + 2Fe | ||
| Mn + H2O = MnO + H2 | C + FeO = CO + Fe | ||
| Mn + FeO = MnO + Fe | P2O5 + 3FeO = (FeO)3P2O5 | ||
| 2P + 5FeO = P2O5 + 5Fe | MnS + CaO = CaS + MnO | ||
| FeS + CaO = CaS + FeO | SiO2 + 2C = Si + 2CO | ||
| 3FeO + 2Al = Al2O3 + 3Fe | SiO2 + 2Fe = Si + 2FeO | ||
| MnO + C = Mn + CO | 2MnO + Si = 2Mn + SiO2 | ||
| CaO + 3C = CaC2 + CO | 3MnO + CaC2 = 3Mn + CaO + 2CO | ||
| 3FeO + CaC2 = 3Fe + CaO + 2CO | CaF2 + FeO = CaO + FeF3 | ||
| 2CaF2 + SiO2 = 2CaO + SiF4 | 2CaF2 + Ti = 2Ca + TiF4 | ||
| 3CaF2 + 2Al = 3Ca + 2AlF3 | 3Fe + Cu2O = FeO + 2Cu | ||
| 2Ce + 3MgCl2 = 3Mg + 2CeCl3 | 3NiO + 2Al= Al2O3 + 3Ni | ||
| 5NiO + 2Cr = Cr2O5 + 5Ni | NiO + Ti = TiO + Ni | ||
| 2NiO + Si = SiO2 + 2Ni | Si + 2FeO = 2FeO + SiO2 | ||
| (FeO)3P2O5 + 4CaO = (CaO)4P2O5 + 3FeO | |||
| 3FeS + CaC2 + 2CaO = 3CaS + 3Fe + 2CO | |||
| 3MnS + CaC2 + 2CaO = 3CaS + 3Mn + 2CO | |||
| 2Fe3O4 + 4SiO2 + 4Cu = 3Fe2SiO4 + Cu4SiO4 |
Практическое задание №2
ОЦЕНКА ПРОЦЕССОВ ВОССТАНОВЛЕНИЯ ОКСИДОВ МЕТАЛЛОВ
НА ОСНОВЕ ТЕРМОДИНАМИЧЕСКИХ РАСЧЕТОВ
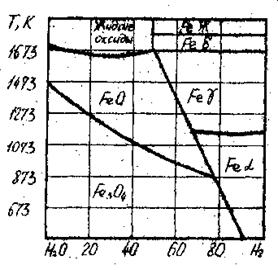
Для заданных температур рассчитать равновесные составы газовых фаз реакций восстановления оксидов железа монооксидом углерода и водорода (табл. 3). Результаты расчетов сравнить сданными диаграмм состояния (рис. 1–2).
Таблица 3
Варианты контрольных задач
|
|
| № вар. | Т, К | № вар. | Т, К | № вар. | Т, К |

| 
|
| Рис. 1. Диаграмма равновесия оксидов железа с атмосферой СО – СО 2 | Рис. 2. Диаграмма равновесия оксидов железа с атмосферой H 2 – Н2О |
Практическое задание №3
ОЦЕНКА ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ
ГАЗОВОЙ ФАЗЫ
1. Определить направление реакций взаимодействия компонентов при различных температурах и составах газовой фазы (табл. 4).
Найти константу равновесия при Р = 1.
Таблица 4
Варианты заданий
| № | Т, К | Составы фаз, % | № | Т, К | Составы фаз, % | ||||
| СО 2 | СО | О 2 | СО 2 | СО | О 2 | ||||
2. Определить равновесные составы газовых фаз, образующихся в результате диссоциации CО2 и Н 2 О при Р = 1.
Определить кислородные потенциалы газовых фаз.
Ответить на вопрос, какая из фаз проявляет более высокую активность.
Температуры для исследования выбрать по формулам:
Т 1 = 500× К + N ×25
Т 2 = 2000× К – N ×25
где N – номер варианта; Т 1 и Т 2 – температуры, для которых проводится исследование.
|
|
Практическое задание №4
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ НАЧАЛА ВОССТАНОВЛЕНИЯ ОКСИДОВ ТВЕРДЫМ УГЛЕРОДОМ
Для окислов металлов вычислить температуры восстановления их твердым углеродом (при давлении Р = 1). Проведя расчет для различных давлений, построить зависимости Т = j (P), Р СО= j(Р), формула (4.9).
Таблица 5
Варианты заданий
| № вар. | Окисел | 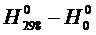 ,
Дж/моль ,
Дж/моль
| 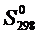 ,
Дж/моль×К ,
Дж/моль×К
| № вар. | Окисел | 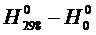 ,
Дж/моль ,
Дж/моль
| 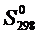 ,
Дж/моль×К ,
Дж/моль×К
|
| 50,95 | 94,865 | ||||||
| 70,45 | 38,02 | ||||||
| – | 77,5 | 66,2 | |||||
| 39,77 | 71,97 | ||||||
| 52,8 | 127,3 | ||||||
| 73,3 | 125,2 | ||||||
| 81,2 | 41,87 | ||||||
| 42,66 | 52,3 | ||||||
| 92,99 | 34,79 | ||||||
| 264,6 | 60,69 | 50,37 | |||||
| 87,5 | 77,37 | ||||||
| 146,29 | 127,15 | ||||||
| 94,203 | 33,62 | ||||||
| 26,96 | 98,4 | ||||||
| 61,55 | 96,7 | ||||||
| 53,17 | 131,0 | ||||||
| 110,5 | 43,67 | ||||||
| 75,090 |
Практическое задание №5. ИССЛЕДОВАНИЕ АКТИВНОСТИ КОМПОНЕНТОВ
В МЕТАЛЛУРГИЧЕСКИХ ШЛАКАХ
Задача № 5.1
Определить энергии смешения шлаковых систем, указанных в таблице. Воспользоваться диаграммами состояния окисных систем.
| № вар. | FeO | MnO | CaO | MgO | SiO 2 | Al 2 O 3 | TiO 2 | Cr 2 O 3 |
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + | ||||||
| + | + | + |
|
|
Задача № 5.2
Определить активность шлаковых систем заданного состава (предполагая шлак «некислый») и построить зависимость содержания кислорода в железе, равновесном сошлаком от температуры Т = 1600 °С
| № вар. | Концентрация компонентов | |||||
| FeO | MnO | CaO | MgO | SiO 2 | Р 2 О 5 | |
| 38,45 | 2,45 | 15,0 | 5,0 | 30,0 | 0,1 | |
| 48,14 | 2,68 | 15,88 | 3,82 | 29,38 | 0,21 | |
| 48,92 | 3,05 | 16,75 | 2,15 | 28,75 | 0,38 | |
| 45,9 | 3,25 | 17,63 | 4,60 | 29,01 | 0,61 | |
| 43,32 | 4,17 | 18,51 | 6,3 | 27,5 | 0,2 | |
| 43,48 | 4,36 | 19,37 | 5,39 | 26,87 | 0,53 | |
| 42,44 | 4,44 | 20,25 | 6,0 | 26,25 | 0,62 | |
| 44,34 | 3,70 | 21,12 | 4,20 | 25,63 | 1,01 | |
| 44,85 | 3,94 | 21,99 | 3,92 | 25,0 | 0,3 | |
| 47,73 | 2,78 | 22,87 | 2,03 | 24,36 | 0,23 | |
| 47,75 | 2,87 | 23,75 | 1,43 | 23,75 | 0,45 | |
| 45,88 | 3,34 | 24,62 | 2,45 | 23,13 | 0,58 | |
| 47,20 | 3,46 | 24,92 | 1,52 | 22,5 | 0,4 | |
| 44,37 | 2,55 | 25,50 | 5,0 | 21,86 | 0,72 | |
| 47,09 | 2,07 | 26,37 | 2,54 | 21,25 | 0,68 | |
| 45,48 | 2,52 | 27,25 | 3,62 | 20,63 | 0,50 | |
| 46,36 | 2,64 | 28,12 | 2,31 | 20,0 | 0,57 | |
| 45,58 | 2,75 | 28,99 | 2,50 | 19,38 | 0,80 | |
| 43,78 | 2,83 | 29,87 | 4,15 | 18,75 | 0,62 | |
| 40,89 | 3,03 | 30,74 | 6,3 | 18,13 | 0,91 | |
| 44,53 | 3,14 | 31,62 | 5,18 | 17,5 | 0,93 | |
| 45,13 | 2,46 | 32,49 | 2,31 | 16,88 | 0,73 | |
| 42,63 | 3,62 | 33,37 | 3,15 | 16,25 | 0,98 | |
| 41,31 | 3,5 | 34,25 | 4,31 | 15,63 | 1,0 | |
| 41,84 | 2,31 | 35,12 | 4,92 | 15,0 | 0,81 | |
| 41,11 | 2,74 | 35,99 | 6,0 | 14,34 | 0,82 | |
| 41,27 | 3,4 | 36,87 | 3,61 | 13,75 | 1,1 | |
| 41,19 | 4,01 | 37,75 | 3,82 | 13,12 | 0,11 | |
| 43,04 | 3,57 | 38,62 | 2,15 | 12,5 | 0,12 | |
| 40,29 | 3,63 | 39,49 | 4,60 | 11,66 | 0,13 | |
| 39,9 | 2,95 | 40,37 | 5,39 | 11,25 | 0,14 | |
| 37,01 | 4,96 | 41,25 | 6,0 | 10,63 | 0,15 | |
| 36,39 | 5,03 | 42,12 | 6,3 | 10,0 | 0,16 | |
| 38,01 | 5,26 | 42,99 | 4,2 | 9,37 | 0,17 | |
| 38,73 | 4,55 | 43,87 | 3,92 | 8,75 | 0,18 | |
| 41,44 | 3,35 | 44,75 | 2,03 | 8,13 | 0,3 | |
| 37,68 | 6,15 | 45,62 | 2,45 | 7,5 | 0,6 | |
| 40,69 | 3,64 | 46,49 | 1,52 | 6,86 | 0,8 | |
| 40,37 | 2,57 | 47,37 | 2,54 | 6,25 | 0,9 | |
| 39,23 | 3,58 | 48,25 | 2,31 | 5,63 | 1,0 |
|
|
Задача № 5.3
Определить коэффициент активности (j) и активность (Q) FeO в кислом шлаке заданного состава. Воспользоваться формулой (5.11). Температура изменяется от 1406 К до 1800 К. Построить зависимости 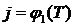 ,
, 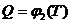 .
.
| № вар. | Состав шлака, % (по массе) | |||
| FeO | CaO | SiO 2 | Al 2 O 3 | |
| 51,8 | 12,2 | |||
| 8,15 | 36,4 | 45,4 | 10,05 | |
| 6,5 | 37,0 | 46,3 | 10,3 | |
| 6,7 | 41,5 | 41,5 | 10,3 | |
| 5,25 | 45,8 | 38,3 | 10,65 | |
| 6,9 | 48,2 | 34,4 | 10,5 | |
| 7,5 | 29,5 | 51,0 | 11,9 | |
| 6,5 | 29,9 | 51,5 | 12,1 | |
| 7,15 | 41,3 | 41,3 | 10,25 | |
| 5,2 | 42,1 | 42,1 | 10,6 | |
| 4,0 | 50,0 | 35,5 | 10,5 | |
| 7,0 | 41,2 | 11,65 | ||
| 12,05 | 16,8 | 30,3 | 40,85 | |
| 13,0 | 40,5 | 30,0 | 16,5 | |
| 8,3 | 23,01 | 50,0 | 18,69 | |
| 9,1 | 20,3 | 41,08 | 29,52 | |
| 6,02 | 30,8 | 43,2 | 19,98 | |
| 10,1 | 42,5 | 32,7 | 14,7 | |
| 11,8 | 44,8 | 35,8 | 7,6 | |
| 18,7 | 55,0 | 21,1 | 5,2 | |
| 15,5 | 48,8 | 28,7 | 7,0 | |
| 16,01 | 30,1 | 48,7 | 5,19 | |
| 13,1 | 25,3 | 49,7 | 11,9 | |
| 18,9 | 20,7 | 45,3 | 15,1 | |
| 16,0 | 28,1 | 44,1 | 11,8 | |
| 17,6 | 24,7 | 35,3 | 22,4 | |
| 10,9 | 17,3 | 40,04 | 31,76 | |
| 9,8 | 54,2 | 33,8 | 2,2 | |
| 17,1 | 41,7 | 38,1 | 3,1 | |
| 15,3 | 39,4 | 44,4 | 0,9 | |
| 7,8 | 29,03 | 48,8 | 14,37 | |
| 8,7 | 21,9 | 49,9 | 19,5 | |
| 6,7 | 50,0 | 31,8 | 11,5 | |
| 8,5 | 48,1 | 35,04 | 8,36 | |
| 10,1 | 47,2 | 32,01 | 10,69 | |
| 7,8 | 33,7 | 44,3 | 14,2 | |
| 11,3 | 33,8 | 48,7 | 5,83 | |
| 14,8 | 33,3 | 49,07 | 2,83 | |
| 18,1 | 22,2 | 48,03 | 11,67 | |
| 20,0 | 19,5 | 45,1 | 15,4 |
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
МЕТАЛЛУРГИЧЕСКИХ РЕАКЦИЙ
(практическое задание №1)
Основой для разработки высокотемпературных металлургических процессов являются термодинамические процессы, позволяющие оценить вероятность протекания заданной реакции, а также оценить соотношение продуктов реакция. Важнейшим параматром, используемым для оценки металлургических реакций, является изменение изобарного потенциала и константы равновесия. Вычисление этих параметров позволяет выбирать температурные области, наиболее интересные для исследуемых металлургических реакций.
Расчет изобарного потенциала может быть осуществлен по следующему соотношению:
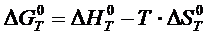 (1.1)
(1.1)
где  (1.2)
(1.2)
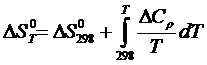 (1.3)
(1.3)
где  ,
,  – изменение энтальпии и энтропии соответственно веществ начального и конечного состояний;
– изменение энтальпии и энтропии соответственно веществ начального и конечного состояний;
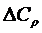 – изменение теплоемкости; Т – температура.
– изменение теплоемкости; Т – температура.
При наличии в изучаемой системе фазовых переходов при расчетах изобарного потенциала учитывают вклад теплоты фазовых переходов:
 (1.4)
(1.4)
где  – теплота фазового перехода;
– теплота фазового перехода;
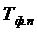 – температура фазового перехода.
– температура фазового перехода.
Конечная формула (4.1.1), с учетом фазовых переходов компонентов металлургических реакций, принимает вид:
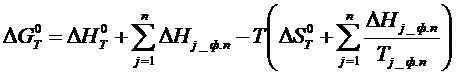 (1.5)
(1.5)
где n – число фазовых переходов, происходящих до температуры Т.
а) Приближенный метод расчета изобарного потенциала
В случае предположения  изобарный потенциал может быть вычислен приближенно с помощью следующей формулы:
изобарный потенциал может быть вычислен приближенно с помощью следующей формулы:
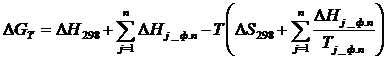 (1.6)
(1.6)
Для вычисления изменения энтальпии  и энтропии
и энтропии 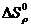 при стандартной температуре пользуются следующими соотношениями:
при стандартной температуре пользуются следующими соотношениями:
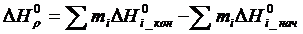 ( 1. 7)
( 1. 7)
 ( 1. 8)
( 1. 8)
где mi – стехиометрический коэффициент продуктов реакции;
|
|
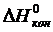 и
и 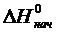 – энтальпии конечных и исходных веществ реакции;
– энтальпии конечных и исходных веществ реакции;
 и
и 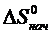 – энтропии конечных и исходных веществ реакции.
– энтропии конечных и исходных веществ реакции.
Однако в ряде случаев степень точности приближенных методов расчета не является удовлетворительной. Поэтому необходимым является учет изменений теплоемкости.
б) Метод Темкина–Шварцмана
Обычно в справочных данных изменение теплоемкости от температуры записывают в виде:
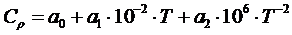 (1.9)
(1.9)
или
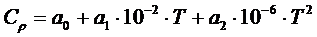 (1.10)
(1.10)
Изменение тегшоемкости  приближенно можно оценить по формулам:
приближенно можно оценить по формулам:
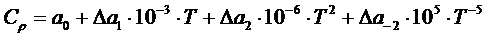 (1.11)
(1.11)
 (1.12)
(1.12)
 (1. 13)
(1. 13)
 (1.14)
(1.14)
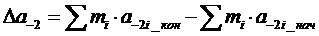 (1.15)
(1.15)
Исходя из уравнения изобары химической реакции
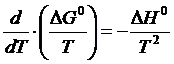 (1.16)
(1.16)
и подставляя уравнение (1.2) в уравнение (1.16), после интегрирования получим:
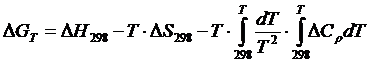 (I.I7)
(I.I7)
Подставив уравнение (1.11) в уравнение (1.17), получим
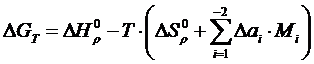 (1.18)
(1.18)
где i – индекс, принимающий значение 0, 1, 2, -2;
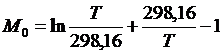


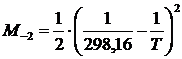
Если в системе происходят фазовые переходы, то в формулу (1.18) вносят поправку DП, добавляющую к правой части (1.18)
 (1.19)
(1.19)
Таким образом, вычисление потенциала методом Темкина-Шварцмана сводится к определению DGТ по формулам (1.18) и (1.19). Следует отметить, что в данном случае учтен вклад в DGТ, связанный q изменением коэффициентов степенного ряда теплоемкости, происходящим в интервале между фазовыми переходами.
Оценка процесса с помощью термодинамических расчетов происходит по следующему критерию:
DGТ < 0 – реакция идет в сторону образования продуктов;
DGТ > 0 – протекание реакции невозможно, и, следовательно, все попытки осуществить процесс лишены смысла.
Пример расчета термодинамического потенциала
(практическое задание №1)
Выполним расчет изменения изобарного потенциала реакции тетрахлорида титана и магния для различных температур, находящихся в интервале 298–1500 К. Реакция имеет вид:
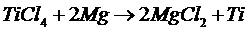
Исходные данные для расчета представлены в табл. 2.1.
Таблица 2.1
Термодинамические характеристики веществ
| Вещество | Сост. | DН298 кДж/моль | S298 кДж/моль×град | Тпл К | DНпл кДж/моль | Ткип К | DНкип кДж/моль |
| TiCl4 | ж | – 801,7 | 249,4 | – | – | – 36,2 | |
| MgCl2 | тв | – 641,8 | 89,5 | 43,1 | – | – | |
| Ti | тв | 30,5 | – | – | – | – | |
| Mg | тв | 32,5 | – 8,8 | – | – | ||
| Mg | ж | – | – | – | – | – 127,6 |
а) Приближенный расчет
Рассчитаем 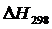 и
и  , воспользовавшись уравнениями (1.7) и (1.8).
, воспользовавшись уравнениями (1.7) и (1.8).
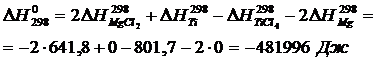
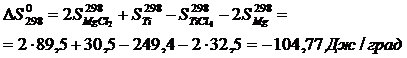
Вычислим изменения изобарного потенциала по формуле (1.6) для Т = 987 К:
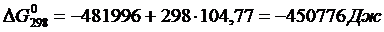
Вычислим изменения изобарного потенциала для Т =410 К:
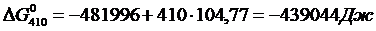
Вычислим изменения потенциала для Т =923 К, учитывая, что при нагреве вещества до этой температуры происходит фазовый переход при Т = 410 К (формула 1.6):

Вычислим изменения потенциала для Т =987 К, учитывая, что при нагреве вещества до этой температуры происходят два фазовых перехода при Т = 410 К и
Т = 923 К (формула 1.6).
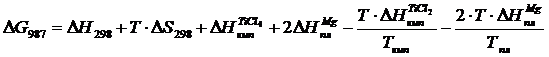
В четвертой и шестом слагаемых присутствует стехиометрический коэффициент 2, взятый из уравнения реакции

Для Т = 1500 К запишем
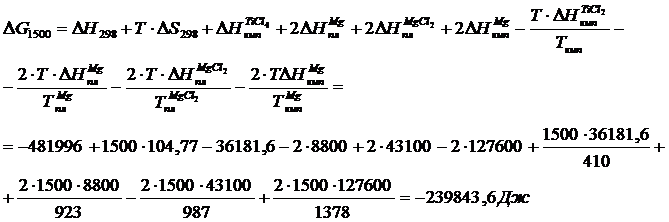
б) Метод Темкина–Шварцмана
В этом случае считаются заданными степенные ряды теплоемкости:
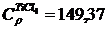
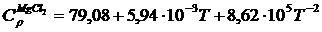
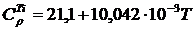

Воспользовавшись этими рядами и формулами (1.12…1.15), найдем:
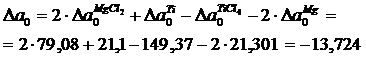
Аналогично находим
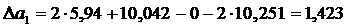

Вычисляем М0, М1, М2, М–2 для Т = 410 К и, подставляя в формулу (1.16) значение 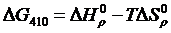 вычисленное ранее, получим
вычисленное ранее, получим
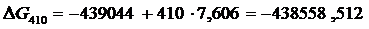
Аналогично можно вычислить потенциалы для любой температуры. Отметим, что уточненный потенциал, полученный методом Темвина-Шварцмана, равен
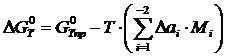
где 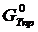 – потенциал, вычисленный приближенно при условии
– потенциал, вычисленный приближенно при условии  .
.
Пример расчета реакции восстановления
(практическое задание №2)
Постановка задачи.
Рассчитать равновесные составы газовой фазы в реакциях восстановления оксидов железа водородом при температуре Т =1473 К и давлении Р = 1.
Решение. Реакции восстановления оксидов железа водородом представлены выие (2.11…2.14). По приведенным потенциалам (уравнения 2.15…2.18) определим константы равновесия, воспользовавшись соотношением (2.10).
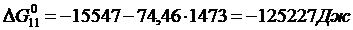
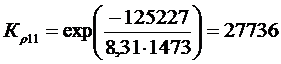

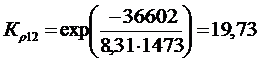
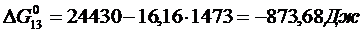
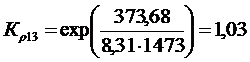
По аналогии с (2.21) для H2запишем
 (2.27)
(2.27)
Подставив константы равновесия в (2.25) и (2.26), получим следующие значения концентрации компонентов:
 (реакция 2.11)
(реакция 2.11)
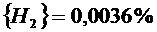
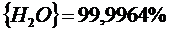
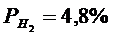

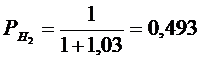 (реакция 2.13)
(реакция 2.13)
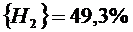
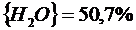
Примеры расчета
(практическое задание №3)
Постановка задачи 1. Определить направление реакции взаимодействия (3.1) при Т = 2273 К при исходном составе газовой фазы 70 % СО2, 20 % СО и 10 % О2. Найти константу равновесия при Р = 1.
Решение.
По уравнению (3.18) определили D G, учитывая (3.3)
 (3.19)
(3.19)

Так как D G < 0, то реакция идет в сторону образования СО 2 с горением СО.
Константа равновесия определятся как
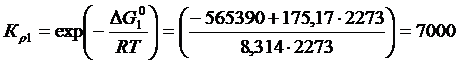
Постановка задачи 2. Определить равновесный состав газовой фазы, образующейся в результате диссоциации СО 2 при Т = 2273 К и Р = 1. Определить кислородный потенциал газовой фазы.
Решение.
Реакция имеет вид (3.1). Задача сводится к определению парциальных давлений (3.9…3.11). Однако предварительно вычислив a (степень диссоциации), воспользовавшись (3.13) и значением константы равновесия, вычисленной из предыдущей задачи, получим:

Подставляя a в(3.9…3.11), получим следующие парциальные давления:
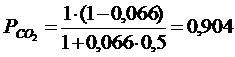


Таким образом, состав газовой фазы будет следующим:
90,4 % СО 2 + 6,4 % СО +3,2 % О 2
Кислородный потенциал газовой фазы рассчитываем с помощью (3.14)

Номера теоретических заданий на контрольную работу
| № вар. | Номер вопроса | № вар. | Номер вопроса |
| 1, 19, 37 | 10, 28, 46 | ||
| 2, 20, 38 | 11, 29, 47 | ||
| 3, 21, 39 | 12, 30, 48 | ||
| 4, 22, 40 | 13, 31, 49 | ||
| 5, 23, 41 | 14, 32, 50 | ||
| 6, 24, 42 | 15, 33, 51 | ||
| 7, 25, 43 | 16, 34, 52 | ||
| 8, 26, 44 | 17, 35, 53 | ||
| 9, 27, 45 | 18, 36, 54 |
Контрольные вопросы
1. Понятие о системе, фазах, процессе; термодинамические параметры как факторы, определяющие состояние системы.
2. Внутреняя энергия и энтальпия как функции состояния; математическое выражение парного закона термодинамики, его формулировки.
3. Работа расширения идеальных газов; изобарный, изотермический, адиабатный, изохорный процессы.
4. Закон Гесса; тепловые эффекты химических реакций и зависимость их от темпераптуры; определение тепловых эффектов методом колориметра.
5. Теплоемкость; зависимость теплоемкости от температуры; уравнение (закон) Кирхгофа.
6. Сущность второго закона термодинамики; его формулировки; возможность и направление самопроизвольного протекания процессов.
7. Формулировки второго закона термодинамики; энтропия как функция состояния системы.
8. Характеристические функции и термодинамические потенциалы: изохорно-изотермический потенциал (энергия Гельмгольца) и изобарно-изотермический потенциал (энергия Гиббса).
9. Равновесное состояние системы; устойчивое или истинное равновесие: влияние внешних условий на равновесие.
10. Общее условие фазовых равновесий; правило фаз.
11. Химический потенциал и активность; условие перехода вещества, содержащегося в система, из одной фазы в другую.
12. Равновесные соотношения при фазовых переходах; уравнение Клаузиуса-Клайперона.
13. Закон действия масс; константы равновесия химических реакций; методы расчета констант равновесия.
14. Принцип подвижного равновесия; влияние внешнего воздействия на направление смещения равновесия.
15. Тепловая теорема Нернста.
16. Уравнение изотермы, изобары, изохоры химической реакции; мера химического сродства.
17. Способы выражения состава растворов; разбавленные растворы; закон Рауля.
18. Температура кипения и кристаллизации разбавленных растворов; Термодинамическая летучесть.
19. Концентрированные растворы; свойства концентрированных растворов.
20. Газы в растворах; зависимость между растворимостью газа и температурой; закон Генри.
21. Кинетика химических реакций; зависимость скорости реакций от концентрации реагирующих веществ.
22. Кинетическая классификация химических реакций; молекулярность реакции, порядок реакции.
23. Влияние температуры на скорость реакций; энергия активации.
24. Классификация металлургических процессов; общие термодинамические особенности процессов плавленая.
25. Характеристика физико-химических процессов, протекающих в плавильных печах при плавке литейных сплавов.
26. Температура, давление и состав газовой атмосферы в печах; изменение условий плавки в разные периоды процесса.
27. Факторы, определяющие взаимодействие металлов друг с другом и с немeталлами (металлохимические свойства элементов).
28. Термодинамика и кинетика реакций в системе.
29. Механизм и кинетика процессов горения в однофазной и многофазной системах.
30. Кинетика горения твердого углерода; стадии процесса; способы интенсификации процессов горения при слоевом сжигании топлива.
31. Диссоциация карбонатов; упругость диссоциации; изменение упругости диссоциай в зависимости от температуры.
32. Диссоциация углеводородов и сульфидов; упругость диссоциации; изменение упругости диссоциации в зависимости от температуры.
33. Механизм и кинетика процессов диссоциации; топохимические превращения.
34. Диссоциация окислов; уравнение Вант-Гоффа; ряд металлов по их сродству к кислороду.
35. Основы теории восстановительной плавки; общая характеристика восстановителько-окислительных реакций.
36. Восстановление окислов железа окисью углерода и водородом.
37. Процессы восстановления в присутствии твердого углерода.
38. Газовое науглероживание в процессе восстановления железа окисью углерода; влияние состава газовой атмосферы на восстановительные процессы при плавке литейных сплавов.
39. Шлаки в металлургических процессах; состав и физико-химические характеристики шлаков и их компонентов.
40. Теории строения шлаковых расплавов.
41. Химические и физические свойстве шлаков.
42. Взаимодействие шлаковых и металлургических расплавов; закон распределения.
43. Окислительные и восстановительные шлаки и их роль в процессах плавки металлов и сплавов.
44. Регулирование состава и свойств шлаков с помощью флюсов; требования, предъявляемые к флюсам.
45. Значение свойств шлаков в процессах плавки металлов и сплавов; взаимодействие шлаков с футеровкой печи.
46. Основы теории окислительной плавки; передача кислорода от газовой фазы к расплаву при плавке стали.
47. Процессы окисления примесей в расплаве металла; упругость диссоциации окислов кремния, марганца и углерода в растворе железа в зависимости от температуры расплава и концентрации примесей.
48. Термодинамика и кинетика окисления кремния, марганца и углерода при плавке стали.
49. Интенсификация окислительных процессов; применение кислорода при плавке металлов и сплавов.
50. Удаление серы и фосфора при плавке чугуна и ст
|
|
|

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!