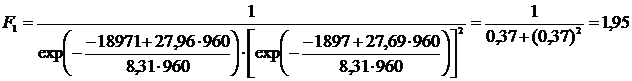(практическое задание №4)
Цель работы: расчет термодинамической температуры восстановлений оксида, твердим, углеродом.
Важнейшую роль в металлургических процессах играют реакции восстановления оксидов твердым углеродом типа
MеО + C = Mе + CО (4.1)
Байковым А.А. предложена схема реагирования, по которой прямое восстановление является суммой реакций косвенного восстановления и газификации углерода:
MeО + CО = Ме + СО2 (4.2)
СО2 + С = 2СО (4.3)
МеО + С = Ме + СО (4.4)
Течение реакций (4.1) и (4.2) происходит в различных температурных областях. Одновременное течение реакций возможно только начиная с температуры, называемой температурой прямого восстановления оксидов твердым углеродом.
Температуру прямого восстановления можно определить графически, задавая значения общего давления и температуры и рассчитывая парциальные давления СО2 и СО реакции (4.2) по температурной функции констант равновесия.
При тех же значениях Р и Т рассчитываются равновесные парциальные давления компонентов газовой фазы реакции (4.3). Построив графически температурные зависимости равновесных составов газовой фазы с оксидом и углеродом, можно найти точку пересечения, дающую начало прямого восстановления оксида твердым углеродом.
Математическая модель для нахождения температуры прямого восстановления имеет вид:
 – реакция (4.2) – реакция (4.2)
|
 (4.5)
(4.5)
|
 – реакция (4.3) – реакция (4.3)
|
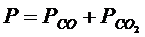
где К Р1, К Р2 – константы равновесия, которые находят из потенциала  ; Р – общее давление в газовой фазе.
; Р – общее давление в газовой фазе.
Исключим 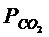 из системы (4.5), использовав уравнение (4.3).
из системы (4.5), использовав уравнение (4.3).
Учитывая, что  , перепишем (4.6).
, перепишем (4.6).
где DG1 – изменение энергии Гиббса реакции (4.2); DG2 – изменение энергии Гиббса реакции (4.3).
Найдем Р СО из 1-го уравнения системы (4.7).
 (4.8)
(4.8)
 (4.9)
(4.9)
Полученное уравнение (4.9) подставим в уравнение 2 системы (4.7)

После преобразования получим
 (4.10)
(4.10)
Уравнение (4.10) является трансцендентным. Традиционно такие уравнения решают графически, строя график кривой правой и левой частей уравнения, задавая при этом Р, D G 1, D G 2.
Для реакции (4.3) термодинамический потенциал имеет вид:
D G 2 =+172118,9 – 177,431 Дж (4.11)
Таким образом, при заданном потенциале реакции (4.2) проблема нахождения температуры восстановления сводится к решению уравнения (4.10), если задан потенциал D G 2.
Приближенно для построения потенциала реакций косвенного восстановления пользуются формулой
 (4.12)
(4.12)
где 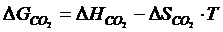 (
( = – 393941;
= – 393941; 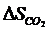 = 1,55)
= 1,55)
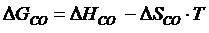 (
( = – 110375;
= – 110375;  = 90,20)
= 90,20)
 – изменение энергии Гиббса реакции образования оксида (данные берутся из таблиц).
– изменение энергии Гиббса реакции образования оксида (данные берутся из таблиц).
Пример расчета температуры восстановления FeO твердым углеродом
(практическое задание №4)
Постановка задачи. Приближенно оценить температуру восстановления FeO твердым углеродом при давлении Р = 1.
Решение. Схема А.А. Байкова имеет вид:
 FeO + CO = Fe + CO 2
CO 2 + C = 2 CO FeO + CO = Fe + CO 2
CO 2 + C = 2 CO
|
| FeO + C = Fe + CO
|
а) определим изменение энтальпии и энтропии для FeO, воспользовавшись таблицами.
D Н = – 264, 594 кДж/моль; D S =60,690 Дж/моль×град;
б) определим изменение потенциала Гиббса DG1 для реакции типа (4.2) по формуле (4.12).
DG1 = (–39340 + 110375 + 264,594) – (1,53 – 90,20 + 60,69)× Т =
= – 10971+27,96× Т.
в) вычислим левую часть уравнения (4.10) для Т = 960.
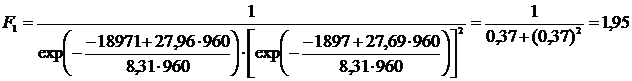
г) вычислим правую часть уравнения (4.10) для Т = 960.

Аналогично вычислим правые и левые части уравнения (4.6.10) для других температур.
| Т
|
|
|
|
|
|
|
|
| F 1
| 1,04
| 1,59
| 1,95
| 2,07
| 2,13
| 2,2
| 2,51
|
| F 2
| 0,01
| 0,19
| 0,80
| 1,24
| 1,54
| 2,23
| 5,09
|
| Рис. 4.1. Функции уравнения (4.10) для реакции восстановления FeO
| 
|





 – реакция (4.2)
– реакция (4.2)
 (4.5)
(4.5)
 – реакция (4.3)
– реакция (4.3)
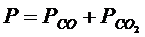
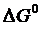 ; Р – общее давление в газовой фазе.
; Р – общее давление в газовой фазе.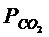 из системы (4.5), использовав уравнение (4.3).
из системы (4.5), использовав уравнение (4.3).
 (4.6)
(4.6)
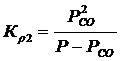
 , перепишем (4.6).
, перепишем (4.6).
 (4.7)
(4.7)

 (4.8)
(4.8) (4.9)
(4.9)
 (4.10)
(4.10) (4.12)
(4.12)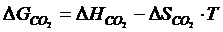 (
( = – 393941;
= – 393941; 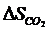 = 1,55)
= 1,55)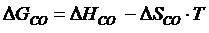 (
( = – 110375;
= – 110375;  = 90,20)
= 90,20) – изменение энергии Гиббса реакции образования оксида (данные берутся из таблиц).
– изменение энергии Гиббса реакции образования оксида (данные берутся из таблиц). FeO + CO = Fe + CO 2
CO 2 + C = 2 CO
FeO + CO = Fe + CO 2
CO 2 + C = 2 CO