Терминология в ФХ.
Фармакологическое средство – вещество (или смесь веществ) природного или синтетического происхождения с установленной фармакологической активностью, которое является объектом клинических испытаний. ЛС - фармакологическое средство, разрешенное для применения уполномоченным на это государственным органом в целях лечения, предупреждения или диагностики заболеваний человека и животных. ЛВ – индивидуальное химическое соединение, полученное синтетически или выделенное из лекарственного сырья и используемое в качестве ЛС. Следует подчеркнуть, что к ЛС относятся только синтетические соединения или подвергнутые специальной обработке объекты природного происхождения. Фармацевтические субстанции - лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность. Лекарственная форма (ЛФ) –удобное для применения ЛС состояние, специально придаваемое ему для достижения необходимого терапевтического действия (таблетки, порошки, капсулы, драже, пилюли, растворы, мази, гели, аэрозоли и т. д.). Лекарственным препаратом (ЛП) – называют ЛС в виде определенной ЛФ, готовой к употреблению. Лекарственный препарат представляет собой активную субстанцию (действующее вещество) с добавлением различных компонентов и вспомогательных веществ (растворитель, другие ЛС, красители, адсорбенты, вкусовые добавки и т. д.).
Различают следующие ЛП: галеновы (отвары); неогаленовы (или новогаленовы), которые в отличие от галеновых биологически стандартизированные; пролонгироованного действия, или дюрантные (обладающие более продолжительным терапевтическим действием); радиоактивные, или радиофармацевтические (содержащие радиоактивные изотопы элементов для диагностики и лучевой терапии); стандартные – вещества с точно измеренными физическими, химическими, биологическими параметрами, предназначенные для оценки биоэквивалентности ЛС. Любые ЛП, качество которых регламентируется Государственной Фармакопеей, называются официнальными. Помимо ЛП, продуктами фармацевтической промышленности являются парафармацевтические препараты: синтетические и природные полимеры медицинского назначения, перевязочные и шовные материалы, адсорбенты, наполнители, БАД к пище, пищевые и красящие добавки, лечебная косметика.
Гомеопатическое ЛС - лекарственное средство, производимое или изготавливаемое по специальной технологии из гомеопатического сырья.
Оригинальное ЛС - лекарственное средство, отличающееся от всех ранее зарегистрированных лекарственных средств фармакологически активным веществом или комбинацией таких веществ. Генерическое ЛС - лекарственное средство, содержащее ту же фармацевтическую субстанцию или комбинацию фармацевтических субстанций в той же лекарственной форме, что и оригинальное лекарственное средство, эквивалентное оригинальному лекарственному средству и терапевтически взаимозаменяемое с ним.
Иммунобиологическое ЛС - лекарственное средство, предназначенное для иммунологической профилактики, диагностики и лечения.
Стабильность и сроки годности лекарственных средств. Терминология: стабильность, срок годности лекарственных средств, дата переконтроля и период переконтроля субстанций для фармацевтического использования.
Критерием стабильности служит сохранение качества ЛС. Снижение колич-го содержания фармакологически активного в-ва в ЛС подтверждает его нестабильность. Этот процесс характеризуется константой скорости разложения ЛС. Уменьшение кол-ного содержания не должно сопровождаться образованием токсичных продуктов или изменением физико-химических св-тв ЛС. Под сроком годности ЛС понимают период вр., в течение кот. они должны полностью сохранять свою терапевтическую активность, безвредность и по уровню кач-ых и кол-ных характеристик соответствовать треб. ГФ или ФС, в соответствии с кот. были выпущены и хранились в условиях, предусмотренных указанными статьями. По истечении срока годности ЛС не может быть использовано без переконтроля качества и соответствующего изменения установленного срока годности. Из физических факторов наибольшее влияние на стабильность лекарств оказывают свет,влажность, углекислый газ, кислород и примеси. Особенно велика роль температурного режима. С повышением температуры резко возрастает скорость хим. реакций. Даже если принять температурный коэффициент равным 2, то скорость реакции при нагревании реагирующих веществ от 20 до 100°С возрастет в 256 раз. Снижение температуры оказывает различное воздействие на ЛС. Свет. Воздействие света ускоряет разложение. Сухие кристаллические в-ва более устойчивы к свету, чем р-ры. Гигроскопичные в-ва после растворения в кристаллизационной воде повышают светочувствительность. Возд. света усиливается в присутствии катализаторов, кот. активизируют хим. процессы. При хранении на свету некоторых ЛС, особенно относящихся к фенолам, аминам, сульфаниламидам, происходит изменение окраски, формы кристаллов. Др. на свету сохраняются лучше, чем в темноте. ЛС, содержащие соли железа стабильны и повышают устойчивость к свету других ЛС. Влажность воздуха — снижает стабильность ЛС. Пониженная влажность воздуха, повышенная температура уменьшают содерж. кристаллизационной воды в ЛС. Это приводит к росту концентрации ЛС, а также к изменениям физ. св-в (формы кристаллов, растворимости). Повышенная влажность воздуха влияет на физ. св-ва гигроскопичных ЛС. В результате могут измениться внешний вид, окраска, концентрация. Вследствие этих процессов образуются продукты разложения и снижается фарм. активность. Основным фактором, вызывающим окисление, является кислород, содерж. в воздухе. Процесс окисления заметно активизируется при повышенной температуре и влажности, ультрафиолетовом облучении. Система мер, направленных на предохранение ЛС от окисления, сводится прежде всего к уменьшению влияния атмосферного кислорода или максимальному удалению примесей, катализирующих процесс окисления. Защиты от воздействия света требуют нитраты, нитриты, кислородсодержащие производные галогенов, нитро- и нитрозосоединения, фенолы, амиды и аминососдинения, производные фенотиазина, кортикостероиды, витамины, антибиотики, эфирные и жирные масла, а также галеновые и органопрепараты. Под возд. света эти ЛС окисляются с образ. разл-х в-в, отличающихся по фарм. активности. Защиты от воздействия влаги требуют гигроскопичные и гидролизующиеся, легко окисляющиеся ЛС, например соли азотной, азотистой, фосфорной и галогеноводородной кислот, калия ацетат, ряд алкалоидов, гликозидов, ферментов, антиб-ков, сухие органопрепараты. Следует предохранять от возд. влаги также ЛС, очень легко рас-мые в воде, и те, влагосодержание кот. регламентировано определенными пределами ГФ (ФС, ФСП). Защита от возд. атмосферных паров воды достигается при хранении в сухом прохладном месте, в плотно укупоренной таре из влагонепроницаемых материалов (стекла, металла, алюминиевой фольги). ЛС с выраженными гигроскопичными св-ми (кальция хлорид, калия хлорид.) следует хранить в стеклянной таре, укупор. герметично и с залитой парафином пробкой. Ряд ЛС может улетучиваться при хранении (йод, йодоформ, камфора, бромкамфора, ментол, тимол, хлоралгидрат, метил салицилат). Их следует хран. в прохл. месте в герметически укупор. и непроницаемой для улетучивающихся в-в таре.
Общая фармакопейная статья ГФ «реакции подлинности на ионы и функциональные группы». Реакции идентификации неорганических катионов: алюминий, аммония соли, аммония соли и соли летуч оснований, висмут, железо, калий, кальций.
На алюминий: реактив тиоацетамид плюс раствор натрия гидроксида разведенный образуется гелеобразный белый осадок, растворяющийся при последующем прибавлении раствора натрия гидроксида разведенного. К полученному раствору постепенно прибавляют раствор аммония хлорида, вновь образуется гелеобразный белый осадок.
На аммония соли: К испытуемому раствору доб-т магний оксида. Через жидкость пропускают воздух и выходящий воздух направляют в смесь раствора кислоты хлористоводородной и раствора метилового красного, окраска индикатора переходит в желтую. Затем прибавляют свежеприготовленный раствор натрия кобальтинитрита; образуется желтый осадок.
НА АММОНИЯ СОЛИ И СОЛИ ЛЕТУЧИХ ОСНОВАНИЙ: к раствору аммония прибавляют раствор натрия гидроксида. При нагревании раствора выделяются пары аммиака, которые обнаруживаются по запаху и щелочной реакции.
На висмут: с сульфидом натрия или сероводородом выпадает коричневый осадок.

На железо: а) к раствору соли железа (11) прибавляют 1 мл раствора калия феррицианида, образуется синий осадок.

b) к раствору соли Fe3+ прибавляют раствор калия тиоционата, появляется красное окрашивание. Отбирают две порции полученногораствора. К одной порции прибавляют спирт изоамиловый, встряхивают и оставляют до расслоения; органический слойокрашивается в розовый цвет. К другой порции прибавляют раствор ртути (II) хлорида Р; красное окрашивание раствора исчезает.
с) к раствору соли железа (111) прибавляют 1 мл раствора калия феррицианида, образуется синий осадок.
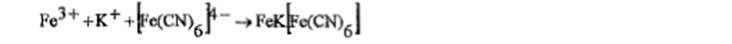
На калий: а) с раствором винной к-ты: об-ся белый кристаллич осадок

Б) с натрия кобальтинитритом, желт осадок


На кальций: с оксалатом аммония, белый осадок

ЙОДИДЫ
а) Исп. образец растворяют в воде, подкисляют кислотой азотной разведенной, + р-р серебра нитрата  образуется светло-желтый творожистый осадок. К осадку + р-р аммиака; осадок медленно растворяется: KI + AgNO3 → AgI↓+ NaNO3
образуется светло-желтый творожистый осадок. К осадку + р-р аммиака; осадок медленно растворяется: KI + AgNO3 → AgI↓+ NaNO3
b) К р-ру исп. образца + к-ту серную разведенную, р-р калия дихромата, воду, хлороформ, встряхивают  хлороформный слой приобретает фиолетовую или фиолетово-красную окраску.
хлороформный слой приобретает фиолетовую или фиолетово-красную окраску.
6I− + Cr2O72−+ 14H+ →3I2 + 4SO42− + 2Cr3+ + 7H2O; I2 → хлороформ → красно-фиолетовая окраска
с) При нагревании исп. образца с кислотой серной выделяются фиолетовые пары йода:
8I− + SO42−+ 10H+ → 4I2↑+ 4H2O + H2S↑
КАРБОНАТЫ И ГИДРОКАРБОНАТЫ
а) К исп. образцу + воду, к-ту уксусную разведенную. Закрывают пробирку притертой пробкой со стеклянной трубкой, дважды изогнутой под прямым углом  наблюдается бурное выделение пузырьков газа без цвета и запаха. Пробирку осторожно нагревают и пропускают выделяющийся газ через р-р бария гидроксида; образуется белый осадок, растворяющийся при прибавлении избытка HCl: CO32− + 2CH3COOH → 2CH3COO− + H2O + CO2↑
наблюдается бурное выделение пузырьков газа без цвета и запаха. Пробирку осторожно нагревают и пропускают выделяющийся газ через р-р бария гидроксида; образуется белый осадок, растворяющийся при прибавлении избытка HCl: CO32− + 2CH3COOH → 2CH3COO− + H2O + CO2↑
Ca(OH)2 + CO2 → CaCO3↓ + H2O
b) Исп. образец растворяют в воде, + насыщенный р-р магния сульфата  образуется белый осадок (отличие от гидрокарбонатов, р-ры которых образуют осадок только при кипячении смеси):
образуется белый осадок (отличие от гидрокарбонатов, р-ры которых образуют осадок только при кипячении смеси):
4CO32− + 4MgSO4 + 4H2O →3MgCO3∙Mg(OH)2∙3H2O↓+ SO42− + CO2↑
2HCO3− → CO32− + H2O + CO2↑
с) Исп. образец растворяют в воде, + р-р фенолфталеина; появляется красное окрашивание (отличие от гидрокарбонатов, р-ры которых остаются бесцветными).
МЫШЬЯК
а) Р-р исп. образца нагревают на водяной бане с реактивом гипофосфита  образуется коричневый осадок.
образуется коричневый осадок.
b) Мышьяк (III) (арсениты). К р-ру исп. образца + HCl разведенную и р-р натрия сульфида  образуется желтый осадок, нерастворимый в HCl, растворимый в растворе аммиака: AsO33− + 6H+ ⇒ As3+ + 3H2O; 2As3+ + 3S2− ⇒ As2S3↓
образуется желтый осадок, нерастворимый в HCl, растворимый в растворе аммиака: AsO33− + 6H+ ⇒ As3+ + 3H2O; 2As3+ + 3S2− ⇒ As2S3↓
с) Мышьяк (V) (арсенаты). К р-ру исп. образца + р-р аммония хлорида, р-ра аммиака и р-ра магния сульфата  образуется белый кристаллический осадок, растворимый в HCl разведенной (отличие от арсенитов): AsO43− + Mg2+ + NH4+ ⇒ MgNH4AsO4↓
образуется белый кристаллический осадок, растворимый в HCl разведенной (отличие от арсенитов): AsO43− + Mg2+ + NH4+ ⇒ MgNH4AsO4↓
НИТРАТЫ
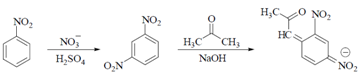
| а) Исп. образец прибавляют к смеси нитробензола кислоты серной, охлаждают в ледяной воде. + воду, р-р натрия гидроксида концентрированного, ацетон и взбалтывают; верхний слой приобретает темно-фиолетовую окраску:
| 
|
b) Р-р исп. образца не обесцвечивает р-р калия перманганата, подкисленный кислотой серной разведенной (отличие от нитритов).
Реакции идентификации неорганических анионов: нитриты, силикаты, сульфаты, сульфиты, фосфаты, хлориды.
НИТРИТЫ
а) Несколько кристаллов антипирина растворяют в фарфоровой чашке в HCl разведенной + р-р исп. образца  появляется зеленое окрашивание: появляется зеленое окрашивание:
| 
|
b) К исп. образцу + H2SO4 разведенную  выделяются желто-бурые пары:
выделяются желто-бурые пары:
2NO2− + H2SO4 →NO↑+NO2↑ + H2O + SO42−
СИЛИКАТЫ
Исп. образец смешивают в свинцовом или платиновом тигле с помощью медной проволоки с натрия фторидом и несколькими каплями H2SO4 до образования суспензии. Тигель накрывают тонкой прозрачной пластиковой пластинкой с висящей каплей воды и осторожно нагревают  вокруг капли воды появляется белое кольцо: 2NaF+ H2SO4 →Na2SO4+2HF
вокруг капли воды появляется белое кольцо: 2NaF+ H2SO4 →Na2SO4+2HF
SiO2+6HF→H2[SiF6] +2H2O
СУЛЬФАТЫ
a) Исп. образец растворяют воде + HCl разведенную и р-р бария хлорида  образуется белый осадок: SO42− + BaCl2 → BaSO4↓ + 2Cl−
образуется белый осадок: SO42− + BaCl2 → BaSO4↓ + 2Cl−
b) К суспензии, полученной в результате реакции (а), прибавляют р-р йода; желтая окраска йода не исчезает (отличие от сульфитов и дитионитов), но обесцвечивается при прибавлении р-ра олова хлорида (отличие от йодатов). Смесь кипятят; осадок не окрашивается (отличие от селенатов и вольфраматов).
СУЛЬФИТЫ
а) К р-ру исп. образца + HCl разведенную и встряхивают; выделяется сернистый газ, обнаруживаемый по характерному резкому запаху: SO32− + 2HCl → 2Cl− + H2O +SO2↑
b) К р-ру исп. образца + р-р йода;  реактив обесцвечивается: SO32− + I2 + H2O → 2HI + SO42−
реактив обесцвечивается: SO32− + I2 + H2O → 2HI + SO42−
ФОСФАТЫ
а) К р-ру исп. образца + р-р серебра нитрата  образуется желтый осадок, цвет которого не изменяется при кипячении и который растворяется при прибавлении раствора аммиака:
образуется желтый осадок, цвет которого не изменяется при кипячении и который растворяется при прибавлении раствора аммиака:
3AgNO3 + PO43− → Ag3PO4↓ + 3NO3−
b) К р-ру исп. образца + молибденованадиевый реактив  появляется желтое окрашивание. Одна из возможных формул продукта взаимодействия фосфата с молибдено-ванадиевым реактивом имеет вид: (NH4)3PO4·NH4VO3∙16MoO3
появляется желтое окрашивание. Одна из возможных формул продукта взаимодействия фосфата с молибдено-ванадиевым реактивом имеет вид: (NH4)3PO4·NH4VO3∙16MoO3
с) К р-ру исп. образца + р-р аммония молибдата, нагревают  образуется желтый кристаллический осадок, растворимый в р-ре аммиака разведенного:
образуется желтый кристаллический осадок, растворимый в р-ре аммиака разведенного:
H3PO4+12(NH4)2MoO4+21HNO3 → (NH4)3PO4∙12 MoO3↓ +21NH4NO3+12H2O
(NH4)3PO412 MoO3 + 23NH4OH→12(NH4)2MoO4 + (NH4)2HPO4+11H2O
d) К р-ру исп. образца + р-р аммония хлорида, р-р аммиака разведенного и р-р магния сульфата  образуется белый кристаллический осадок, растворимый в разведенныхминеральных кислотах: MgSO4 + PO43− + NH4OH
образуется белый кристаллический осадок, растворимый в разведенныхминеральных кислотах: MgSO4 + PO43− + NH4OH 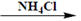 MgNH4PO4↓+SO42−+ H2O.
MgNH4PO4↓+SO42−+ H2O.
ХЛОРИДЫ
а) Исп. образец растворяют в воде, подкисляют кислотой азотной разведенной, + р-р серебра нитрата  образуется белый творожистый осадок, растворимый в р-ре аммиака:
образуется белый творожистый осадок, растворимый в р-ре аммиака:
Cl− + AgNO3 → AgCl↓+ NO3− AgCl + 2NH4OH→[Ag(NH3)2]Cl + 2H2O
b) Исп. образец помещают в пробирку, + калия дихромат и H2SO4. У входного отверстия пробирки помещают фильтровальную бумагу, пропитанную раствором дифенилкарбазида (пропитанная бумага не должна соприкасаться с калия дихроматом)  бумага окрашивается в фиолетово-красный цвет. Реакции идентификации органических анионов: ацетаты, бензоаты, лактаты, салицилаты, тартраты, цитраты
бумага окрашивается в фиолетово-красный цвет. Реакции идентификации органических анионов: ацетаты, бензоаты, лактаты, салицилаты, тартраты, цитраты
АЦЕТАТЫ
a) Исп. образец нагревают с к-той щавелевой  выделяется к-та уксусная, обнаруживаемая по запаху и кислой реакции: СН3СOONa + Н2С2O4→ СН3СOOН+NaH С2O4
выделяется к-та уксусная, обнаруживаемая по запаху и кислой реакции: СН3СOONa + Н2С2O4→ СН3СOOН+NaH С2O4
b) Исп. образец растворяют в воде, + р-р лантана нитрата, р-р йода и р-р аммиака разведенного. Нагревают до кипения  образуется синий осадок или появляется синее окрашивание.
образуется синий осадок или появляется синее окрашивание.
c) К р-ру исп. образца + р-р железа(III) хлорида  появляется красно-бурое окрашивание, исчезающее при прибавлении кислот минеральных разведенных:
появляется красно-бурое окрашивание, исчезающее при прибавлении кислот минеральных разведенных:
3СН3СOONa+FeCl3→(СH3COO)3Fe+3NaCl
d) К р-ру исп. образца + H2SO4 конц. Р и спирт, нагревают  образуется этилацетат, обнаруживаемый по запаху: СН3СOO− + Н+
образуется этилацетат, обнаруживаемый по запаху: СН3СOO− + Н+  СН3СOOН
СН3СOOН
СН3СOOН + С2Н5ОН → СН3СOOC2Н5 +Н2О
БЕНЗОАТЫ
а) К р-ру исп. образца + р-р железа (III) хлорида  образуется розовато-желтый осадок, растворимый в эфире: 3C6H5COO−+2Fe3++3H2O→(C6H5COO)3Fe∙Fe(OH)3↓+3H+
образуется розовато-желтый осадок, растворимый в эфире: 3C6H5COO−+2Fe3++3H2O→(C6H5COO)3Fe∙Fe(OH)3↓+3H+
b) Исп. образец помещают в пробирку + H2SO4, нагревают  на внутренних стенках пробирки появляется белый налет: C6H5COO−+ H2SO4+to→ C6H5COOH↓.
на внутренних стенках пробирки появляется белый налет: C6H5COO−+ H2SO4+to→ C6H5COOH↓.
с) Исп. образец растворяют в воде, + HCl  образуется осадок, имеющий температуру плавления от 120°С до 124°С: C6H5COO−+ HCl→ C6H5COOH↓.
образуется осадок, имеющий температуру плавления от 120°С до 124°С: C6H5COO−+ HCl→ C6H5COOH↓.
ЛАКТАТЫ
Исп. образец растворяют в воде, + бромную воду Р, H2SO4 разведенную и нагревают на водяной бане до обесцвечивания раствора. + р-р аммония сульфата, р-р натрия нитропруссида в H2SO4, р-р аммиака концентрированного  на границе двух жидкостей образуется темно-зеленое кольцо:
на границе двух жидкостей образуется темно-зеленое кольцо:
C3H6O3+Br2/H2O→CH3COCOOH→ to→HCOOH+CH3CHO+Na2[Fe(CN)5(NO)]
САЛИЦИЛАТЫ
а) К р-ру исп. образца + р-р железа (III) хлорида  появляется фиолетовое окрашивание, которое не исчезает после прибавления кислоты уксусной, но исчезает при прибавлении HCl разведенной; при этом образуется белый кристаллический осадок салициловой кислоты:
появляется фиолетовое окрашивание, которое не исчезает после прибавления кислоты уксусной, но исчезает при прибавлении HCl разведенной; при этом образуется белый кристаллический осадок салициловой кислоты:
 + FeCl3→ фиолет. окраш.
+ FeCl3→ фиолет. окраш.  + HCl →
+ HCl → 
b) Исп. образец растворяют в воде, + HCl  образуется белый кристаллический осадок с температурой плавления от 156°С до 161°С.
образуется белый кристаллический осадок с температурой плавления от 156°С до 161°С.
ТАРТРАТЫ
а) Исп. образец растворяют в воде, + р-р железа (II) сульфата и р-р пероксида водорода разведенного  появляется неустойчивое желтое окрашивание. После обесцвечивания р-ра + р-р натрия гидроксида разведенный
появляется неустойчивое желтое окрашивание. После обесцвечивания р-ра + р-р натрия гидроксида разведенный  появляется интенсивное синее окрашивание.
появляется интенсивное синее окрашивание.
b) К р-ру исп. образца + р-р калия бромида, р-р резорцина, H2SO4  появляется темно-синееокрашивание. После охлаждения + воду; окраска р-ра изменяется на красную.
появляется темно-синееокрашивание. После охлаждения + воду; окраска р-ра изменяется на красную.
ЦИТРАТЫ
а) Исп. образец растворяют в воде, + H2SO4 и р-р калия перманганата, нагревают до обесцвечивания, + р-р натрия нитропруссида в H2SO4, к-ты сульфаминовой, р-р аммиака концентрированный до рН 7,0. Прибавление избытка р-ра аммиака концентрированногоР приводит к появлению фиолетового окрашивания, переходящего в фиолетово-синее.
b) К р-ру исп. образца + р-р кальция хлорида; р-р остаётся прозрачным; при кипячении раствора образуется белый осадок, растворимый в HCl разведенной:
−ООССН2 −С(ОН)(СОО−)−СН2СОО−+2Ca2+→(−ООССН2 −С(ОН)(СОО−)−СН2СОО−)2Ca
с) К исп. образцу + ангидрида уксусногоР и нагревают  появляется красное окрашивание.
появляется красное окрашивание.
АЦЕТИЛ
Исп. образец помещают в пробирку, прибавляют к-ту фосфорную. Пробирку закрывают пробкой, через которую пропущена небольшая пробирка, содержащая воду и выполняющая роль холодильника. На внешнюю поверхность меньшей пробирки помещяют 1 каплю раствора лантана нитрата. Если субстанция относительно легко гидролизуется, устройство помещают в водяную баню, затем вынимают меньшую пробирку. Для трудно гидролизуемых субстанций смесь медленно нагревают на открытом пламени до кипения. Каплю снимают, смешивают на фарфоровой пластинке с раствором йода. На край капли наносят р-р аммиака разведённого  в месте соединения двух капель появляется синее окрашивание, которое усиливается и сохраняется в течение короткого промежутка времени. На первом этапе реакции происходит гидролиз с образованием уксусной кислоты и далее реакция протекает также как и реакция b на ацетаты: 2CH3COO–R + H+ → 2CH3COOH + H–R
в месте соединения двух капель появляется синее окрашивание, которое усиливается и сохраняется в течение короткого промежутка времени. На первом этапе реакции происходит гидролиз с образованием уксусной кислоты и далее реакция протекает также как и реакция b на ацетаты: 2CH3COO–R + H+ → 2CH3COOH + H–R
ЭФИРЫ СЛОЖНЫЕ
К исп. образцу + р-р гидроксиламина гидрохлорида в метаноле, р-р калия гидроксида в спирте, нагревают при взбалтывании и охлаждают. Полученный р-р подкисляют HCl разведенной, прибавляют р-р железа (III) хлорида, разбавленного в 10 раз  появляется синевато-красное или красное окрашивание.
появляется синевато-красное или красное окрашивание.
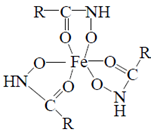 Реакции идентификации алкалоидов, барбитуратов (за исключением N-замещенных), ксантинов.
Реакции идентификации алкалоидов, барбитуратов (за исключением N-замещенных), ксантинов.
АЛКАЛОИДЫ
Исп. образец растворяют в воде +, прибавляют HCl разведенную до кислой реакции раствора, затем + р-р калия йодвисмутата  оранжевый или оранжево-красный осадок. В ходе реакции образуется соединение с общей формулой: (Алкалоид)+(BiI4)−.
оранжевый или оранжево-красный осадок. В ходе реакции образуется соединение с общей формулой: (Алкалоид)+(BiI4)−.
КСАНТИНЫ
К исп. образцу + р-р пероксида водорода концентрированного, HCl разведенной и упаривают на водяной бане до получения сухого желтовато-красного остатка. К остатку прибавляют р-р аммиака разведенного  цвет остатка изменяется на фиолетово-красный.
цвет остатка изменяется на фиолетово-красный.


Рисунок 2.4.5.-1. Прибор для испытания на фториды Размеры указаны в миллиметрах
МАГНИЙ К 10 мл раствора испытуемого образца, приготовленного, как указано в частной статье, прибавляют 0,1 г динатрия тетрабората Р. Определяют рН раствора и при необходимости доводят до рН 8,8-9,2, используя кислоту хлористоводородную разведенную Р или раствор натрия гидроксида разведенный Р. Раствор помещают в делительную воронку, встряхивают в течение 1 мин с двумя порциями, по 5 мл каждая, раствора 1 г/л гидроксихинолина Р в хлороформе Р, оставляют до расслоения и отбрасывают органический слой. К водному слою прибавляют 0,4 мл бутиламина Р и 0,1 мл триэтаноламина Р. Определяют рН раствора и при необходимости доводят до рН 10,5-11,5. Прибавляют 4 мл раствора 1 г/л гидроксихинолина Р в хлороформе Р, встряхивают в течении 1 мин, оставляют до расслоения, нижний слой отбирают и используют для испытания. Параллельно с теми же количествами реактивов и в этих же условиях готовят эталон, используя вместо 10 мл раствора испытуемого вещества смесь1 мл эталонного раствора магния (10 ррт Mg) Р и 9 мл воды Р.Окраска испытуемого раствора должна быть не интенсивнее окраски эталона. МАГНИЙ И ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ К 200 мл воды Р прибавляют 0,1 г гидроксиламина гидрохлорида Р, 10 мл амиачного буферного раствора рН 10,0 Р, 1 мл 0,1 М раствора цинка сульфата и около 15 мг индикаторной смеси протравного черного 11 P. Нагревают до температуры около 40°С. Полученный раствор титруют 0,01 М раствором натрия эдетата до перехода окраски раствора от фиолетовой к синей. К полученному раствору прибавляют указанное в частной статье количество испытуемого вещества, растворенное в 100 мл воды Р, или используют указанный в частной статье раствор. Если окраска раствора становится фиолетовой, снова титруют до перехода окраски раствора к синей. Объем 0,01 М раствора натрия эдетата, израсходованный на второе титрование, не должен превышать объем титранта, указанный в частной статье.
91. Общая фармакопейная статья ГФ РБ «Испытания на предельное содержание примесей»: тяжелые металлы, железо, фосфаты, калий, сульфаты, алюминий.
ТЯЖЕЛЫЕ МЕТАЛЛЫ МЕТОД А
К водному р-ру, указанного в частной статье, прибавляют буферный р-р рН 3,5 и перемешивают. Полученную смесь прибавляют к тиоацетамидному реактиву и немедленно перемешивают.
Параллельно готовят эталон, используя вместо исп. р-ра смесь эталонного р-ра свинца и исп. р-ра. Готовят контрольный р-р, используя смесь воды и исп. р-ра. Через 2 мин коричневая окраска исп. р-ра должна быть не интенсивнее окраски эталона.
ЖЕЛЕЗО
Исп. Образец растворяют в воде, + р-р кислоты лимонной и кислоты тиогликолевой. Перемешивают, подщелачивают р-ром аммиака.
Параллельно готовят эталон, используя эталонный р-р железа (III). Через 5 мин р озовая окраска исп. р-ра должна быть не интенсивнее окраски эталона.
ФОСФАТЫ
К исп. р-ру + сульфомолибденовый реактив. Встряхивают и + р-р олова (II) хлорида. Параллельно готовят эталон (смесь эталонного р-ра фосфата и воды). Сравнивают окраску каждого р-ра. Окраска исп. р-ра должна быть не интенсивнее окраски эталона.
КАЛИЙ
К исп. р-ру + свежеприготовленный р-р натрия тетрафенилбората. Параллельно в этих же условиях готовят эталон, используя вместо р-ра исп. образца смесь эталонного р-ра калия и воды. Через 5 мин опалесценция исп. р-ра не должна превышать опалесценцию эталона.
СУЛЬФАТЫ
Использоваться вода дистиллированная. К эталонному р-ру сульфата + р-р бария хлорида. Встряхивают и оставляют на 1 мин, затем +исп. р-р и к-ту уксусную.
Параллельно с теми же количествами реактивов и в этих же условиях готовят эталон, используя вместо исп. р-ра эталонный р-р сульфата. Через 5 мин опалесценция исп. р-ра не должна превышать опалесценцию эталона.
АЛЮМИНИЙ
Р-р исп. образца помещают в делительную воронку, встряхивают тремя порциями р-ра гидроксихинолина в хлороформе. Хлороформные слои отделяют и собирают в мерную колбу, доводят объем р-ра хлороформом до метки и перемешивают (исп. р-р).
Эталон и контрольный р-р готовят аналогично, используя указанный в частной статье р-р сравнения.
Измеряют интенсивность флуоресценции исп. р-ра (I1), эталона (I2) и холостого р-ра (I3), используя возбуждающее излучение при длине волны 392 нм и фильтр с полосой пропускания, имеющей максимум при длине волны 518 нм.
Флуоресценция исп. р-ра (I1-I3) не должна превышать флуоресценцию эталона (I2-I3).
МЕТОДИКА
Пробоподготовка 1. Применяют при определении остаточных растворителей в веществах, растворимых в воде. Исходный раствор испытуемого образца (1). 0,250 г испытуемого образца растворяют в воде Р и доводят объем раствора этим же растворителем до 25,0 мл. Пробоподготовка 2. Применяют при определении остаточных растворителей в веществах, нерастворимых в воде. Исходный раствор испытуемого образца (2). 0,250 г испытуемого образца растворяют в N,N-диметилформамиде Р (ДМФ) и доводят объем раствора этим же растворителем до 25,0 мл. Пробоподготовка 3. Применяют при контроле N,N-диметилацетамида и/или N,N-диметилформамида, если известно или допускается, что один или оба растворителя присутствуют в испытуемом образце. Исходный раствор испытуемого образца (3). 0,250 г испытуемого образца растворяют в 1,3-диметил-2-диметил-2-имидазолидоне Р (ДМИ) и доводят объем раствора этим же растворителем до 25,0 мл.
Раствор остаточного растворителя. 1,0 мл ФСО раствора остаточного растворителя класса 1 доводят водой Р до 100,0 мл. 1,0 мл полученного раствора доводят водой Р до 10,0 мл. Раствор остаточных растворителей (b). Соответствующие количества остаточных растворителей класса 2 растворяют в диметилформамиде Р и доводят объем водой Р до 100,0 мл. Объем полученного раствора доводят водой Р до указанной в таблице концентрации, соответствующей 1/20 значений пределов концентраций. Раствор остаточных растворителей (с). 1,00 г растворителя или растворителей, присутствующих в испытуемом образце, растворяют в диметилсульфоксиде Р или в воде Р и доводят объем раствора водой Р до соответствующей концентрации,
Растворы сравнения. Раствор остаточного растворителя и подходящего растворителя помещают во флакон. Флаконы плотно закрывают резиновыми пробками, покрытыми политетрафторэтиленом, и обжимают алюминиевыми колпачками. Встряхивают до получения однородного раствора.
Холостой раствор (контроль). Готовят аналогично раствору остаточных Растворителей (с), но без добавления остаточных растворителей (используют для проверки отсутствия мешающих пиков).
Испытуемый раствор. 5,0 мл исходного раствора испытуемого образца, подготовленного в соответствии с методикой пробоподготовки, и 1,0 мл холостого раствора помещают во флакон. Проводят хроматографический анализ.
Определение микробиологической чистоты фармацевтических субстанций. МИКРОБИОЛОГИЧЕСКИЕ ИСПЫТАНИЯ НЕСТЕРИЛЬНОЙ ПРОДУКЦИИ (СУММАРНОЕ КОЛИЧЕСТВО ЖИЗНЕСПОСОБНЫХ АЭРОБОВ) Испытания, описанные ниже, позволяют осуществлять количественное определение мезофильных бактерий и грибов, способных расти в аэробных условиях. Испытания предназначены прежде всего для того, чтобы определить, соответствует ли субстанция требованиям микробиологической чистоты, приведенным в частной статье Выполняют испытания в условиях, позволяющих избежать случайной контаминации испытуемого продукта. Меры предосторожности, предпринимаемые для предотвращения контаминации, не должны влиять ни на один из микроорганизмов, обнаруживаемых в ходе испытания. Если испытуемый продукт обладает антимикробной активностью, она должна быть подходящим образом нейтрализована. Если для этой цели используют инактиваторы, должна быть продемонстрирована их эффективность и нетоксичность в отношении микроорганизмов. Если в связи с природой лекарственного средства нельзя использовать метод мембранной фильтрации, а все вышеперечисленные методы устранения его антимикробного действия в отношении данного тест-штамма не эффективны, этот вид испытания не проводят. Суммарное количество жизнеспособных аэробов определяют методом мембранной фильтрации, чашечным методом подсчета или методом последовательных разведений, в соответствии с указаниями в частной статье. Допускается использование автоматизированных методов испытаний. Метод наиболее вероятного числа предназначен для использования в тех случаях, когда другие методы использовать невозможно. При выборе метода испытания необходимо учитывать природу испытуемого лекарственного средства и ожидаемое количество микроорганизмов. Необходимо надлежащим образом провести проверку пригодности выбранной методики. ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ За общее число бактерий принимают среднее количество колониеобразующих единиц, обнаруженных на агаризованной среде В или среде №1. За общее число грибов принимают среднее количество колониеобразующих единиц, обнаруженных на агаризованной среде С или среде №2. Суммарное количество жизнеспособных аэробов представляет собой сумму числа бактерий и числа грибов, определенных выше. Если имеются доказательства роста на обеих средах микроорганизмов одинаковых типов, могут быть внесены соответствующие поправки. Если подсчет выполнен методом наиболее вероятного числа, то вычисленное значение представляет собой количество бактерий.
МИКРОБИЛОГИЧЕСКИЕ ИСПЫТАНИЯ НЕСТЕРИЛЬНОЙ ПРОДУКЦИИ (ИСПЫТАНИЯ НА НАЛИЧИЕ СПЕЦИФИЧЕСКИХ МИКРООРГАНИЗМОВ) Методики, изложенные в данной статье, допускают использование селективных питательных сред. Если испытуемый продукт обладает антимикробной активностью, она должна быть соответствующим способом нейтрализована. Допускается использование автоматизированных методов испытаний. Для биохимической идентификации микроорганизмов могут быть использованы готовые тест-системы. Энтеробактерии и некоторые другие грамотрицательные бактерии Испытание предназначено для определения бактерий семейства Enterobacteriaceae, но также позволяет определять и другие типы микроорганизмов (например, Aeromonas, Pseudomonas). Все посевы инкубируют при температуре 30 - 35°С в течение 18 – 20 ч. Если в образце обнаружены грамотрицательные неспорообразующие палочки, которые дают отрицательную оксидазную реакцию,ферментируют глюкозу с образованием кислоты (или кислоты и газа) и восстанавливают нитраты в нитриты, лекарственное средство контаминировано бактериями семейства Enterobacteriaceae. Escherichia coli Пересевают на чашки с агаризованной средой Н и инкубируют при 35-370С в течение 18-72 часов. Рост красных, немукоидных колоний грамотрицательных палочек указывает на возможное присутствие E.coli. Для подтверждения проводят соответствующие биохимические тесты, например, по образованию индола. Продукт выдерживает испытание, если подобные колонии не обнаруживаются или подтверждающие биохимические реакции дают отрицательный результат.
Если в образце обнаружены грамотрицательные неспорообразующие палочки, не обладающие ферментом цитохромоксидазой, не утилизирующие цитрат натрия и образующие индол, считают, что лекарственное средство контаминировано E. coli. Salmonella Пересевают не менее чем на две различные агаризованные среды, выбранные из агаризованных сред J, К и L. Инкубируют при 35-370С в течение 18-72 часов. На возможное присутствие сальмонелл указывает рост культур, имеющих следующие характерные признаки: Агаризованная среда J: хорошо развитые бесцветные колонии. Агаризованная среда К: хорошо развитые красные или к







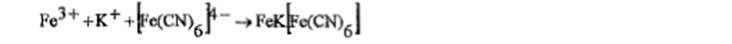




 образуется светло-желтый творожистый осадок. К осадку + р-р аммиака; осадок медленно растворяется: KI + AgNO3 → AgI↓+ NaNO3
образуется светло-желтый творожистый осадок. К осадку + р-р аммиака; осадок медленно растворяется: KI + AgNO3 → AgI↓+ NaNO3 хлороформный слой приобретает фиолетовую или фиолетово-красную окраску.
хлороформный слой приобретает фиолетовую или фиолетово-красную окраску.

 MgNH4PO4↓+SO42−+ H2O.
MgNH4PO4↓+SO42−+ H2O. образуется белый творожистый осадок, растворимый в р-ре аммиака:
образуется белый творожистый осадок, растворимый в р-ре аммиака: СН3СOOН
СН3СOOН + FeCl3→ фиолет. окраш.
+ FeCl3→ фиолет. окраш.  + HCl →
+ HCl → 

 Реакции идентификации алкалоидов, барбитуратов (за исключением N-замещенных), ксантинов.
Реакции идентификации алкалоидов, барбитуратов (за исключением N-замещенных), ксантинов.




