Определяется следующими критериями:
1. Чем ближе аминокислотный состав пищевого белка к аминокислотному составу беков тела, тем выше его биологическая ценность.
2. В составе белка должны быть все незамеимые аминокислоты: вал, илей, лей, лиз, мет, тре, три, фен. Исключение какой-либо незаменимой аминокислоты из пищи сопровождается развитием отрицательного азотистого баланса.
3. В составе белка установлены пропорциональные величины незаменимых аминокислот, относительно триптофана, принятого за единицу, лиз-5, лей-4, вал-3,5.
Недостаток в пище одной незаменимой аминокислоты ведет к неполному усвоению других аминокислот.
Для человека наиболее ценны белки молока, яиц, мяса, т.к. их аминокислотный состав ближе к аминокислотному составу органов и тканей человека.
В результате недостаточного поступления белков в организм возникает синдром квашиоркор. Поражает детей в период отнятия от груди. Нарушение нормального синтеза белка в печени вызывает снижение содержания сыворотного альбумина, что приводит к отеку, снижение содержания ЛОНП приводит к развитию жирового поражения печени. Снижен синтез гемоглобина, в результате развивается анемия. Резко нарушается функция кишечника, т.к. из недостатка аминокислот страдает синтез ферментов поджелудочной железы. Смерть наступает от диареи, острых инфекций и хронических заболеваний печени.
Незаменимые аминокислоты: вал,лей,илей,лиз,мет,тре,три,фен.
Частично заменимые-взрослый организм не нуждается:арг,гис.
Условно заменимые-это цистеин,кот сниж потр в мет на 80%,
Тирозин сниж потр в фен на 70%
В организме человека ежесуточно распадается на аминокислоты около 400 г беков и столько их синтезируется.
Основная функция белков пластическая. Белки могут выполнять энергетическую функцию при избыточном их поступлении с пищей или в экстремальных ситуациях, когда белки тела подвергаются усиленному распаду. Этот процесс наблюдается при голодании или патологии (при сахарном диабете). При сгорании 1 г белков высвобождается 16,8 кДж.
Под термином «резервные» белки понимают не особые отложения белков, а легкомобилизуемые при необходимости тканевые белки, которые после гидролиза под действием тканевых протеиназ дают аминокислоты.
При голодании наблюдается неравномерное изменение массы отдельных органов и тканей.В значительной степени снижается масса печени,мышц,и существенно не меняется масса мозга и сердца.Организм за счет распада белков печени и мышц обеспечивает нормальнуюработу других жизненно важных органов.Т о белки печени,мышц и плазмы крови являются «резервными».Это имеет важное физиологическое значение в экстренных условиях мобилизации ресурсов организма,хотя их резерв отличается от такового у углеводов и жиров.
Незаменимые: VILKMTWF
Гидрофобные: FAMILY WV
Частично: RH
Условно: CY
A - alanin
с - cisteinum
d - aspartatum
e - glutamat
f - fenilalanin
g - glicin
H - histidin
I - isoleucinum
L - leucinum
K - lizin
M - methionin
N - asparaginum
P - prolin
Q - glutamin
R - argininum
S - serin
T - treonin
V - valin
W - triptophanum
Y - thirosinum
Билет 56
Переваривание белков происходит в 3 этапа:
1. в желудке;
2. в тонком кишечнике;
3. в клетках слизистой оболочки тонкого кишечника.
Расщепление белков происходит при участии нескольких групп ферментов:
1. Экзопептидазы – катализирует разрыв концевой пептидной связи с образованием одной какой-либо аминокислоты.
2. Эндопептидазы – гидролизуют пептидные связи внутри полипептидной цепи.
К эндопептидазам относятся следующие ферменты: пепсин, гастрин, трипсин, химотрипсин, эластаза.
К экзопептидазам относятся: карбоксипептидазы, аминопептидазы, дипептидазы.
Экзопептизазы участвуют в переваривании белков в тонком кишечнике.
В результате расщепления образуются свободные аминокислоты, которые затем подвергаются всасыванию. Аминокислоты всасываются свободно с ионами натрия. Некоторые аминокислоты обладают способностью конкурентно тормозить всасывание других аминокислот:
Лизин тормозит всасывание аргинина. Это позволяет считать, что существует общая переносящая система.
Часть аминокислот в кишечнике под действием микрофлоры подвергается гниению. В результате гниения аминокислот в кишечнике образуются ядовитые продукты распада – фенол, индол, крезол, скатол, сероводород. Распад цистеина, цистина, метионина приводит к образованию сероводорода, метилмеркаптана. Диаминокислоты – орнитин и лизин подвергаются декарбоксилированию с образованием путресцина и кадаверина.
Микробные ферменты кишечника превращают тирозин 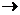 крезол
крезол 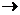 фенол
фенол
триптофан 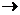 скатол
скатол 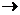 индол.
индол.
После всасывания эти продукты через воротную вену попадают в печень, где обезвреживаются путем связывания с серной или глюкуроновой кислотами с образованием парных кислот, которые выделяются с мочей.






 крезол
крезол 





