1. Синдром Де-Тони-Дебре-Факкони.
Характерна триада: гиперфосфатемия, гиперглюкозурия, гипераминоацедемия. В основе генетически обусловленные нарушения транспорта в почечных канальцах. Развивается вторичный рахит (вследствие потери фосфата и ацидоза).
2. Семейный гипофосфатемический витамин D – резистентный рахит.
Гипофосфатемия и признаки рахита на 1-2 году жизни, не поддается лечению витамином D, низкий рост 150-160 см, костные деформации, псевдоатлет (приземистое телосложение).
Причина: снижение реабсорбции неорганического фосфата в почечных канальцах, понижение всасывания в тонком кишечнике. В основе генетические нарушения в третичной структуре белков в почечных канальцах.
Лечение: фосфаты и соли кальция.
3. Врожденный псевдодефицитный витамин D – зависимый рахит – по клинике сходен с рахитом, но отличается резистентностью к стандартным профилактическим и лечебным дозам витамина D.
Характеризуется гипокальциемией и гипераминоацидурией, нет фосфата.
В основе дефект фермента в почках, обеспечивающего образования 1,25-диокси витамин D2/D3.
Витамин К.
Витамин К является хиноном с боковой изопреноидной цепью. Есть два ряда нафтохинонов – филлохиноны и менохиноны. Разработаны синтетические препараты витамина К – менадион, викасол и синкавит.
Витамин К содержится в основном в растительной пище: шпинат, тыква, капуста, томаты, крапива. Частично синтезируется микрофлорой кишечника.
Всасывается витамин К в тонком кишечнике в присутсвии желчных кислот. Транспорт витамина К происходит с хиломикронами. В плазме крова витамин К связывается с альбумином.
Функции витамина К.
1. Витамин К участвует в образовании факторов свертывающей системы крови: II – протромбина, VII – проконвертина, IX – фактора Кристмаса и X – фактора Стюарта.
2. Витамин К в виде кофермента участвует в микросомальном  - карбоксилировании глутаминовой кислоты (печень), входящей в состав белков, связывающего кальций.
- карбоксилировании глутаминовой кислоты (печень), входящей в состав белков, связывающего кальций.
Протромбин (содержит 10 остатков глу, в отличие от тромбина).

Чтобы протромбин мог активироваться и превратиться в тромбин, он должен связать ионы Са2+. При недостатке витамина К в организме синтезируются дефектные молекулы протромбина, не способные правильно связывать ионы Са2+.
В костях белок – остеокальцин связывает Са2+.
Билет 91
Белки плазмы крови.
Кровь состоит из плазмы и взвешенных в ней форменных элементов. Плазма составляет около 55% от объема крови. Эритроциты составляют основную массу форменных элементов – 44%.
Из 9-10% сухого остатка плазмы крови на болю белков приходится 6,5-8,5%.
Общее содержание белков составляет 60 – 80 г/л.
Для разделения белков плазмы крови используют следующие методы:
- Высаливание.
Разделение белков проводят с использованием солей щелочных и щелочноземельных металлов. Наиболее часто используют сульфат аммония. Различные белки высаливаются из растворов при разных концентрациях растворов сульфата аммония: альбумины выпадают при 100% насыщении, глобулины при 50%.
При действии сульфата аммония, ацетона, спирта белки теряют гидратную оболочку, утрачивают устойчивость и выпадают в осадок.
В результате высаливания получают 2 фракции:
- Альбумины – 40 – 50 г/л
- Глобулины – 20 – 30 г/л
На долю фибриногена приходится – 2 – 4 г/л.
Плазма, лишенная фибриногена, называется сывороткой.
В условиях клинических лабораторий для разделения белков сыворотки крови применяют метод электрофореза.
Сыворотка – плазма, не содержащая фибриноген и др. факторы свертывания (т.е. жидкость, которая остается после формирования сгустка крови).
Высаливание.
Для высаливания применяют соли в разных концентрациях.
При малой концентрации солей осаждаются наиболее крупные, тяжелые и обладающие наименьшим зарядом частицы.
При повышенной концентрации солей выпадают все более мелкие частицы и устойчивые белковые фракции.
При использовании 33%-ного раствора (NH4)2SO4 выпадают белки сыворотки крови, имеющие наибольший молекулярный вес – эйглобулины, при 50%-ной концентрации – псевдоглобулины, при 100%-ной – самые «легкие» альбумины.
Белки, осажденные сульфатом аммония, почти не денатурируются; после удаления соли из белкового осадка (диализом через целлофановую мембрану) ее растворяют и используют для различных целей.
Чтобы лишить высокомолекулярные частицы устойчивости, необходимо удалить их водные оболочки и снять электрический заряд.
При электрофорезе в поддерживающих средах имеет значение размер пор геля (молекулярно-ситовой эффект геля) и размеры молекул белка.
Электрофорез на бумаге.
Сыворотку крови наносят на бумажную полоску, смоченную буфером. Концы бумажной полосы опущены в раствор электролита, где находятся электроды источника постоянного тока. При замыкании электрической цепи белковые молекулы движутся со скоростью. Пропорциональной величине заряда. За единицу времени проходят разные расстояния, т.е. оказываются на разных участках бумажной полосы.
2. Электорфорез основан на передвижении заряженной частицы в электрическом поле.
Белки сыворотки крови различаются по молекулярной массе, заряду и изоэлектрической точке. На основании этих различий белки разделяются в электрическом поле.
В зависимости от условий проведения разделения различают электрофорез на бумаге, в растворе и в геле: крахмала, целлюлозы и полиакриламидном геле.
а) Электрофорез на бумаге позволяет получить 5 белковых фракций: 1. Альбумины. 2. 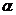 1-глобулины. 3.
1-глобулины. 3. 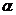 2-глобулины. 4.
2-глобулины. 4. 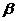 -глобулины. 5.
-глобулины. 5.  -глобулины.
-глобулины.
б) Электрофорез в крахмальном геле позволяет получить 10 фракций.
в) Электрофорез в полиакриламидном геле позволяет получить до 18 фракций.
При электрофорезе в полиакриламидном геле используют пары буферных растворов с различными значениями рН и различной степени пористости гель.
3. Изоэлектрофокусировние – проведение электрофореза в поддерживающих средах с градиентом рН. Нахождение белка определяется его изоэлектрической точкой.
4. Иммунофорез представляет собой комбинацию электрического и иммунологического методов. Происходит электрофорез и реакция преципитации в одной среде.
Иммуноэлектрофорез – сочетание электрофореза в агаровом геле и иммунодиффузии. После электрофоретического разделения белков в канавку, идущую параллельно пути движения антигенов, вносят перциптирующую иммунную сыворотку. Антигены и антитела диффундируют на месте встречи дугообразные полосы преципитации.

Электрофорез основан на способности белков перемещаться в электрическом поле.
Для функционирования белков сыворотки крови чаще всего используют веронал-мединаловый буфер с рН 8,6. При этом значении рН белки заряжаются отрицательно и движутся к аноду.
В связи с различием в размерах молекул и в величине заряда скорость движения белков самые малые и имеющие наибольший заряд альбумины, затем 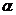 -,
-, 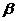 -, и
-, и  -глобулины.
-глобулины.
Скорость передвижения белка в электрическом поле зависит от его электрофоретической подвижности.




 - карбоксилировании глутаминовой кислоты (печень), входящей в состав белков, связывающего кальций.
- карбоксилировании глутаминовой кислоты (печень), входящей в состав белков, связывающего кальций.
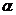 1-глобулины. 3.
1-глобулины. 3. 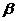 -глобулины. 5.
-глобулины. 5. 




