направления химической реакции
в неравновесных условиях
Цель работы
1. Определить направление химической реакции в условиях, отличных от равновесных.
2. Рассчитать стандартное изменение энергии Гиббса  и константу равновесия при заданной температуре одним из рассмотренных способов при заданной температуре.
и константу равновесия при заданной температуре одним из рассмотренных способов при заданной температуре.
Методика расчета изменения энергии Гиббса
Химической реакции в неравновесных условиях
Уравнение изотермы химической реакции
Константа равновесия определяет условия, когда парциальные давления (концентрации) являются равновесными.
Для определения направления химической реакции, когда парциальные давления (концентрации) исходных продуктов и исходных веществ отличаются от равновесных, используется уравнения изотермы химической реакции для изобарно-изотермического процесса
 (5.1)
(5.1)
и для изохорно-изотермического процесса
 . (5.2)
. (5.2)
где  ,
, 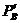 ,
,  ,
,  или
или  ,
, 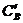 ,
, 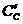 ,
,  – неравновесные парциальные давления или концентрации;
– неравновесные парциальные давления или концентрации;  – константа равновесия химической реакции для данной температуры.
– константа равновесия химической реакции для данной температуры.
Уравнение изотермы химической реакции  по своему абсолютному значению характеризует степень удаленности системы от равновесия, а по знаку – направление реакции. Если
по своему абсолютному значению характеризует степень удаленности системы от равновесия, а по знаку – направление реакции. Если  , значит, реакция идет в прямом направлении. Если
, значит, реакция идет в прямом направлении. Если  , реакция идет в обратном направлении. Если
, реакция идет в обратном направлении. Если  , следовательно, выбранные парциальные давления (концентрации) являются равновесными.
, следовательно, выбранные парциальные давления (концентрации) являются равновесными.
Таким образом, для определения направления химической реакции в неравновесных условиях нужно рассчитать стандартное изменение энергии Гиббса  или константу равновесия
или константу равновесия  химической реакции при заданной температуре и вычислить по уравнению изотермы химической реакции изменение энергии Гиббса этой реакции
химической реакции при заданной температуре и вычислить по уравнению изотермы химической реакции изменение энергии Гиббса этой реакции  при данной температуре и заданных неравновесных парциальных давлениях
при данной температуре и заданных неравновесных парциальных давлениях  ,
, 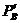 ,
,  ,
,  .
.
Другие методы расчета константы равновесия
Кроме метода стандартных термодинамических величин, для расчета константы равновесия используются методы:
– высокотемпературных составляющих энтальпии и энтропии компонентов;
– значений приведенных энергий Гиббса  компонентов;
компонентов;
– косвенного расчета комбинированием реакций.
Эти методы позволяют более оперативно определить  и
и  химической реакции для заданной температуры.
химической реакции для заданной температуры.
5.2.3. Расчет D rGT и Кр с использованием
Высокотемпературных составляющих энтальпии
И энтропии компонентов
Рассчитаем  и
и  для химической реакции с использованием табличных значений высокотемпературных составляющих (
для химической реакции с использованием табличных значений высокотемпературных составляющих (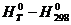 ) и (
) и ( ) или (
) или ( ) и
) и  компонентов реакции.
компонентов реакции.
Высокотемпературные составляющие известны для большинства неорганических соединений, что позволяет определить  или Кр, используя табличные значения высокотемпературных составляющих.
или Кр, используя табличные значения высокотемпературных составляющих.
Эта методика является более простой для определения  или Кр при определенной температуре. Кроме того, в таблицах этих термодинамических величин учтены фазовые превращения, и при определении
или Кр при определенной температуре. Кроме того, в таблицах этих термодинамических величин учтены фазовые превращения, и при определении  или Кр данная методика свободна от осложнений влияния фазовых превращений.
или Кр данная методика свободна от осложнений влияния фазовых превращений.
В этом случае для определения  ,
,  и
и 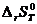 :
:
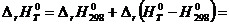
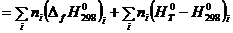 ; (5.3)
; (5.3)
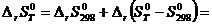
 ; (5.4)
; (5.4)

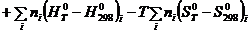 . (5.5)
. (5.5)
Аналогично можно определить  через (
через ( ) и
) и  компонентов реакции.
компонентов реакции.
5.2.4. Пример расчета D rGT и Кр с использованием



 и константу равновесия при заданной температуре одним из рассмотренных способов при заданной температуре.
и константу равновесия при заданной температуре одним из рассмотренных способов при заданной температуре. (5.1)
(5.1) . (5.2)
. (5.2) ,
, 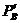 ,
,  ,
,  или
или  ,
, 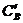 ,
, 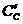 ,
,  – неравновесные парциальные давления или концентрации;
– неравновесные парциальные давления или концентрации;  – константа равновесия химической реакции для данной температуры.
– константа равновесия химической реакции для данной температуры. по своему абсолютному значению характеризует степень удаленности системы от равновесия, а по знаку – направление реакции. Если
по своему абсолютному значению характеризует степень удаленности системы от равновесия, а по знаку – направление реакции. Если  , значит, реакция идет в прямом направлении. Если
, значит, реакция идет в прямом направлении. Если  , реакция идет в обратном направлении. Если
, реакция идет в обратном направлении. Если  , следовательно, выбранные парциальные давления (концентрации) являются равновесными.
, следовательно, выбранные парциальные давления (концентрации) являются равновесными. компонентов;
компонентов;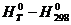 ) и (
) и ( ) или (
) или ( ) и
) и  компонентов реакции.
компонентов реакции. и
и 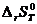 :
: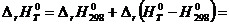
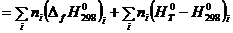 ; (5.3)
; (5.3)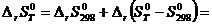
 ; (5.4)
; (5.4)
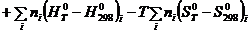 . (5.5)
. (5.5)


