Химического равновесия и направление химической реакции
Цель работы
1. Методика расчета константы равновесия.
2. Определение направления химической реакции.
3. Определение степени завершенности реакции в
состоянии равновесия.
Условия химического равновесия
И направления химической реакции
Энергия Гиббса G определяется соотношением
 , (4.1)
, (4.1)
где H и S – соответственно энтальпия и энтропия системы; Т – температура.
При любом процессе, протекающем самопроизвольно при постоянных давлении и температуре, энергия Гиббса уменьшается, следовательно, условием протекания химической реакции является неравенство
 , (4.2)
, (4.2)
условием химического равновесия:
 . (4.3)
. (4.3)
Отсюда следует, что не может самопроизвольно протекать химическая реакция, для которой  .
.
Другой важнейшей величиной в определении химического равновесия является константа равновесия, выражающая связь между концентрацией или парциальным давлением компонентов реакции в условиях равновесия – закон действующих масс.
Для реакции
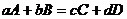 (4.4)
(4.4)
константа равновесия через парциальные давления Кр или концентрацию Кс компонентов соответственно выражается
 ;
; 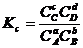 . (4.5)
. (4.5)
Константа равновесия обратимой реакции для данного состава реакционной смеси позволяет определить, в каком направлении и до какого предела протекает реакция в условиях, отличных от равновесия, с использованием уравнения изотермы
 . (4.6)
. (4.6)
При рассмотрении равновесий имеет значение особый случай, когда исходные вещества реагируют в своих стандартных условиях при парциальных давлениях, равных атмосферному, т.е.  1 атм. Из уравнения (4.6) следует, что при этом
1 атм. Из уравнения (4.6) следует, что при этом
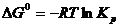 . (4.7)
. (4.7)
Величина  называется стандартным или нормальным изменением энергии Гиббса. Из уравнения (4.7) следует, что условия равновесия и протекания реакции в прямом и обратном направлениях – Кр = 1, Кр > 1 и Кр < 1 соответственно.
называется стандартным или нормальным изменением энергии Гиббса. Из уравнения (4.7) следует, что условия равновесия и протекания реакции в прямом и обратном направлениях – Кр = 1, Кр > 1 и Кр < 1 соответственно.
Следует отметить, что положительная величина  (или Кр < 1) означает полную невозможность протекания данной реакции в прямом направлении лишь в случае, когда все участники реакции имеют одинаковые парциальные давления, равные атмосферному. Если изменить эти давления, то, согласно уравнению (2.6), можно изменить направление реакции. Кроме того, Кр зависит от температуры, что тоже надо использовать при выборе оптимальных условий реакции.
(или Кр < 1) означает полную невозможность протекания данной реакции в прямом направлении лишь в случае, когда все участники реакции имеют одинаковые парциальные давления, равные атмосферному. Если изменить эти давления, то, согласно уравнению (2.6), можно изменить направление реакции. Кроме того, Кр зависит от температуры, что тоже надо использовать при выборе оптимальных условий реакции.
Таким образом, для заданной реакции 2CO+O2=2CO2

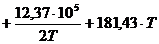 [Дж/моль].
[Дж/моль].
Подставив значения Т в уравнение (4.27), можно найти  для любой температуры в заданном интервале температур. Нужно только помнить, что выражение
для любой температуры в заданном интервале температур. Нужно только помнить, что выражение  получено при условии, что каждый компонент реакции не имеет фазового перехода в заданном интервале температур.
получено при условии, что каждый компонент реакции не имеет фазового перехода в заданном интервале температур.
Вычислим, например, 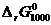 :
:
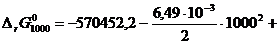
 [Дж/моль].
[Дж/моль].
 .
.
Определение степени завершенности реакции
В состоянии равновесия
Степень завершенности реакции в состоянии равновесия можно характеризовать через долю прореагировавшего исходного вещества.
4.3.1. Первый пример расчета
Вычислим выход NO (х) при окислении азота при 4000 К
1/2 N2газ + 1/2 О2газ = NOгаз.
Исходное число молей N2 и О2 равно1/2.
Для данной реакции
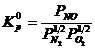 . (4.8)
. (4.8)
При равновесии парциальное давление N2 и О2 составляет 1/2(1 – х) атм, парциальное давление NO ‑ х атм. Тогда значение  можно выразить через значение х:
можно выразить через значение х:
 . (4.9)
. (4.9)
Значение Кр можно рассчитать любым из приведенных выше способов.
Например, при Т = 4000 К Кр = 0,3, следовательно, из выражения
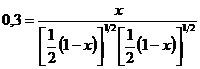
получаем х = 0,13, т.е. выход NO при этой температуре составляет лишь 13 %.
Аналогично можно рассчитать выход в гетерогенных системах.
4.3.2. Второй пример расчета
Рассчитать выход реакции восстановления при Т = 873 К
FeOт + CO = Feт + CO2.
Любым из приведенных выше способов рассчитаем Кр. Например, при Т = 873 К Кр = 2,6.
Если исходное давление СО составляет единицу, то выход х можно найти из значения Кр:
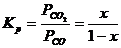 . (4.10)
. (4.10)
Выход составляет 72 %.
Задание
Для химической реакции (по заданию):
– изучить термодинамические характеристики компонентов реакции;
– изучить методику расчета константы равновесия химической реакции;
– рассчитать  , результаты представить в виде таблиц и графиков зависимостей
, результаты представить в виде таблиц и графиков зависимостей 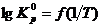 и
и 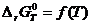 ;
;
– сделать выводы о направлении реакции и влиянии температуры на выход продукта с определением оптимальных условий выхода продукта в заданном интервале температур.
Оформление отчета должно соответствовать требованиям стандарта предприятия.
Примеры задач
1. В изолированной системе самопроизвольно протекает химическая реакция с образованием некоторого количества конечного продукта. Как изменится энтропия такой системы?
2. В каких случаях термодинамические функции приобретают свойства термодинамических потенциалов?
3. Пользуясь справочными данными, вычислите стандартное изменение изобарно-изотермического потенциала при 25 °С для химической реакции MgCO3(Тв) = MgO3(Тв) + СО2(г).
4. Напишите уравнение изотермы для реакции H2 + Br2 = 2HBr (все вещества в газообразном состоянии).
5. Определить направление химической реакции. Выбрать оптимальную температуру.
6. Рассчитать константу равновесия химической реакции в интервале температур. Определить оптимальный режим.
7. Определить степень завершенности химической реакции в равновесных условиях.
8. Какой термодинамический потенциал следует выбрать в качестве критерия направленности реакции, если она протекает в закрытом автоклаве при постоянной температуре? Каково условие самопроизвольного течения процесса, выраженное с помощью этого потенциала? Аргументируйте ответ.



 , (4.1)
, (4.1) , (4.2)
, (4.2) . (4.3)
. (4.3) .
.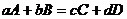 (4.4)
(4.4) ;
; 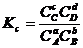 . (4.5)
. (4.5) . (4.6)
. (4.6) 1 атм. Из уравнения (4.6) следует, что при этом
1 атм. Из уравнения (4.6) следует, что при этом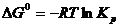 . (4.7)
. (4.7) называется стандартным или нормальным изменением энергии Гиббса. Из уравнения (4.7) следует, что условия равновесия и протекания реакции в прямом и обратном направлениях – Кр = 1, Кр > 1 и Кр < 1 соответственно.
называется стандартным или нормальным изменением энергии Гиббса. Из уравнения (4.7) следует, что условия равновесия и протекания реакции в прямом и обратном направлениях – Кр = 1, Кр > 1 и Кр < 1 соответственно.
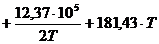 [Дж/моль].
[Дж/моль]. для любой температуры в заданном интервале температур. Нужно только помнить, что выражение
для любой температуры в заданном интервале температур. Нужно только помнить, что выражение 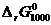 :
: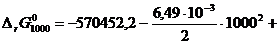
 [Дж/моль].
[Дж/моль]. .
.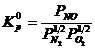 . (4.8)
. (4.8) можно выразить через значение х:
можно выразить через значение х: . (4.9)
. (4.9)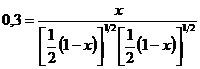
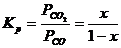 . (4.10)
. (4.10) , результаты представить в виде таблиц и графиков зависимостей
, результаты представить в виде таблиц и графиков зависимостей 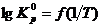 и
и 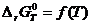 ;
;


