

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Цель работы
1. Определить направление химической реакции в равновесных условиях.
2. Определить оптимальные условия реакции в заданном интервале температур.
3. Рассчитать температурную зависимость стандартного изменения энергии Гиббса  с помощью стандартных термодинамических величин.
с помощью стандартных термодинамических величин.
Условия химического равновесия
И направления химической реакции
Энергия Гиббса G определяется соотношением
 , (2.1)
, (2.1)
где H и S – соответственно энтальпия и энтропия системы; Т – температура.
При любом процессе, протекающем самопроизвольно при постоянных давлении и температуре, энергия Гиббса уменьшается, следовательно, условием протекания химической реакции является неравенство
 , (2.2)
, (2.2)
условием химического равновесия:
 . (2.3)
. (2.3)
Отсюда следует, что не может самопроизвольно протекать химическая реакция, для которой  .
.
При рассмотрении равновесий имеет значение особый случай, когда исходные вещества реагируют в своих стандартных условиях при парциальных давлениях, равных атмосферному, т.е.  1 атм.
1 атм.
Величина  называется стандартным или нормальным изменением энергии Гиббса.
называется стандартным или нормальным изменением энергии Гиббса.
2.2. Расчет стандартного изменения энергии Гиббса 
С помощью стандартных термодинамических величин
Исходными данными для расчета являются температурные зависимости теплоемкостей компонентов 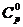 , стандартная теплота образования
, стандартная теплота образования 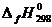 , энтропия
, энтропия 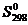 или стандартное изменение энергии Гиббса
или стандартное изменение энергии Гиббса  .
.
В этом методе расчета используются два исходных уравнения:
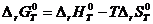 ; (2.4)
; (2.4)
 . (2.5)
. (2.5)
Тепловой эффект химической реакции 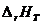 определяется уравнением
определяется уравнением
 , (2.6)
, (2.6)
где D Ср – изменение теплоемкости системы, обусловленное протеканием данной реакции.
|
|
Если
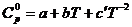 ; (2.7)
; (2.7)
 ; (2.8)
; (2.8)
 , (2.9)
, (2.9)
где D а, D b, D с ¢ – алгебраические суммы коэффициентов при одинаковой температуре в выражении (2.8), например,
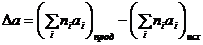 , (2.10)
, (2.10)
где ni – стехиометрические коэффициенты в уравнении реакции.
Аналогично определяются D b, D с ¢.
После интегрирования уравнения (2.6) получаем
 , (2.11)
, (2.11)
где D Н 0 – константа интегрирования.
Для определения D Н 0 вычисляем при Т = 298 °С тепловой эффект реакции D rH 298, используя табличные значения величин стандартных теплот образования компонентов реакции 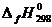 :
:
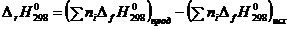 . (2.12)
. (2.12)
Подставив значения 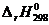 из уравнения (2.12) в уравнение (2.11), определяем D Н 0:
из уравнения (2.12) в уравнение (2.11), определяем D Н 0:
 . (2.13)
. (2.13)
Далее рассчитаем 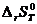 :
:
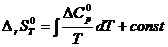 . (2.14)
. (2.14)
Подставив D Ср из выражения (2.7) в уравнение (2.14) и проинтегрировав, получаем
 . (2.15)
. (2.15)
Подставив 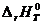 и
и 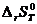 в уравнение (2.4), получим
в уравнение (2.4), получим
 , (2.16)
, (2.16)
где I – константа интегрирования.
Из уравнений (2.12) – (2.14) очевидно, что I = а – const.
Константу интегрирования I находим по известному значению  :
:
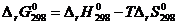 , (2.17)
, (2.17)
тогда

 . (2.18)
. (2.18)
Температурную зависимость константы равновесия химической реакции определяем по уравнению (2.5).
Пример расчета
Рассчитать температурную зависимость  и
и  для химической реакции 2СО + О2 = 2СО2.
для химической реакции 2СО + О2 = 2СО2.
Термодинамические характеристики компонентов реакции приведены в таблице.
Стандартные термодинамические величины веществ
| Вещество | 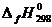 , кДж/моль , кДж/моль
| 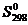 , Дж/моль×К , Дж/моль×К
| 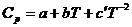 , Дж/моль×К , Дж/моль×К
| ||
| а | b ×103 | c¢ ×10-5 | |||
| СО2 | –393,51 | 213,6 | 44,14 | 9,04 | –8,53 |
| О2 | 205,03 | 31,46 | 3,39 | –3,77 | |
| СО | –110,50 | 197,40 | 28,41 | 4,10 | –0,46 |
Вычислим D а, D b, D с¢ реакции:
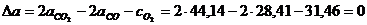 .
.
Аналогично:
 ;
;
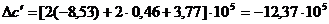 .
.
Следовательно для реакции 2СО + О2 = 2СО2
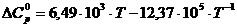 [Дж/моль×К].
[Дж/моль×К].
Согласно уравнению (2.11), для данной реакции
 , (2.19)
, (2.19)
так как D а = 0.
Для определения D Н 0 вычислим 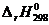 , используя значения
, используя значения 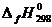 по уравнению (2.12):
по уравнению (2.12):
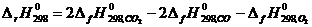 ; (2.20)
; (2.20)
 [кДж/моль],
[кДж/моль],
затем из уравнения (2.19) находим D Н 0:
 .
.
Для данной реакции, согласно уравнению (2.16), определим  :
:
|
|
 ; (2.21)
; (2.21)
и вычислим  , чтобы найти константу интегрирования I.
, чтобы найти константу интегрирования I.
 . (2.22)
. (2.22)
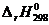 = -566,02 кДж/моль, согласно уравнению (2.22).
= -566,02 кДж/моль, согласно уравнению (2.22).
 ; (2.23)
; (2.23)
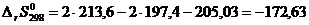 [Дж/К].
[Дж/К].
Следовательно,
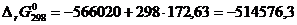 [Дж].
[Дж].
Затем по уравнению (2.21) находим I:

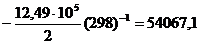 ;
;
I = 181,43.
Таким образом, для заданной реакции

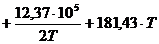 [Дж/моль]. (2.24)
[Дж/моль]. (2.24)
Подставив значения Т в уравнение (2.24), можно найти  для любой температуры в заданном интервале температур. Нужно только помнить, что выражение
для любой температуры в заданном интервале температур. Нужно только помнить, что выражение  получено при условии, что каждый компонент реакции не имеет фазового перехода в заданном интервале температур.
получено при условии, что каждый компонент реакции не имеет фазового перехода в заданном интервале температур.
Вычислим, например, 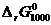 :
:
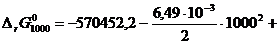
 [Дж/моль].
[Дж/моль].
Задание
1. Определить направление химической реакции в равновесных условиях (по варианту).
2. Определить оптимальные условия реакции в заданном интервале температур.
3. Рассчитать температурную зависимость стандартного изменения энергии Гиббса  с помощью стандартных термодинамических величин.
с помощью стандартных термодинамических величин.
Примеры задач
1. При каких условиях внутренняя энергия системы может служить критерием направленности процесса? Как она изменяется в ходе самопроизвольного процесса в этих условиях? Ответ аргументировать.
2. В некотором самопроизвольно протекающем изобарно-изотермическом процессе энтропия убывает. Сопоставьте изменение изобарно-изотермического потенциала ΔG и тепловой эффект процесса ΔН по величине. Что больше?
3. Определите изменение изобарно-изотермического потенциала конденсации 1 кмоля водяного пара при 373 К и давлении 1,0133·103 Н/м2, если известно, что теплота испарения воды равна 40,7·106 Дж/кмоль, а изменение энтропии 109·103 Дж/(кмоль·К).
4. Какой знак будет иметь величина ΔG для процесса перехода жидкого олова при 298 К в твердое состояние при той же температуре? Температура плавления олова 511 К. Какое состояние олова (жидкое или твердое) является более устойчивым при 298 К?
5. Рассчитать изменение изобарно-изотермического потенциала от температуры в интервале Т1 – Т2 для реакции (по заданию).
3. Энтропия. Энтропийный критерий
самопроизвольного процесса и равновесия
Энтропия – функция состояния системы, изменение которой равно приведенной теплоте, сообщенной системе обратимым процессом.
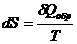 . (3.1)
. (3.1)
Для обратимых процессов 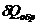 = 0, dS = 0 и ΔS = 0. Пи конечном изменении состояния системы
= 0, dS = 0 и ΔS = 0. Пи конечном изменении состояния системы
|
|
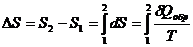 . (3.2)
. (3.2)
Если процесс изотермический, то

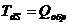 (3.3)
(3.3)
В любых круговых процессах
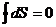 ,
,  . (3.4)
. (3.4)
Для необратимого процесса
δQнеобр < δQобр,(3.5)
следовательно,
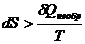 ,
,  . (3.6)
. (3.6)
Таким образом, второй закон термодинамики для обратимых и необратимых процессов
 . (3.7)
. (3.7)
Для изолированных систем δQ = 0, следовательно, dS ≥ 0 и Δ S ≥ 0.
|
|
|

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!