

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Определение места расположения распределительного центра: Фирма реализует продукцию на рынках сбыта и имеет постоянных поставщиков в разных регионах. Увеличение объема продаж...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
1) При нагревании вещества при P = const
 , (3.8)
, (3.8)
где n – число молей.
2) При нагревании вещества при V = const
 . (3.9)
. (3.9)
3) При изотермическом процессе

 (3.10)
(3.10)
где  ,
,  – теплота и абсолютная температура фазового перехода.
– теплота и абсолютная температура фазового перехода.
4) Для различных процессов с идеальным газом
 , (3.11)
, (3.11)
 . (3.12)
. (3.12)
Если СV = const,
 . (3.13)
. (3.13)
Если T = const,
 . (3.14)
. (3.14)
Если V = const,
 . (3.15)
. (3.15)
Если Р = const,
 . (3.16)
. (3.16)
Изменение энтропии – критерий самопроизвольного процесса и равновесия
Для изолированной системы второй закон термодинамики определяется
 ,
,  , (3.17)
, (3.17)
где знак равенства соответствует обратимым процессам, знак неравенства – необратимым (самопроизвольным процессам). Т. о. изменение энтропии есть критерий возможности и направления самопроизвольных процессов. Чтобы вычислить изменение энтропии при необратимом процессе мысленно провести этот процесс обратимо с тем же начальным и конечным состоянием системы
 . (3.18)
. (3.18)
Для расчета изменения энтропии как критерия направления процесса необходимо общее изменение энтропии сложной изолированной системы 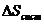 .
.
1) Общее изменение энтропии 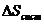 изолированной системы складывается из двух величин: изменения энтропии в результате происходящих процессов (нагревание, плавление, испарение и т.д.)
изолированной системы складывается из двух величин: изменения энтропии в результате происходящих процессов (нагревание, плавление, испарение и т.д.) 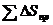 и изменения энтропии окружающей среды, т.е. теплового источника и приемника теплоты
и изменения энтропии окружающей среды, т.е. теплового источника и приемника теплоты 
Таким образом
 . (3.19)
. (3.19)
2) При обратимых процессах
 ,
,  . (3.20)
. (3.20)
3) При необратимых (самопроизвольных) процессах
 ,
,  . (3.21)
. (3.21)
Судить о направлении процесса по величине  невозможно. О направлении процесса можно судить только по величине
невозможно. О направлении процесса можно судить только по величине 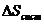 , определяемой по уравнению (3.19).
, определяемой по уравнению (3.19).
|
|
Задание
1. Рассчитать изменение энтропии вещества при нагревании от Т1 до Т2.
2. Рассчитать изменение энтропии вещества ΔS в интервале температур от Т1 до Т2 при наличие фазовых переходов.
3. Определить, пойдет ли самопроизвольный процесс кристаллизации вещества при Т1, Т2 … Тn ˂ Тпл на основании изменения энтропии. Процесс необратим, и для расчета 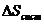 необходимо заменить данный обратимый процесс совокупностью обратимых стадий.
необходимо заменить данный обратимый процесс совокупностью обратимых стадий.
Примеры расчета
Общее выражение для расчета изменения энтропии при Р = const с температурами плавления и кипения Т пл и Т кип можно записать в виде:
 (3.22)
(3.22)
где Ср(тв), Ср(ж), Ср(газ) ‑ теплоемкости твердого, жидкого, газообразного состояния вещества; D Нпл и D Нкип - теплота плавления и кипения при нормальном давлении;
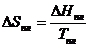 и
и 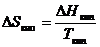 (3.23)
(3.23)
 ‑ изменение энтропии при фазовом переходе плавления и кипения.
‑ изменение энтропии при фазовом переходе плавления и кипения.
Задача 1. Найти изменение энтропии 1 моля Н2О (ж) при нагревании от 0 °С до 100 °С, если 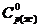 = 75,44 Дж/моль.
= 75,44 Дж/моль.
Решение.


Нужно обратить внимание на то, что в расчетную формулу подставляют температуру в градусах Кельвина.
Задача 2. Найти изменение энтропии при превращении 1 моля льда при 0 °С в пар при 100 °С.
Решение. По справочнику находим теплоту плавления и кипения ‑ 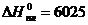 Дж/моль и
Дж/моль и 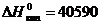 Дж/моль, теплоемкость жидкого состояния ‑
Дж/моль, теплоемкость жидкого состояния ‑ 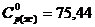 Дж/(моль·К).
Дж/(моль·К).
Очевидно, что при данных условиях нужно учесть два фазовых перехода ‑ изменение энтропии при плавлении и кипении.
Таким образом,
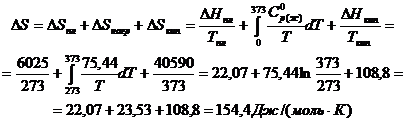
Задача 3. Найти изменение энтропии 1 моля Na2SiO3 при нормальном давлении в интервале температур 298 – 1800 К.
Решение. По справочнику находим: Т пл = 1360 К,
D Нпл = 52390 Дж/моль, 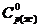 = 179,1 Дж/(
= 179,1 Дж/(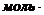 К), т.е. в заданном интервале температур нужно учесть фазовый переход плавления.
К), т.е. в заданном интервале температур нужно учесть фазовый переход плавления.

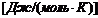 .
.
С учетом наличия фазового перехода плавления

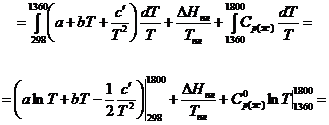


Примечание. Уравнения (3.22) и (3.23) приведены для 1 моля вещества. Если по условию задачи нужно найти D S для n молей вещества, то
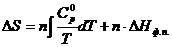 .
.
Если по условию задачи нужно найти изменение энтропии для m г вещества, то необходимо вес пересчитать на число молей:
|
|
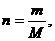
где m - вес вещества в граммах; М - молекулярная масса.
Задача 4. Определить, пойдет ли самопроизвольно процесс кристаллизации воды при Т = 263 К и давлении Р = 1 атм.
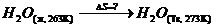 .
.
Процесс явно необратим, т.к. при 363 К вода и лед не находятся в равновесии, т.е. для расчета общей энтропии 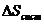 необходимо заменить данный необратимый процесс совокупностью обратимых стадий.
необходимо заменить данный необратимый процесс совокупностью обратимых стадий.
Решение. 1. Нагреем воду до Т = 273 К при P = const
 .
.
2. Заморозим воду при 273 К, при этом H2O(ж) и H2O(Тв) будут в равновесии
 .
.
3. Охладим лед до Т = 263 К
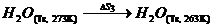 ;
;
или

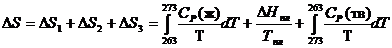 .
.
Справочные данные:
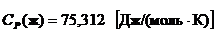 ,
,
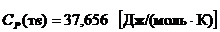 ,
,
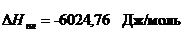 ,
,
тогда
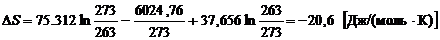
Чтобы установить направление процесса, используя энтропийный критерий самопроизвольности процесса, необходимо найти изменение энтропии системы, т.е. включить окружающую среду
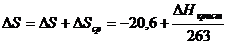 ,
,
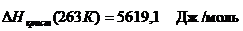 .
.
тогда
 .
.
Т. о. 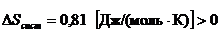 .
.
Следовательно, данный процесс является самопроизвольным.
Задание
Расчитать изменение энтропии, энтальпии индивидуального вещества (по заданию) в заданном интервале температур.
Примеры задач
1. 14 кг азота при 273 К нагревают при постоянном объеме до тех пор, пока его температура не станет равной 373 К. Считать азот идеальным газом, рассчитать изменение энтропии в этом процессе. Зависимость теплоемкости азота при постоянном объеме от температуры выражается уравнением СV = 19,56 + 4,27·10-3 Т.
2. Как зависит от температуры свободная энергия F при постоянном объеме системы? Выведите математическое выражение этой зависимости и объясните его.
3. Рассчитайте величину ΔF для процесса изобарно-изотермического испарения 1 моля Н2О при 100 °С и давлении 1 атм.
4. 1 моль твердой Н2О, взятой при температуре плавления (0 °С), последовательно претерпевает следующие изменения:
а) превращается в жидкость при температуре плавления (ΔНпл = 6010,8 Дж/моль);
б) изобарически нагревается до температуры кипения (100 °С, Ср(Т) = 75,31 Дж/(моль·К);
в) превращается в газообразное состояние при температуре кипения (100 °С, ΔНисп = 40748,4 Дж/моль);
г) полученный пар изотермически расширяется в 10 раз.
Какой из этих этапов суммарного процесса характеризуется наибольшим изменением энтропии?
5. Пользуясь справочными данными, рассчитайте стандартное изменение энтропии и изобарно-изотермического потенциала при 298 К в ходе реакции
|
|
4NO + 6H2O(ж) = 4NH3 + 5O2.
6. Пользуясь данными справочника о зависимости теплоемкости азота от температуры, рассчитайте величину изменения энтропии в процессе изобарического нагревания 1 моля N2 от 300 до 600 К.
7. Пользуясь данными справочника, рассчитайте стандартное изменение энтропии и изобарно-изотермического потенциала при 293 К реакции 2N2 + 6H2O(ж) = 4NH3 + 3O2.
8. Рассчитать U, S, F, G индивидуального вещества, если при Т = Т1, Т = Т2 имеют место фазовые переходы (по заданию).
|
|
|

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!