

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...
Топ:
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Марксистская теория происхождения государства: По мнению Маркса и Энгельса, в основе развития общества, происходящих в нем изменений лежит...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Точные данные о количественных соотношениях между реаги-рующими и получаемыми в результате реакции веществами содержит правильно написанное уравнение химической реакции. В случае про-текания реакций между растворами для определения количества (массса или объем) взаимодействующих растворов необходимо учитывать содержание в них реагирующих веществ.
Решение задачи начинается с написания уравнения химической реакции. Стехиометрические коэффициенты (коэффициенты перед формулами) выражают количественное соотношение числа молей реагирующих веществ.
При решении задачи необходимо:
1. Написать уравнение реакции.
2. Рассчитать количество молей заданного реагента. Если это раствор, то учесть заданные объем и концентрацию.
3. Используя уравнение реакции, определить необходимое коли-чество молей второго вещества и соответственно его массу.
4. В случае, если второй реагент раствор, то, исходя из концен-трации, рассчитывают его объем.
Этот тип задач можно решать, используя закон эквивалентов (см. «Расчеты с использованием закона эквивалентов»).
Пример 1. Рассчитать массу карбоната кальция (CaCO3), не-обходимого для нейтрализации 2 л 8% азотной кислоты (HNO3)  .
.
Уравнение реакции: CaCO3 + 2 HNO3 = Ca(NO3)2 + H2O + CO2↑
1. Количество HNO3:
масса раствора 10%
 ;
;
масса растворенного вещества
 ;
;
число молей
 [моль],
[моль],
где М (HNO3) = 63 г/моль.
2. Количество CaCO3.
Согласно уравнению реакции
1 моль CaCO3 – 2 моль HNO3,
соответственно
n (CaCO3) моль – 2,65 моль HNO3

 [моль].
[моль].

Масса карбоната кальция:

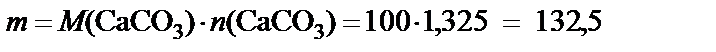 [г],
[г],
где М (CaCO3) = 40 + 12 + 16∙3 = 100 г/моль.
Вывод. Для нейтрализации 2 л 8% азотной кислоты необходимо 132,5 г карбоната кальция.
|
|
Пример 2. Какой объем 0,2 М раствора соляной кислоты необхо-димо добавить к 200 мл раствора нитрата серебра с молярной концен-трацией C(AgNO3) = 0,05 моль/л для полного осаждения ионов серебра.
Уравнение реакции:
AgNO3 + HCl = AgCl↓+ HNO3
Так как 0,2 М раствор ≡ молярная концентрация соляной кислоты C(HCl) = 0,2 моль/л, можно рассчитать количество AgNO3.
1. Количество AgNO3
n (X) = C (X)∙ V,
где V − объем раствора в литрах,
n (AgNO3) = С (AgNO3)· V = 0,05·0,2 = 0, 01 моль.
2. Количество HCl.
Согласно уравнению реакции
1 моль AgNO3 – 1 моль HCl,
соответственно
0,01 моль AgNO3 – n (HCl) моль
n (HCl) = 0,01 моль.
3. Объем раствора HCl:
C (HCl) = 0,2 моль/л, 1 л раствора содержит 0,2 моль
V л − 0,01 моль,
 мл.
мл.
Вывод. Для полного осаждения ионов серебра из 200 мл 0,2 М раствора нитрата серебра необходимо 50 мл 0,2 М раствора HCl.
Пример 3. Рассчитать объем оксида азота (II), образующегося при растворении 2 г меди в разбавленной азотной кислоте: Cu + HNO3 ® Cu(NO3) + NO↑ + H2O.
1. Определить стехиометрические коэффициенты в уравнении реакции:
3 Cu + 8 HNO3 = 3 Cu(NO3) + 2 NO↑ + 4 H2O
| 3│Cu0 − 2ē = Cu+2 2│N+5 + 3ē = N+2 |
2. Количество меди:
 [моль], М (Cu) = 64 г/моль.
[моль], М (Cu) = 64 г/моль.
3. Количество NO.
Согласно уравнению реакции
3 моль Cu – 2 моль NO,
соответственно
0,31 моль Cu – n (NO) моль,

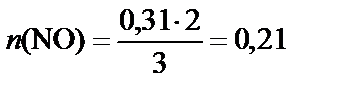 [моль].
[моль].
4. Объем газа
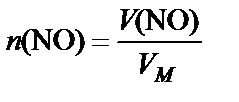 ®
®  .
.
Вывод. При растворении 2 г меди в разбавленной азотной кислоте образуется 4,7 л оксида азота (II).
Пример 4. Какой объем углекислого газа (СО2) может поглотить 100 мл 10% раствора гидроксида натрия  ?
?
Уравнение реакции: 2NaOH + CO2 = Na2CO3 + H2O
1. Количество NaOH.
Масса раствора
 ;
;
масса растворенного вещества
 ;
;
 , М (NaOH) = 40 г/моль,
, М (NaOH) = 40 г/моль,
 моль.
моль.
2. Количество СО2. Согласно уравнению реакции
2 моль NaOH – 1 моль CO2,
соответственно
0,28 моль NaOH – n (CO2) моль;

 моль.
моль.
3. Объем газа
 ®
®  .
.
Вывод. 100 мл 10% раствора гидроксида натрия может поглотить 3,1 л углекислого газа.
Пример 5. Какой объем 10%-ного раствора гидроксида натрия  необходимо добавить к 3 мл раствора сульфата меди (II) C(CuSO4) = 0,5 моль/л для получения дигидроксида меди?
необходимо добавить к 3 мл раствора сульфата меди (II) C(CuSO4) = 0,5 моль/л для получения дигидроксида меди?
|
|
Уравнение реакции: CuSO4 + 2 NaOH = Cu(OH)2↓ + Na2SO4.
1. Количество CuSO4:
n (CuSO4) = C (CuSO4)∙ V,
где V − объем раствора в литрах;
V = 3 мл = 0,003 л, n (CuSO4) = С (CuSO4)· V = 0,5·0,003 = 0,0015 моль.
2. Количество NaOH. Согласно уравнению реакции
2 моль NaOH – 1 моль CuSO4,
соответственно
n (NaOH) моль – 0,0015 моль CuSO4,

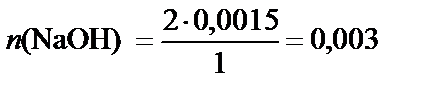 моль.
моль.
3. Масса растворенного вещества:
 ; М (NaOH) = 40 г/моль
; М (NaOH) = 40 г/моль

 г.
г.
4. Масса раствора NaOH с концентрацией ω% = 10%:
 ®
® 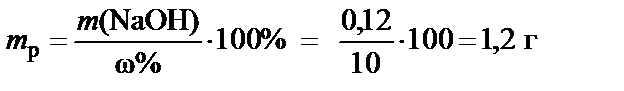 .
.
5. Объем раствора NaOH:
 см3.
см3.
Вывод. Для получения Cu(OH)2 к 3 мл раствора CuSO4 С(CuSO4)·= 0,5 моль/л необходимо добавить 1,08 мл 10% раствора NaOH.
|
|
|

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!