

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
Топ:
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
1. Массовая доля (процентная концентрация) ω% ® молярная концентрация С (X):
 или
или  ,
,
где  − плотность раствора;
− плотность раствора;  − молярная масса.
− молярная масса.
2. Массовая доля (процентная концентрация) ω% ® молярная концентрация эквивалента C [(1/ z)X] (нормальная концентрация C н):
 или
или  ,
,
где  − плотность раствора;
− плотность раствора;  − молярная масса эквивалента.
− молярная масса эквивалента.
3. Массовая доля (процентная концентрация) ω% ® моляльная концентрация B (X):
 ,
,
где  − молярная масса.
− молярная масса.
4. Молярная концентрация С (X) − молярная концентрация эквивалента C [(1/ z)X] (нормальная концентрация C н):

 , z – эквивалентное число.
, z – эквивалентное число.
Для растворов веществ с z = 1 молярная концентрация С (X) и молярная концентрация эквивалента C [(1/ z)X] совпадают.
Решение задач
Приготовление растворов
Приготовить раствор заданной концентрации можно растворени-ем вещества в воде, разбавлением концентрированного раствора, смешиванием растворов разных концентраций. Как правило, задаются объем раствора и его концентрация. Необходимо рассчитать массу растворяемого вещества или объем концентрированного раствора, добавлением воды к которому до заданного объема получают раствор требуемой концентрации. Если концентрация раствора − массовая доля (ω%), то для расчета необходимо знать его плотность.
При решении задачи необходимо:
1. Рассчитать количество растворенного вещества, содержаще-гося в объеме раствора заданной концентрации. Это может быть масса (г), количество молей или эквивалентов, необходимое для приготовления раствора.
2. При растворении вещества определяют массу вещества, необ-ходимого для приготовления раствора (см. примеры 1, 2).
3. В случае приготовления раствора разбавлением рассчитывают объем концентрированного раствора, содержащий столько же веще-ства, сколько содержит заданный раствор (см. примеры 3, 4).
|
|
Пример 1. Приготовить 500 мл 10% раствора карбоната калия (K2CO3), плотность раствора 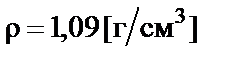 . Рассчитать молярную концентрацию полученного раствора.
. Рассчитать молярную концентрацию полученного раствора.
1. Масса раствора
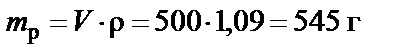 .
.
2. Масса растворенного вещества
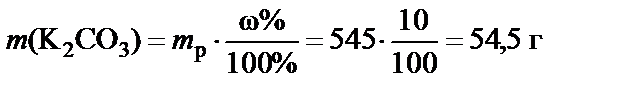 .
.
3. Молярная концентрация полученного раствора.
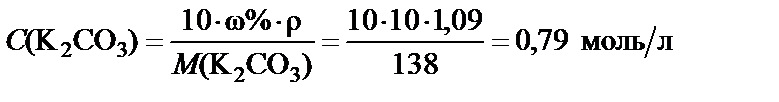 ,
,
где М (K2CO3) = 39·2 + 12 + 16·3 = 138 г/моль.
Вывод. Для приготовления заданного раствора навеску карбоната калия m = 54,5 г растворить в воде и довести объем раствора до
500 мл. Молярная концентрация полученного раствора С (K2CO3) = = 0,79 моль/л.
Пример 2. Приготовить 1 л 0,1 н. раствора карбоната натрия (Na2CO3). Рассчитать процентную концентрацию полученного рас-твора. Плотность раствора  .
.
Так как 0,1 н. раствор º молярная концентрация эквивалента C [(1/2)Na2CO3] = 0,1 моль/л, можно рассчитать массу растворенного вещества в 1 л раствора 0,1 н.
1. Расчет массы Na2CO3: 1 л раствора соли содержит 0,1 моль эквивалентов Na2CO3
n [(1/2)] = C [(1/2)Na2CO3]∙ V = 0,1·1 = 0,1 моль.
М (Na2CO3) = 23·2 + 12 + 16·3 = 106 г/моль, z = 2,
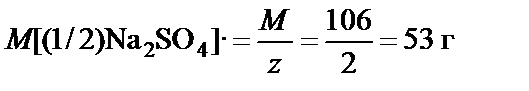 ,
,
m (Na2CO3) = M [(1/2)Na2CO3]· n [(1/2)Na2CO3] = 53·0,1 = 5,3 г.
2. Процентная концентрация полученного раствора

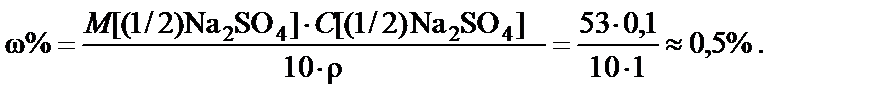
Вывод. Для приготовления заданного раствора навеску карбоната натрия m = 5,3 г растворить в воде и довести объем раствора до 1 л. Массовая доля Na2CO3 ω% = 0,5%.
Пример 3. Приготовить 200 мл 2 М раствора серной кислоты разбавлением 96% раствора с плотностью 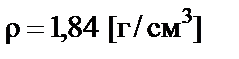 .
.
Так как 2М раствор ≡ молярная концентрация серной кислоты С (H2SO4) = 2 моль/л, следовательно, 1 л раствора кислоты содержит
2 моль H2SO4.
1. Масса растворенного вещества (H2SO4) в 200 мл 2 М раствора:
n (H2SO4) = С (H2SO4)· V = 2·0,2= 0,4 моль,
где V − объем раствора в литрах.
2. Масса серной кислоты:
m (H2SO4) = М (H2SO4)· n (H2SO4) = 98·0,4= 39,2 г,
где М (H2SO4) = 98 г/моль − молярная масса серной кислоты.
3. Масса раствора H2SO4 при ω% = 96%:
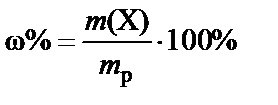 ®
® 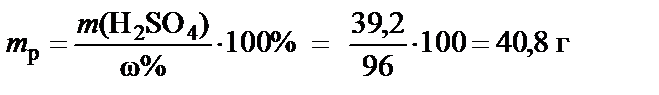 .
.
Объем раствора H2SO4 при ω% = 96%:
|
|
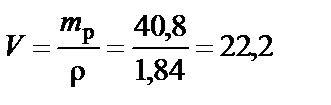 см3.
см3.
Вывод. Для приготовления заданного раствора 22,2 мл H2SO4 ω% = 96 % растворить в воде и довести объем раствора до 200 мл.
Данную задачу можно решить другим способом. Если перейти
от массовой концентрации к молярной 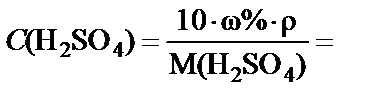 =
=  , то можно воспользоваться условием равенства количества молей серной кислоты в концентрированном и заданном растворе:
, то можно воспользоваться условием равенства количества молей серной кислоты в концентрированном и заданном растворе:
n (H2SO4) = С (H2SO4)1∙ V 1 = С (H2SO4)2∙ V 2
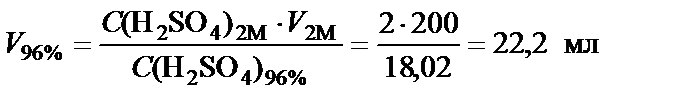 .
.
Пример 4. Приготовить 500 мл 10% раствора соляной кислоты 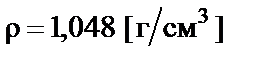 разбавлением концентрированного раствора ω% = = 35% с плотностью
разбавлением концентрированного раствора ω% = = 35% с плотностью 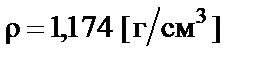 .
.
1. Масса раствора 10%
 .
.
2. Масса растворенного вещества (HCl)
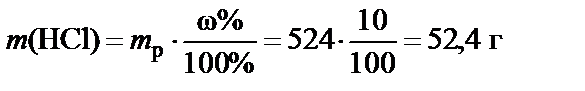 .
.
3. Масса раствора 35%
 ®
®  .
.
Объем раствора HCl ω% = 35 %
 см3.
см3.
Вывод. Для приготовления заданного раствора растворить 127,5 мл HCl с концентрацией ω% = 35 % в воде и довести объем раствора до 500 мл.
|
|
|

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!