СТЕХИОМЕТРИЧЕСКИЕ
Расчеты
Министерство образования и науки Российской Федерации
Балтийский государственный технический университет «Военмех»
Кафедра «Технология конструкционных материалов
и производства ракетно-космической техники»
а.п. КИСЕЛЕВ, а.а ФАТИНА, А.А. Барунин
СТЕХИОМЕТРИЧЕСКИЕ
расчеты
Практическое пособие
Санкт-Петербург
УДК 542.3.021(076)
| Киселев, А.П.
Стехиометрические расчеты: практическое посо-бие / А.П. Киселев, А.А. Фатина, А.А. Барунин; Балт. гос. техн. ун-т.– СПб., 2017. – 30 с.
Приведены основные понятия, определения и обозначения физико-химических величин задачи разной степени сложности и методика их решения, а также варианты задач для самосто-ятельного решения.
Предназначено для студентов технических специальностей, изучающих курс «Химия».
|
К44
УДК 542.3.021(076)
Р е ц е н з е н т д-р техн. наук, проф. Л.П. Юнаков
Утверждено
редакционно-издательским
советом университета
© БГТУ, 2017
© Авторы, 2017
Принятые обозначения
| Мr (Х)
| −
| относительная молекулярная масса молекулы вещества Х
|
| М (Х)
| −
| молярная масса вещества Х, 
|
| n (X)
| −
| количество вещества Х, [моль]
|
| n [(1/ z)Х]
| −
| количество вещества эквивалентов Х, [моль]
|
| M [(1/ z)X]
| −
| молярная масса эквивалента вещества Х, [г/моль]
|
| z (Х)
| −
| число эквивалентности
|
| m (X)
| −
| масса вещества Х, г
|
| V (X)
| −
| объем вещества Х, л, мл
|
| VМ
| –
| объем одного моля идеального газа, л/моль
|
| C (X)
| −
| молярная концентрация вещества Х,
|
| С [(1/ z)Х]
| −
| молярная концентрация эквивалента вещества Х, 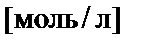
|
| ω, ω%
| −
| массовая доля вещества Х в растворе
|
| В (X)
| −
| моляльная концентрация вещества Х, 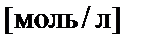
|
| ρ
| −
| плотность раствора, 
|
Буквой X обозначен химический символ вещества.
Основные понятия
В результате протекания химической реакции исходные вещества – реагенты − превращаются в продукты реакции. Стехиометрия − раздел химии, рассматривающий количественные соотношения меж-ду реагирующими веществами. Расчеты, связанные с определением массовых или объемных соотношений между реагирующими и полу-чаемыми в результате необратимой (полностью протекающей в од-ном направлении) реакции веществами, называются стехиометриче-скими. Их теоретической основой являются закон сохранения массы и закон постоянства состава. В реальных химических процессах в результате неполного протекания реакции (кинетически обратимые реакции) или протекания неосновных реакций количество (масса, объем) продуктов обычно меньше теоретически рассчитанного.
Точные данные о количественных соотношениях между реаги-рующими и получаемыми в результате реакции веществами содержит правильно написанное уравнение химической реакции. Стехиометрические коэффициенты (коэффициенты перед формулами) соответствуют числу молей реагирующих веществ.
Количество вещества можно характеризовать их массой (m) или объемом (V). В химии единицей измерения массы обычно служит грамм (г) и кратные ему величины, а единицей измерения объема − литр (л ≡ дм3) или миллилитр (мл ≡ см3). Количество твердых веществ удобно характеризовать их массой, а газов и жидкостей − объемом.
Концентрация
Концентрация растворенного вещества − величина, характери-зующая количественный состав раствора (количество растворенного вещества в единице массы или объема раствора). Чаще всего это массовая доля (w) и молярная концентрация (C (X)), молярная концентрация эквивалента (нормальная концентрация) 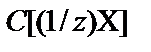 , моляльная концентрация (В (X)).
, моляльная концентрация (В (X)).
Массовая доля (w) – доля растворенного вещества в единице массы раствора − вычисляется как отношение массы растворенного вещества m (X) к массе раствора (m p):
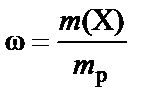 или
или  .
.
Массовая доля, выраженная в процентах (w%), − процентная концентрация − численно равна массе растворенного вещества в граммах, содержащейся в 100 г раствора. Соответственно масса растворенного вещества, содержащегося в растворе:
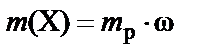 или
или  .
.
В зависимости от выбранной единицы измерения для характери-стики состава раствора кроме массовой доли 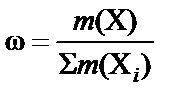 используют мольную
используют мольную 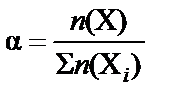 или объемную долю
или объемную долю  .
.
П р и м е р. Какое количество гидроксида натрия содержится в 300 г его 5%-ного раствора?
100 г раствора содержат 5 г NaOH, 300 г раствора содержат
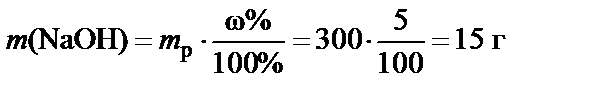 .
.
Если стоит задача определить массу растворенного вещества в объеме раствора, то необходимо знать его плотность 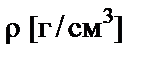 .
.
П р и м е р. Какое количество гидроксида натрия содержится в
300 мл 5% раствора? Плотность раствора 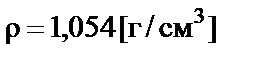 .
.
Масса раствора
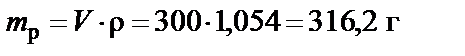 ;
;
масса растворенного вещества
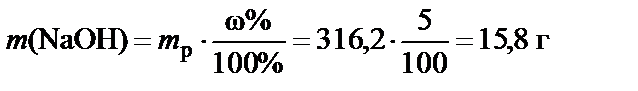 .
.
Молярная концентрация вещества Х – количество растворенного вещества в молях, содержащегося в 1 л раствора:
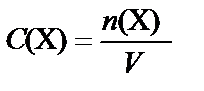 [моль/л].
[моль/л].
Соответственно количество вещества, содержащегося в растворе:
n (X) = C (X)∙ V, [моль],
где V − объем раствора в литрах.
Часто встречается другое обозначение молярной концентрации C (X), которое принято обозначать «М». Так, раствор с концентрацией C (X) = 0,5 моль/л º 0,5 М раствор.
П р и м е р. Какое количество хлористого водорода в граммах содержится в 2 л раствора соляной кислоты концентрации C (HCl) = = 0,1 моль/л (0,1 М)?
1 л раствора кислоты содержит 0,1 моль HCl;
2 л раствора содержат
n (HCl) = C (HCl)∙ V = 0,1·2 = 0,2 моль HCl.
Масса содержащегося в растворе хлористого водорода:
m (HCl) = n (HCl)· М (HCl) = 0,2·36,5 = 7,3 г,
М (HCl) = 1 + 35,5 = 36,5 г/моль.
Молярная концентрация эквивалента вещества Х − количество моль эквивалентов вещества, содержащееся в 1 л раствора:
 .
.
Другое, часто используемое, название молярной концентрации эквивалента − нормальная концентрация (C н), которое принято обозначать «н». Так, раствор с молярной концентрации эквивалента  = 0,1 моль/л обозначается C н(1/ z) = 0,1 моль/л (0,1 н. рас-твор), где z – эквивалентное число. Например, для перманганата калия в окислительно-восстановительных реакциях С (1/5 КMnO4) º C н (1/5) [моль/л].
= 0,1 моль/л обозначается C н(1/ z) = 0,1 моль/л (0,1 н. рас-твор), где z – эквивалентное число. Например, для перманганата калия в окислительно-восстановительных реакциях С (1/5 КMnO4) º C н (1/5) [моль/л].
Соответственно количество эквивалентов вещества X, содержа-щееся в растворе:
n [(1/ z)X] = C [(1/ z)X]∙ V, [моль],
где V − объем раствора в литрах.
П р и м е р. Какое количество серной кислоты в граммах содержат 200 мл 0,1 (1/2) н. раствора.
Так как 0,1 (1/2) н. раствор º молярная концентрация эквивалента C [(1/2)H2SO4] = 0,1 моль/л, 1 л раствора кислоты содержит 0,1 моль эквивалентов H2SO4
200 мл = 0,2 л раствора содержат n [(1/2)H2SO4]
n [(1/2)H2SO4] = C [(1/2)H2SO4]∙ V = 0,1·0,2 = 0,02 моль эквивалентов HCl
Масса содержащейся в растворе серной кислоты:
М (H2SO4) = 98 г/моль, z = 2 ® 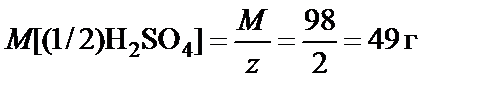 ;
;
m (H2SO4) = M [(1/2)H2SO4]· n [(1/2)H2SO4] = 0,02·49 = 0,98 г.
Моляльная концентрация вещества Х – количество растворено-го вещества в молях, растворенного в 1 кг растворителя:
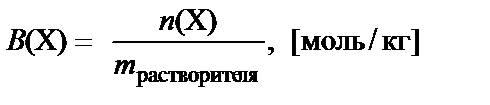 .
.
Другое обозначение моляльной концентрации – Cm (моляльность раствора).
П р и м е р. Раствор хлорида натрия, моляльная концентрация соли Cm = 5 моль/кг. Рассчитать массовую долю NaCl.
Так как Cm º В (X) = 5 моль/кг, 1 кг воды содержит 5 моль NaCl.
Масса растворенной соли
m (NaCl) = М (NaCl)· n (NaCl) = 58,5·5 = 292,5 г,
М (NaCl) = 23 + 35,5 = 58, 5 г/моль;
Масса раствора
m p = m (H2O) + m (NaCl) = 1000 + 292,5 =1292,5 г.
Массовая доля NaCl (процентная концентрация):
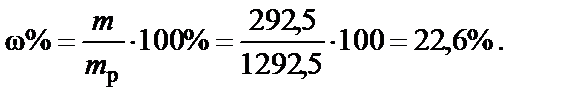
Решение задач
Приготовление растворов
Приготовить раствор заданной концентрации можно растворени-ем вещества в воде, разбавлением концентрированного раствора, смешиванием растворов разных концентраций. Как правило, задаются объем раствора и его концентрация. Необходимо рассчитать массу растворяемого вещества или объем концентрированного раствора, добавлением воды к которому до заданного объема получают раствор требуемой концентрации. Если концентрация раствора − массовая доля (ω%), то для расчета необходимо знать его плотность.
При решении задачи необходимо:
1. Рассчитать количество растворенного вещества, содержаще-гося в объеме раствора заданной концентрации. Это может быть масса (г), количество молей или эквивалентов, необходимое для приготовления раствора.
2. При растворении вещества определяют массу вещества, необ-ходимого для приготовления раствора (см. примеры 1, 2).
3. В случае приготовления раствора разбавлением рассчитывают объем концентрированного раствора, содержащий столько же веще-ства, сколько содержит заданный раствор (см. примеры 3, 4).
Пример 1. Приготовить 500 мл 10% раствора карбоната калия (K2CO3), плотность раствора 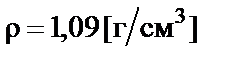 . Рассчитать молярную концентрацию полученного раствора.
. Рассчитать молярную концентрацию полученного раствора.
1. Масса раствора
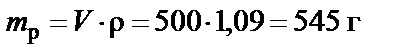 .
.
2. Масса растворенного вещества
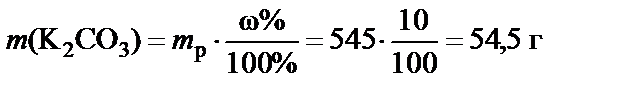 .
.
3. Молярная концентрация полученного раствора.
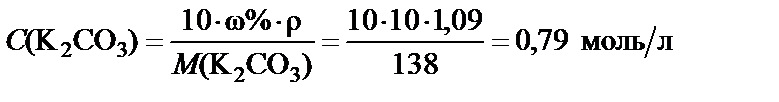 ,
,
где М (K2CO3) = 39·2 + 12 + 16·3 = 138 г/моль.
Вывод. Для приготовления заданного раствора навеску карбоната калия m = 54,5 г растворить в воде и довести объем раствора до
500 мл. Молярная концентрация полученного раствора С (K2CO3) = = 0,79 моль/л.
Пример 2. Приготовить 1 л 0,1 н. раствора карбоната натрия (Na2CO3). Рассчитать процентную концентрацию полученного рас-твора. Плотность раствора  .
.
Так как 0,1 н. раствор º молярная концентрация эквивалента C [(1/2)Na2CO3] = 0,1 моль/л, можно рассчитать массу растворенного вещества в 1 л раствора 0,1 н.
1. Расчет массы Na2CO3: 1 л раствора соли содержит 0,1 моль эквивалентов Na2CO3
n [(1/2)] = C [(1/2)Na2CO3]∙ V = 0,1·1 = 0,1 моль.
М (Na2CO3) = 23·2 + 12 + 16·3 = 106 г/моль, z = 2,
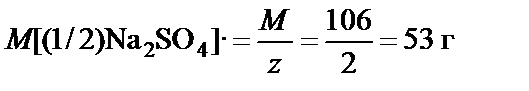 ,
,
m (Na2CO3) = M [(1/2)Na2CO3]· n [(1/2)Na2CO3] = 53·0,1 = 5,3 г.
2. Процентная концентрация полученного раствора

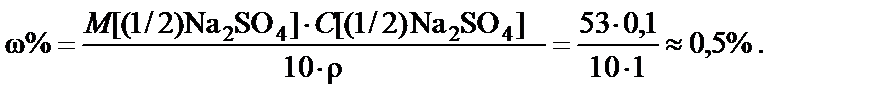
Вывод. Для приготовления заданного раствора навеску карбоната натрия m = 5,3 г растворить в воде и довести объем раствора до 1 л. Массовая доля Na2CO3 ω% = 0,5%.
Пример 3. Приготовить 200 мл 2 М раствора серной кислоты разбавлением 96% раствора с плотностью 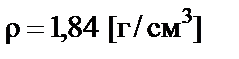 .
.
Так как 2М раствор ≡ молярная концентрация серной кислоты С (H2SO4) = 2 моль/л, следовательно, 1 л раствора кислоты содержит
2 моль H2SO4.
1. Масса растворенного вещества (H2SO4) в 200 мл 2 М раствора:
n (H2SO4) = С (H2SO4)· V = 2·0,2= 0,4 моль,
где V − объем раствора в литрах.
2. Масса серной кислоты:
m (H2SO4) = М (H2SO4)· n (H2SO4) = 98·0,4= 39,2 г,
где М (H2SO4) = 98 г/моль − молярная масса серной кислоты.
3. Масса раствора H2SO4 при ω% = 96%:
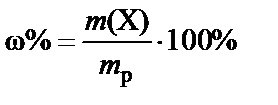 ®
® 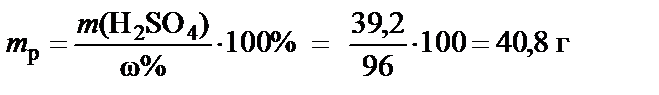 .
.
Объем раствора H2SO4 при ω% = 96%:
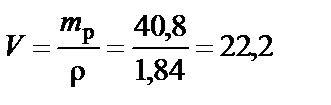 см3.
см3.
Вывод. Для приготовления заданного раствора 22,2 мл H2SO4 ω% = 96 % растворить в воде и довести объем раствора до 200 мл.
Данную задачу можно решить другим способом. Если перейти
от массовой концентрации к молярной 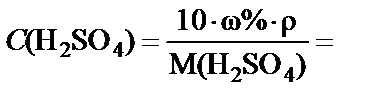 =
=  , то можно воспользоваться условием равенства количества молей серной кислоты в концентрированном и заданном растворе:
, то можно воспользоваться условием равенства количества молей серной кислоты в концентрированном и заданном растворе:
n (H2SO4) = С (H2SO4)1∙ V 1 = С (H2SO4)2∙ V 2
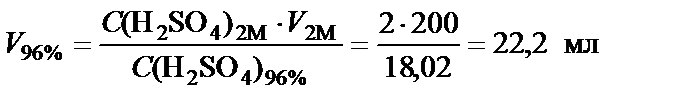 .
.
Пример 4. Приготовить 500 мл 10% раствора соляной кислоты 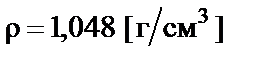 разбавлением концентрированного раствора ω% = = 35% с плотностью
разбавлением концентрированного раствора ω% = = 35% с плотностью 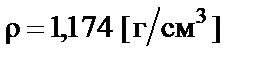 .
.
1. Масса раствора 10%
 .
.
2. Масса растворенного вещества (HCl)
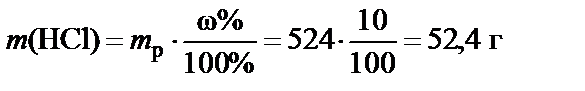 .
.
3. Масса раствора 35%
 ®
®  .
.
Объем раствора HCl ω% = 35 %
 см3.
см3.
Вывод. Для приготовления заданного раствора растворить 127,5 мл HCl с концентрацией ω% = 35 % в воде и довести объем раствора до 500 мл.
Расчеты концентраций
1.1. К раствору HCl (r = r(HCl)) объемом V (HCl) и массовой долей w%(HCl) добавили воду массой m (H2O). Определить w′%(HCl) в растворе.
| Вар. №
|
|
|
|
|
|
| V (HCl) (мл)
|
|
|
|
|
|
| w(HCl) %
|
|
|
|
|
|
| ρ(HCl) (г/см3)
| 1,059
| 1,079
| 1,110
| 1,121
| 1,142
|
| m (H2O) (г)
|
|
|
|
|
|
1.2. К раствору KCl объемом V (KCl) и молярной концентрацией C (KCl) добавили воду массой m (H2O) (r(H2O) = 1г/см3). Определить C ′(KCl) в растворе.
| Вар. №
|
|
|
|
|
|
| V (HCl) (мл)
|
|
|
|
|
|
| C (KCl)(моль/л)
|
| 1,5
| 1,2
| 0,8
| 0,5
|
| m (H2O) (г)
|
|
|
|
|
|
1.3. Какую массу растворов KNO3 c концентрациями w′% и w′′% надо взять для получения m (KNO3) г раствора соли с концентрацией w%?
| Вар. №
|
|
|
|
|
|
| w′(KNO3)%
|
|
|
|
|
|
| w′′(KNO3) %
|
|
|
|
|
|
| w(KNO3) %
|
|
|
|
|
|
| m (KNO3)(г)
|
|
|
|
|
|
1.4. Какой объем раствора H2SO4 (r = r(H2SO4)г/см3) с w% = = w(H2SO4)% надо взять для приготовления раствора кислоты объемом V мл и r = r′(H2SO4) г/см3 с w% = w′(H2SO4)%?
| Вар. №
|
|
|
|
|
|
| w (H2SO4)%
|
|
|
|
|
|
| ρ(H2SO4) (г/см3)
| 1,830
| 1,808
| 1,793
| 1,732
| 1,710
|
| w′(H2SO4)%
|
|
|
|
|
|
| ρ′(H2SO4)(г/см3)
| 1,190
| 1,224
| 1,273
| 1,342
| 1,399
|
| V ′(H2SO4) (мл)
|
|
|
|
|
|
1.5. Определить молярную концентрацию С (KOH) раствора гидроксида калия, полученного смешиванием раствора KOH объемом
V ′(KOH) и массовой долей w′(KOH)% (r = r′(KOH) г/см3) и раствора KOH (r = r′′(KOH) г/см3) объемом V ′′(KOH) и массовой долей w′′(KOH) %.
| Вар. №
|
|
|
|
|
|
| w′(KOH) %
|
|
|
|
|
|
| ρ′(KOH) (г/см3)
| 1,616
| 1,564
| 1,511
| 1,460
| 1,411
|
| V ′(KOH) (мл)
|
|
|
|
|
|
| w′′(KOH) %
|
|
|
|
|
|
| ρ′′(KOH) (г/см3)
| 1,118
| 1,065
| 1,100
| 1,048
| 1,082
|
| V ′(KOH) (мл)
|
|
|
|
|
|
1.6. Определить молярную концентрацию С (KOH) раствора гидроксида калия, полученного смешиванием раствора KOH объемом V ′(KOH) и молярной концентрацией С ′KOH и раствора KOH объемом V ′′(KOH) и молярной концентрацией С ′′(KOH).
| Вар. №
|
|
|
|
|
|
| C ′(KOH) (моль/л)
|
|
|
|
|
|
| V ′(KOH) (мл)
|
|
|
|
|
|
| C ′′(KOH) (моль/л)
|
|
|
| 0,5
| 0,5
|
| V ′(KOH) (мл)
|
|
|
|
|
|
2. Расчеты по реакциям
(стехиометрическое соотношение компонентов)
2.1. Какой объем раствора HNO3 (r = r(HNO3)г/см3 и массовой долей w(HNO3)) следует прибавить к фосфату кальция массой
m (Ca3 (PO4)2) для его растворения?
| Вар. №
|
|
|
|
|
|
| w(HNO3)
| 0,92
| 0,88
| 0,86
| 0,80
| 0,78
|
| ρ(HNO3) (г/см3)
| 1,496
| 1,486
| 1,480
| 1,460
| 1,453
|
| m (Ca3(PO4)2) (г)
|
|
| 9,3
| 6,2
| 3,1
|
2.2. Через раствор гидроксида бария с молярной концентрацией С (Ba(OH)2) и объемом V (CO2) пропустили инертный газ (при н.у.), содержащий СО2 с объемной долей φ = φ(CO2). Найти объем газовой смеси, необходимый для полного осаждения ионов бария.
| Вар. №
|
|
|
|
|
|
| V CO2(мл)
|
|
|
|
|
|
| С Ba(OH)2(моль/л)
|
| 1,5
| 1,2
|
|
|
| φCO2
| 0,9
| 0,8
| 0,7
| 0,6
| 0,5
|
2.3. Вычислить объем водорода, выделившегося при взаимо-действии с избытком цинка раствора серной кислоты концентрацией
w = w(H2SO4)% массой m = m (H2SO4) г.
| Вар. №
|
|
|
|
|
|
| w(H2SO4)%
|
|
|
|
|
|
| m (H2SO4) (г)
|
|
|
|
|
|
2.4. В раствор, содержащий сульфат серебра Ag2SO4 (в избытке), добавили V (KI) мл иодида калия, с молярной концентрацией С (KI). Найти массу образовавшегося иодида серебра (AgI).
| Вар. №
|
|
|
|
|
|
| С (KI) (моль/л)
| 1,0
| 1,4
| 1,2
| 2,0
| 1,5
|
| V (KI) (мл)
|
|
|
|
|
|
2.5. При пропускании сероводорода объемом V (H2S) л (н.у.) через избыток раствора сульфата меди (II) (CuSO4) образовался осадок сульфида меди массой m (CuS) г. Вычислить выход продукта в процентах от теоретически возможного.
| Вар. №
|
|
|
|
|
|
| m (CuS) (г)
| 44,16
| 22,8
| 8,16
| 12,96
| 15,36
|
| V (H2S) (л)
| 11,2
| 5,6
| 22,4
| 3,36
| 4,48
|
2.6. К m (CaO) г оксида кальция, содержащего ω % примесей, добавили избыток HCl и получили m (CaCl2) хлорида кальция. Вычислить массовую долю выхода продукта в процентах от теоретически возможного.
| Вар. №
|
|
|
|
|
|
| m (CaO) (г)
|
|
|
|
|
|
| ω %
|
|
|
|
|
|
| m (CaCl2)(г)
| 53,13
| 72,4
| 80,1
| 100,8
|
|
3. Расчеты по реакциям
(определение избытка одного из компонентов)
3.1. Смешали ω(MgSO4)%-ный раствор сульфата магния мас-
сой m (MgSO4)г и ω(BaCl2)%-ный раствор хлорида бария массой m (BaCl2) г. Вычислить массу сульфата бария получившегося в результате реакции.
| Вар. №
|
|
|
|
|
|
| ω(MgSO4)%
|
|
|
|
|
|
| m (MgSO4) (г)
|
|
|
|
|
|
| ω(BaCl2)%
|
|
|
|
|
|
| m (BaCl2)(г)
|
|
|
|
|
|
3.2. Вычислить объем углекислого газа СО2, получившегося при воздействии m (CH3COOH) уксусной кислоты, массовой долей ω(CH3COOH) на m (CaCO3) грамм карбоната кальция.
| Вар. №
|
|
|
|
|
|
| ω(CH3COOH)
| 0,20
| 0,24
| 0,15
| 0,09
| 0,12
|
| m (CH3COOH) (г)
|
|
|
|
|
|
| m (CaCO3) (г)
|
|
|
|
|
|
3.3. Кислым или щелочным будет раствор, полученный при смешивании m (H3PO4) ω (H3PO4)%-го раствора ортофосфорной кислоты с m (KOH) г ω(KOH)%-го раствора гидроксида калия?
| Вар. №
|
|
|
|
|
|
| ω(H3PO4) %
|
|
|
|
|
|
| m (H3PO4) (г)
|
|
|
|
|
|
| ω(KOH) %
|
|
|
|
|
|
| m (KOH) (г)
|
|
|
|
|
|
3.4. Кислым или щелочным будет раствор, полученный при смешивании V (H2SO4) мл раствора серной кислоты (ω = ω(H2SO4),
ρ = ρ(H2SO4)г/см3) с V LiOH мл раствором гидроксида лития молярной концентрацией СM = С (LiOH)М?
| Вар. №
|
|
|
|
|
|
| V (H2SO4)(г)
|
|
|
|
|
|
| ω(H2SO4)
| 0,04
| 0,08
| 0,06
| 0,01
| 0,02
|
| ρ(H2SO4)(г/см3)
| 1,027
| 1,055
| 1,04
| 1,069
| 1,083
|
| С (LiOH) (М)
| 2,5
| 1,2
|
|
|
|
| V (LiOH) (мл)
|
|
|
|
|
|
3.5. Какая соль получится при действии m (NaOH) раствора NaOH (ω% = ω(NaOH) %) на ортофосфорную кислоту объемом m (H3PO4) и массовой долей ω H3PO4%? Вычислить массу образовавшейся соли.
| Вар. №
|
|
|
|
|
|
| ω(H3PO4) %
|
|
|
|
|
|
| m (H3PO4) (г)
|
|
|
|
|
|
| ω (NaOH) %
|
|
|
|
|
|
| m(NaOH) (г)
|
|
|
|
|
|
3.6. Какая соль получится при смешивании V (H2SO4) мл раствора серной кислоты (ω = ω(H2SO4), ρ = ρ(H2SO4) г/см3) с V (KOH) мл раствором гидроксида калия молярной концентрацией СM = С (KOH)? Вычислить массу образовавшейся соли.
| Вар. №
|
|
|
|
|
|
| V (H2SO4) (мл)
|
|
|
|
|
|
| ω(H2SO4)
| 0,04
| 0,08
| 0,06
| 0,1
| 0,12
|
| ρ(H2SO4) (г/см3)
| 1,027
| 1,055
| 1,04
| 1,069
| 1,083
|
| С (KOH)
| 0,6
| 0,5
| 0,8
| 0,3
| 0,5
|
| V (KOH) (мл)
|
|
|
|
|
|
Ответы на задачи
| Задача
| Вари-ант
| Ответ
|
| Задача
| Вари-ант
| Ответ
|
| Задача
| Вари-ант
| Ответ
|
| 1.1
|
| 0,1
| 2.1
|
| 54,9
| 3.1
|
| 4,08
|
|
| 0,13
|
| 28,9
|
| 4,66
|
|
| 0,19
|
| 8,9
|
| 5,83
|
|
| 0,21
|
| 6,5
|
| 6,99
|
|
| 0,24
|
| 3,34
|
| 6,99
|
| 1.2
|
| 1,25
| 2.2
|
| 12,4
| 3.2
|
| 2,24
|
|
| 1,25
|
| 16,8
|
| 1,793
|
|
|
|
| 19,2
|
| 1,4
|
|
| 0,64
|
| 67,2
|
| 0,672
|
|
| 0,33
|
| 156,8
|
| 0,672
|
| 1.3
|
| 300;100
| 2.3
|
| 0,48
| 3.3
|
| кислая
|
|
| 400;300
|
| 0,96
|
| кислая
|
|
| 200;100
|
| 0,96
|
| кислая
|
|
| 400;200
|
| 2,56
|
| щелочн.
|
|
| 600;200
|
| 2,4
|
| щелочн.
|
| 1.4
|
| 55,1
| 2.4
|
| 4,7
| 3.4
|
| щелочн.
|
|
| 148,6
|
| 9,87
|
| кислая
|
|
| 133,4
|
| 11,28
|
| кислая
|
|
| 255,7
|
| 23,5
|
| щелочн
|
|
| 367,1
|
| 21,15
|
| кислая.
|
| 1.5
|
| 12,15
| 2.5
|
|
| 3.5
|
| 4,32
|
|
| 9,32
|
|
|
| 4,32
|
|
| 7,65
|
|
|
| 10,8
|
|
| 5,26
|
|
|
| 8,4
|
|
| 4,38
|
|
|
|
|
| 1.6
|
| 4,5
| 2.6
|
|
| 3.6
|
| 2,92
|
|
| 4,4
|
|
|
| 4,49
|
|
|
|
|
|
| 5,54
|
|
| 1,9
|
|
|
| 11,39
|
|
| 3,35
|
|
|
| 18,46
|
Библиографический список
1. Киселев, А.П. Крашенинников А.А. Основы общей химии: учебное пособие / Балт. гос. техн. ун-т. СПб., 2012. 339 с.
2. Глинка, Н.Л. Общая химия: учебное пособие. М.: КноРус, 2016. 752 с.
3. Лебедев, В.Н., Фатина А.А. Аналитическая химия: учебно-практическое пособие / Балт. гос. техн. ун-т. СПб., 2014.
О г л а в л е н и е
Принятые обозначения.. 3
Основные понятия.. 3
Характеристики количества вещества в химии. 4
Количественные соотношения реагирующих веществ. 6
Концентрация. 7
Переход от одних способов выражения концентраций к другим.. 10
Решение задач.. 11
Приготовление растворов. 11
Расчет количества реагентов, вступающих в химические реакции. 15
Расчеты с использованием закона эквивалентов. 19
Варианты задач для самостоятельного решения.. 24
1. Расчеты концентраций. 24
2. Расчеты по реакциям (стехиометрическое соотношение компонентов) 26
3. Расчеты по реакциям (определение избытка одного из компонентов) 27
Ответы на задачи. 29
Библиографический список. 29
Киселев Алексей Петрович, Фатина Александра Анатольевна,
Барунин Анатолий Анатольевич
Стехиометрические расчеты
Редактор Г.М. Звягина
Корректор Л.А. Петрова
Компьютерная верстка: Н.А. Андреева
Подписано в печать 11.05.2017. Формат 60×84/16. Бумага документная.
Печать трафаретная. Усл. печ. л 1,75. Тираж 100 экз. Заказ № 68
Балтийский государственный технический университет
Типография БГТУ
190005, С.-Петербург, 1-я Красноармейская ул., д. 1
СТЕХИОМЕТРИЧЕСКИЕ
Расчеты
Министерство образования и науки Российской Федерации
Балтийский государственный технический университет «Военмех»
Кафедра «Технология конструкционных материалов
и производства ракетно-космической техники»
а.п. КИСЕЛЕВ, а.а ФАТИНА, А.А. Барунин
СТЕХИОМЕТРИЧЕСКИЕ
расчеты
Практическое пособие
Санкт-Петербург
УДК 542.3.021(076)
| Киселев, А.П.
Стехиометрические расчеты: практическое посо-бие / А.П. Киселев, А.А. Фатина, А.А. Барунин; Балт. гос. техн. ун-т.– СПб., 2017. – 30 с.
Приведены основные понятия, определения и обозначения физико-химических величин задачи разной степени сложности и методика их решения, а также варианты задач для самосто-ятельного решения.
Предназначено для студентов технических специальностей, изучающих курс «Химия».
|
К44
УДК 542.3.021(076)
Р е ц е н з е н т д-р техн. наук, проф. Л.П. Юнаков
Утверждено
редакционно-издательским
советом университета
© БГТУ, 2017
© Авторы, 2017
Принятые обозначения
| Мr (Х)
| −
| относительная молекулярная масса молекулы вещества Х
|
| М (Х)
| −
| молярная масса вещества Х, 
|
| n (X)
| −
| количество вещества Х, [моль]
|
| n [(1/ z)Х]
| −
| количество вещества эквивалентов Х, [моль]
|
| M [(1/ z)X]
| −
| молярная масса эквивалента вещества Х, [г/моль]
|
| z (Х)
| −
| число эквивалентности
|
| m (X)
| −
| масса вещества Х, г
|
| V (X)
| −
| объем вещества Х, л, мл
|
| VМ
| –
| объем одного моля идеального газа, л/моль
|
| C (X)
| −
| молярная концентрация вещества Х,
|
| С [(1/ z)Х]
| −
| молярная концентрация эквивалента вещества Х, 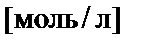
|
| ω, ω%
| −
| массовая доля вещества Х в растворе
|
| В (X)
| −
| моляльная концентрация вещества Х, 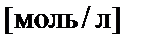
|
| ρ
| −
| плотность раствора, 
|
Буквой X обозначен химический символ вещества.
Основные понятия
В результате протекания химической реакции исходные вещества – реагенты − превращаются в продукты реакции. Стехиометрия − раздел химии, рассматривающий количественные соотношения меж-ду реагирующими веществами. Расчеты, связанные с определением массовых или объемных соотношений между реагирующими и полу-чаемыми в результате необратимой (полностью протекающей в од-ном направлении) реакции веществами, называются стехиометриче-скими. Их теоретической основой являются закон сохранения массы и закон постоянства состава. В реальных химических процессах в результате неполного протекания реакции (кинетически обратимые реакции) или протекания неосновных реакций количество (масса, объем) продуктов обычно меньше теоретически рассчитанного.
Точные данные о количественных соотношениях между реаги-рующими и получаемыми в результате реакции веществами содержит правильно написанное уравнение химической реакции. Стехиометрические коэффициенты (коэффициенты перед формулами) соответствуют числу молей реагирующих веществ.
Количество вещества можно характеризовать их массой (m) или объемом (V). В химии единицей измерения массы обычно служит грамм (г) и кратные ему величины, а единицей измерения объема − литр (л ≡ дм3) или миллилитр (мл ≡ см3). Количество твердых веществ удобно характеризовать их массой, а газов и жидкостей − объемом.
Характеристики количества вещества в химии
Атомная единица массы (а.е.м.) − 1/12 массы атома изотопа углерода 12С (1 а.е.м. = 1,6605·10−27 кг). В Периодической системе эле-ментов указаны относительные атомные массы (Ar) – безразмерные величины, показывающие, во сколько раз масса данного атома больше 1/12 массы атома углерода 12С.
Относительная молекулярная масса вещества (Mr) − сумма отно-сительных атомных масс (Ar) элементов, входящих в состав молекулы.
П р и м е р. Ar (Н) = 1; Ar (O) = 16; Ar (S) = 32; Ar (Na) = 23;
Mr (H2O) = 2∙1 + 1·16 = 18; Mr (H2SO4) = 2∙1 + 1·32 + 4∙16 = 98;
Mr (NaOH) = 1·23 + 1∙1 + 1·16 = 40.
Количество вещества в молях. Моль − количество вещества, ко-торое содержит столько формульных единиц (атомов, молекул, ионов или других частиц), сколько атомов содержится в 12 г изотопа 12C. Моль любого вещества содержит одинаковое число частиц, равное числу Авогадро (NА): 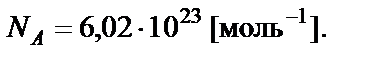
Молярная масса (М (Х) г/моль) − масса одного моля вещества Х в граммах. Численно совпадает с относительной молекулярной Mr (атомной Ar) массой данного вещества.
П р и м е р. Mr (H2O) = 18 ® M(H2O) = 18 г/моль;
Mr (H2SO4) = 98 ® M (H2SO4) = 98 г/моль.
Молярный объем газа (VМ) − объем одного моля газа. Моль лю-бого газообразного вещества при нормальных условиях (T = 273 K и
р = 1013 гПа) занимает объем 22,4 л (VМ = 22,4 л/моль).
Количество вещества в молях можно рассчитать делением массы образца в граммах (m) на молярную (атомную) массу данного вещества или объема газа в литрах на молярный объем:

 .
.
Количество вещества в эквивалентах. Эквивалент − реальная или условная частица, которая может




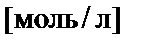
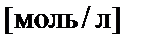

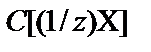 , моляльная концентрация (В (X)).
, моляльная концентрация (В (X)).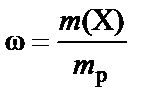 или
или  .
.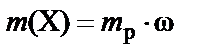 или
или  .
.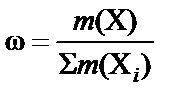 используют мольную
используют мольную 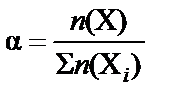 или объемную долю
или объемную долю  .
.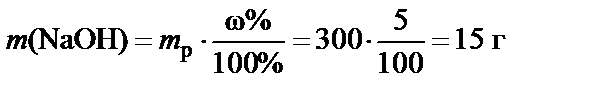 .
.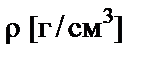 .
.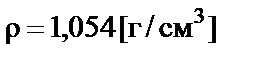 .
.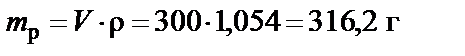 ;
;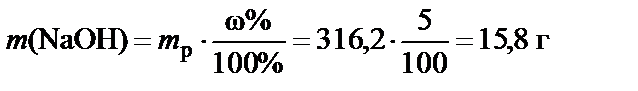 .
.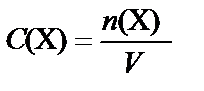 [моль/л].
[моль/л]. .
. = 0,1 моль/л обозначается C н(1/ z) = 0,1 моль/л (0,1 н. рас-твор), где z – эквивалентное число. Например, для перманганата калия в окислительно-восстановительных реакциях С (1/5 КMnO4) º C н (1/5) [моль/л].
= 0,1 моль/л обозначается C н(1/ z) = 0,1 моль/л (0,1 н. рас-твор), где z – эквивалентное число. Например, для перманганата калия в окислительно-восстановительных реакциях С (1/5 КMnO4) º C н (1/5) [моль/л].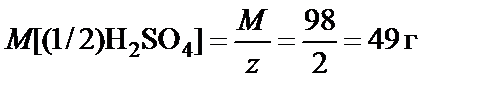 ;
;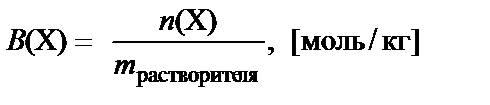 .
.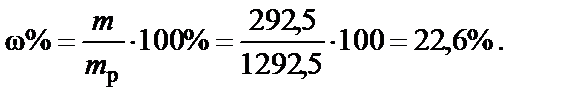
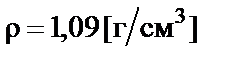 . Рассчитать молярную концентрацию полученного раствора.
. Рассчитать молярную концентрацию полученного раствора.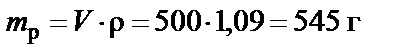 .
.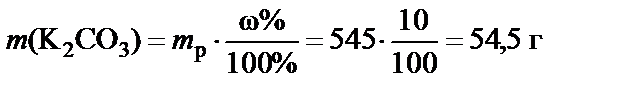 .
.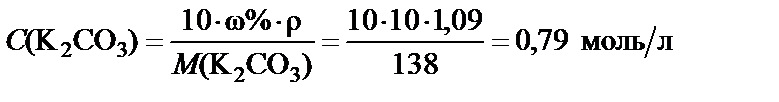 ,
, .
.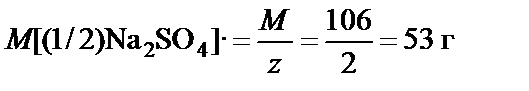 ,
,
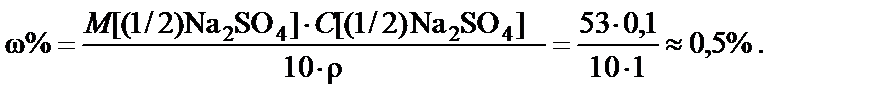
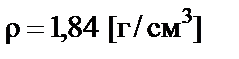 .
.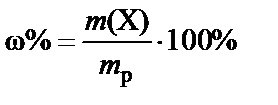 ®
® 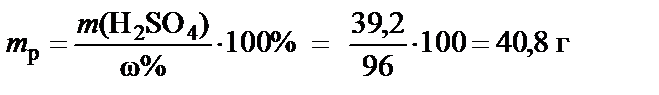 .
.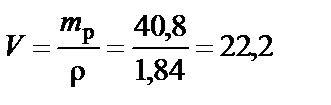 см3.
см3.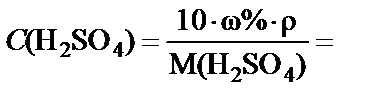 =
=  , то можно воспользоваться условием равенства количества молей серной кислоты в концентрированном и заданном растворе:
, то можно воспользоваться условием равенства количества молей серной кислоты в концентрированном и заданном растворе: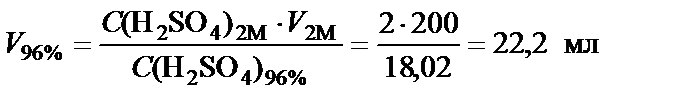 .
.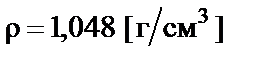 разбавлением концентрированного раствора ω% = = 35% с плотностью
разбавлением концентрированного раствора ω% = = 35% с плотностью 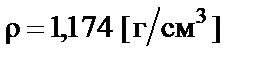 .
. .
.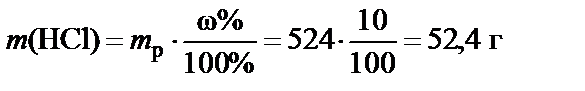 .
. ®
®  .
. см3.
см3.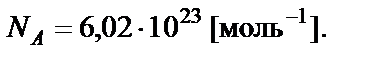

 .
.


