

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Аура как энергетическое поле: многослойную ауру человека можно представить себе подобным...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Электрохимическая коррозия является следствием возникновения коррозионных гальванических микроэлементов (коррозионных гальванических пар), состоящих из катодных и анодных участков. Появление катодных и анодных участков на поверхности металлов происходит по следующим причинам:
– неоднородность поверхности металла вследствие включений иной природы, ударов и изгибов, накопления примесей на границах зерен, участков с разной степенью обработки и т.д.;
– неоднородность жидкой фазы, в которой происходит коррозия из-за различия концентрации ионов, рН среды, неравномерного доступа кислорода или других окислителей;
– различие внешних условий: температуры, давления, действия электрического поля и т.д.
Коррозия, как любой химический процесс, обладает определенной скоростью. При контакте металла с электролитом на металле устанавливается равновесный потенциал, определяемый уравнением Нернста. Если подать внешнее напряжение, то потенциал электрода увеличится. Это изменение электродного потенциала называется электродной поляризацией. Поляризация способствует уменьшению коррозии. Если изменить ход процесса, увеличив скорость его протекания, то произойдет уменьшение электродного потенциала по сравнению с равновесным; процесс, обусловливающий его, называют деполяризацией, и он способствует увеличению скорости коррозии.
При возникновении коррозионного гальванического микроэлемента процесс электрохимической коррозии можно представить состоящим из четырёх стадий.
1. Окисление той части металла, которая имеет меньшее значение электродного потенциала; эта часть в коррозионном гальваническом микроэлементе является анодом.
|
|
2. Перенос заряда электронами (или, говоря проще, переход электронов) по металлу от анодного к катодному участку.
3. Перенос заряда ионами в электролите.
4. Восстановление окислителя на катодном участке поверхности металла.
При электрохимической коррозии наиболее распространенными окислителями являются растворённый в щелочных растворах кислород и катионы водорода в кислой среде.
Растворенный в воде и щелочных растворах кислород восстанавли-вается на катодных участках металла по уравнению:
О2 + 4е + 2Н2О = 4ОН-
Таким образом, здесь деполяризация осуществляется за счет растворенного кислорода и ускорение разрушения металла осуществляется за счет коррозии с кислородной деполяризацией.
Катионы водорода в кислых растворах (кислород в кислой среде не растворяется) восстанавливаются по уравнению:
2Н+ + 2е = Н2
Здесь деполяризация происходит за счет ионов водорода и ускорение разрушения металла осуществляется за счет коррозии с водородной деполяризацией.
Катодные и анодные участки в металлах чередуются и имеют очень малые размеры, т.е. речь идет о микроанодах и микрокатодах и, как указывалось выше, о коррозионных гальванических микроэлементах. Таким образом, электрохимическая коррозия заключается в работе огромного числа гальванических микроэлементов, при которой происходит анодное окисление металла.
Коррозионный гальванический микроэлемент, в отличие от обычного гальванического элемента, является короткозамкнутым микроэлементом. Форма его записи не отличается от записи электрохимической схемы обычного гальванического элемента, но для сокращения в ней не указывают окисленную форму. Например, коррозия железа в контакте с углеродом (обычная углеродистая сталь) во влажной атмосфере происходит в результате возникновения гальванических микроэлементов, анодными участками которых является металл, а катодными – включения углерода
|
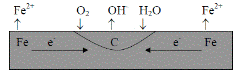
|
|
Полная и сокращенная форма записи такого элемента имеют вид:
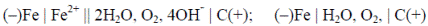
Коррозия железа является результатом работы этого элемента. При коррозии железа идут следующие процессы:
анодное окисление: Fe – 2e = Fe2+
катодное восстановление: O2 + 2H2O + 4e = 4OH-
общее уравнение коррозии: 2Fe + O2 + 2H2O = 2Fe(OH) 2
Контактная коррозия
Коррозия металла ускоряется или замедляется при его контакте с другими металлами.
Ускорение коррозии происходит при контакте металла с менее активным металлом, расположенном в ряду электрохимической активности металлов правее, так как в этом случае данный металл в коррозионной гальванической паре становится анодом

При контакте металла с более активным металлом коррозия основного металла наоборот замедляется, так как в коррозионной гальванической паре этот металл является катодом.

Именно по этой причине кровельное железо покрывают более активным металлом цинком, а не оловом или медью.
Защита от коррозии
Применяются различные способы защиты металлов от коррозии.
Легирование металлов. Легированием металлов называется процесс введения в их состав других металлов, то есть получение сталей и сплавов, обладающих высокой устойчивостью против коррозии. Наиболее распространено легирование хромом, никелем и титаном.
В химическом машиностроении широко применяется нержавеющая сталь Х18Н9Т, в состав которой входит хром (18 %) а, никель (9 %), титан (около 1 %), железо (остальное). На поверхности этой стали образуется тонкая пленка сложного оксида NiO·Cr2O3 со структурой шпинели, обладающая высокой устойчивостью к действию воды и кислот.
Металлические покрытия. Для покрытия малостойких против коррозии металлов применяют металлы, образующие на своей поверхности защитные пленки. К таким металлам относятся хром, никель, алюминий, цинк, кадмий, олово и др. Покрытия наносят распылением расплавленного металла, электролизом, химическим осаждением и другими методами.
Неметаллические покрытия. Они подразделяются на неорганические и органические. Самыми распространенными неорганическими покрытиями являются оксидные, фосфатные и нитридные пленки на по-верхности металлов, а органические – лаки, краски, полимеры и резина.
|
|
Химическое пассивирование. Пассивированием металлов называет-ся процесс образования на их поверхности устойчивых к коррозии оксидных плёнок. Такие защитные плёнки образуются, например, при обработке некоторых металлов (железа, алюминия, хрома, ванадия и др.) концентрированной азотной и концентрированной серной кислотами.
Электрохимическая защита. Она применяется в тех случаях, когда защищаемая конструкция находится в среде электролита: корпус морского судна, трубопровод на дне реки или под землей и т.д. Защищаемый металл присоединяется к отрицательному полюсу внешнего источника постоянного тока, и он становится катодом. В качестве анодов используются куски железного лома. В этом случае процесс окисления (коррозия) идет на аноде, т.е. на кусках железного лома.
Применение ингибиторов коррозии. Ингибиторами называются вещества, добавление которых в коррозионную среду в незначительных количествах заметно снижает скорость коррозии. Ингибиторами явля-ются различные неорганические соединения (нитрит натрия, хромат и дихромат калия, фосфат и гидрофосфаты натрия) и многие органические вещества. Защитное действие ингибиторов обусловлено тем, что их молекулы или ионы адсорбируются на поверхности металлов, замедляя или полностью прекращая процесс их анодного окисления.
Экспериментальная часть
Целью работы является исследование влияния природы металла, среды и внешних условий на процессы коррозии металлов и ознакомление со способами их защиты от коррозии.
Опыт 1. Химическая и электрохимическая коррозия цинка
В пробирку с 8–10 каплями раствора серной кислоты опустить гранулу цинка. Отметить образование пузырьков газа на поверхности гранулы. Написать уравнение реакции взаимодействия цинка с кислотой. В ту же пробирку опустить медную проволоку и коснуться ею гранулы цинка. Что изменилось? Какую функцию выполняет медная проволока?
Написать схему коррозионного медно-цинкового гальванического микроэлемента и схемы анодного и катодного процессов при его работе.
Опыт 2. Влияние концентрации окислителя на скорость коррозии
В пробирку с 5 каплями серной кислоты добавить 5 капель воды, т.е. разбавить раствор в два раза. Проделать опыт, аналогичный опыту 1. Сделать вывод о влиянии концентрации Н+-ионов на скорость коррозии.
|
|
Опыт 3. Влияние на коррозию природы защитного покрытия
Две пробирки наполнить на 1/2 их объема дистиллированной водой. Добавить в каждую из них по 2–3 капли серной кислоты и по 2–3 капли раствора гексацианоферрата (III) калия К3[Fe(CN)6]. Он является качественным реактивом на ионы Fe2+, с которыми образует синее окрашивание (турнбулева синь). В одну пробирку опустить железную полоску, в которой зажата гранула цинка, а в другую – железную полоску, в которой зажата гранула олова. Первая пробирка имитирует коррозию оцинкованного железа, а вторая – лужёного, т.е. покрытого оловом.
Отметить, в какой пробирке появляется синее окрашивание.
В отчёте составить схемы коррозионных гальванических микро-элементов и написать уравнения анодных и катодных процессов. Объяснить, какое из покрытий является катодным, а какое – анодным. Какое из них и почему защищает железо от коррозии, а какое не защищает?
Опыт 4. Защита металла от коррозии с помощью протектора
В две пробирки с разбавленным раствором уксусной кислоты прибавить несколько капель раствора йодида калия. В одну из них опустить полоску свинца, а в другую – полоску свинца с зажатой в ней гранулой цинка. Отметить, в какой пробирке раньше появляется малорастворимое соединение PbI2, объяснить причину его появления в растворе. Написать уравнение взаимодействия свинца с уксусной кислотой, нарисовать схему коррозионного гальванического микроэлемента. Написать схемы анодного и катодного процессов. Указать, какую роль выполняет прижатая к свинцу гранула цинка в процессе коррозии свинца.
Опыт 5. Сравнение коррозии железа и легированной стали
В две пробирки с серной кислотой опустить: в одну – полоску обычной стали, в другую – легированной (нержавеющей) стали Х18Н9Т. Сравнить скорость коррозии. В отчёте объяснить устойчивость к коррозии легированной стали.
Опыт 6. Защита металла от коррозии химическим пассивированием
Очистить наждачной бумагой две стальные проволочки (разогнутые канцелярские скрепки). Одну из них опустить в пробирку с концентрированным раствором азотной кислоты. Записать наблюдения. Ополоснуть проволоку водой и вновь опустить в пробирку с азотной кислотой. Промыть пассивированную проволоку и опустить в пробирку с разбавленной серной кислотой. Для сравнения опустить вторую необработанную проволоку в тот же раствор серной кислоты. Сравнить скорость выделения водорода на проволочках.
Описать опыт. В выводе отметить роль оксидной пленки, образовавшейся на поверхности железа при его обработке азотной кислотой.
|
|
Опыт 7. Защита металла от коррозии пленкой оксида, полученной при термообработке
Очистить наждачной бумагой две стальные проволочки. Одну из них нагреть в пламени спиртовки до появления цветов побежалости, то есть до появления оксидной пленки цвета «воронова крыла». Эта операция в технике получила название «воронение». Опустить обе проволоки в пробирки с раствором сульфата меди (II). Описать наблюдения и составить уравнения реакции железа с раствором CuSO4. По скорости появления меди на поверхности проволоки оценить защитные свойства оксидной пленки, полученной при воронении.
Опыт 8. Коррозия алюминия при удалении с него защитной оксидной пленки
Некоторые активные металлы, например Al, Cr, Mn, устойчивы к коррозии из-за образования на их поверхности защитных оксидных пленок. При нарушении прочности оксидной пленки такие металлы активно взаимодействуют с окислителями. Наиболее показательным в этом отношении металлом является алюминий.
Разрушить оксидную пленку на поверхности алюминия можно, обработав её раствором какой-либо соли ртути. Ионы ртути из раствора частично восстанавливаются до металла. Образовавшаяся металлическая ртуть растворяет поверхностный слой алюминия, образуя амальгаму алюминия. Амальгама алюминия приобретает положительный электрический потенциал по отношению к чистому алюминию. Таким образом, образуется коррозионный гальваническая микроэлемент, в котором анодом является алюминий, а катодом – амальгама алюминия. В результате происходит интенсивная коррозия алюминия, которую можно наблюдать как в воде, так и на воздухе. При действии воды наблюдается выделение водорода, а на воздухе образуется рыхлый слой оксида алюминия.
Ход опыта. Полоску алюминиевой фольги на несколько секунд поместить в раствор соли двухвалентной ртути, затем ополоснуть водой и осушить с помощью фильтровальной бумаги. Наблюдать, как происходит коррозия алюминия на воздухе. Затем опустить полоску в воду и наблюдать за процессом коррозии алюминия в воде.
В отчете описать ход опыта и наблюдения. Написать уравнения реакций: 1) взаимодействия алюминия с солью ртути; 2) окисления алюминия на воздухе; 3) взаимодействия алюминия с водой.
Дополнительные задания к лабораторной работе
1. Приведите примеры газовой, или химической коррозии металлов.
2. Какой металл разрушается при электрохимической коррозии в микрогальванопаре: Fe или Mg, Fe или Cd, Fe или Ni?
3. Какие процессы происходят при повреждении поверхностного слоя никелированного железа?
4. Какие металлы используются для протекторной защиты железных изделий от коррозии?
5. Какое железо называется лужёным, а какое оцинкованным?
6. Какие процессы протекают на катоде и аноде при коррозии оцинкованного железа в сернокислой среде?
7. Какая операция в технике получила название «воронение» стали?
8. Какими металлами легирована нержавеющая сталь Х18Н9Т?
Часть II
НЕОРГАНИЧЕСКАЯ ХИМИЯ
Лабораторная работа 1.
Тема: ВОДОРОД
Водород в виде простого вещества получали (действием кислот на металлы) еще в XVI в. (Парацельс и другие исследователи). Причем, за способность гореть и взрываться назвали его «горючим воздухом». Лишь в 1799 г. А. Лавуазье (изучавший состав воды, вытесняя из нее водород с помощью раскаленного железа и снова синтезируя воду сжиганием H2) дал ему современное название «гидроген», что в переводе с греческого значит «воду рождающий» («водород») и отнес его к «простым телам» (т.е. к простым веществам).
Отметим, что указанный способ получения H2 из воды, предложенный Лавуазье, до сих пор иногда применяют в промышленности.
В современных лабораториях берут водород из баллонов, а также вытесняют его из кислот (HCl, H2SO4(разб.)) действием цинка. Можно использовать и любой другой металл (М), имеющий E0 (Mn+/M0) <0 (термодинамический фактор), если на его поверхности не образуется пассивирующая пленка (кинетический фактор).
Пассивирующая пленка может возникать за счет взаимодействия М с окружающей средой (например, с компонентами воздуха), или на начальной стадии растворения М (часто в первые мгновения процесса). Подчеркнем, что пленка является пассивирующей, если она не только малорастворима в жидкой фазе системы, но и является достаточно плотной, чтобы препятствовать проникновению реагентов через нее к поверхности металла.
Так, в нейтральной водной среде, где a (H+) = 10 7 моль/л (при 220С), водород должны восстанавливать металлы, редокс-потенциал которых ниже соответсвующего потенциала воды (E0(H2O/H2) = -0,41 В). Это Ca, Mg, Na и т.п., но, например, Zn (E0 = -0,76 B) с водой практически не реагирует вследствие формирования на его поверхности достаточно плотной нерастворимой в воде пленки продукта окисления цинка.
В тоже время гидроксиды М(OH)2, образующиеся при взаимодействии Ca или Mg с водой, получаются в виде достаточно рыхлых осадков, поэтому не препятствуют протеканию данных реакций, хотя в той или иной степени тормозят их.
Очевидно, если пассивирующую пленку убирать по мере ее образования (например, соскабливая с поверхности металла - механический способ), то можно осуществить практически полностью процесс взаимодействия М с водой.
Другой способ удаления пленки - химический. Так, в щелочной среде в случае амфотерных М пленка исчезает за счет взаимодействия ее со щелочью. Но при этом М восстановливает водород воды только, если выполняется условие: E0 ([M(OH)n]m /M0) < -0,83 В. (E0 (H2O/H2) =-0,83 в щелочной среде при рН = 14.) Например, E0([Al (OH)6]3 / Al0) = -2,35 В, поэтому Al растворяется в щелочи.
Собирать выделяющийся водород удобно в перевернутый сосуд (так как H2 много легче воздуха), а еще лучше в сосуд, заполненный водой (рис. 1), поскольку растворимость водорода в ней незначительна.
Несмотря на устойчивость молекул H2 (Eатомизации = 436 кДж/моль) термодинамическая активность водорода высока за счет образования достаточно прочных связей Н с другими элементами.
Электроотрицательность (Э.О.) водорода имеет среднее значение (2,1 по шкале Полинга), поэтому H2 проявляет как окислительные свойства (по отношению к ЩМ, щелочноземельным металлам (ЩЗМ), редкоземельным металлам (РЗМ) и т.п.), так и восстановительные (в реакциях с оксидами достаточно малоактивных М; с кислородом и др.).
Причем смеси H2 с O2 (а также с кислородом воздуха) от 6 до 67% (об.) по H2 - взрывоопасны. (Максимальной взрывной силой обладает т.н. «гремучий газ», содержащий стехиометрические соотношения данных газов.)
В то же время струя чистого водорода (без О2) спокойно горит (голубоватым пламенем) на воздухе или в чистом кислороде с образованием воды. (При охлаждении пламени, например, внесением в него льда, восстановление O2 идет менее полно - лишь до пероксида H2O2.)
Отметим, что химическая активность атомарного водорода (“Н”): и термодинамическая (E0 (H+ /"H") = -2,1 В), и кинетическая (ибо “Н” является радикалом), - много выше молекулярного, так как при использовании H2 большая часть энергии тратится на разрыв связи H-H. (Даже при 25000С атомизируются только 0,13% H2 и лишь при 50000С - 95%).
Теоретически атомарный водород в очень чистом состоянии без соприкосновения со стенками сосуда может существовать неограниченно долго, поскольку при соударении двух атомов “Н” образуется молекула H2 с избытком энергии, которая тут же распадается. Реально же энергия отдается частицам примеси или стенкам сосуда, поэтому половина “Н” комбинируется в молекулы всего за 1/3 секунды.(При наложении сильного магнитного поля это время заметно увеличивается.)
В химии, чтобы осуществить реакцию какого-либо вещества с атомарным водородом, помещают это вещество в реакционную зону образования “Н”, например, в зону реакции Zn с кислотой. Таким образом можно осуществить при об.у. взаимодействие “Н” с O2 (с образованием H2O2), с Cl2 (даже в темноте), с Br2, I2, восстановить концентрированную H2SO4 и др.
|
|
|

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!