

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...
Топ:
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Приблизительное значение теплоемкости калориметра может быть вычислено по формуле (2). Для этого внутренний стакан калориметра взвешивается на технохимических весах, рассчитанных на максимальную нагрузку до 500 г, а удельная теплоемкость стекла, из которого изготовлен стакан, принимается равной 0,78 Дж/(г·К).
Опыт 2. Определение теплоты реакции гашения извести
Реакцией гашения извести называется взаимодействие оксида кальция с водой, которое сопровождается выделением тепла и описывается уравнением
CaO(к) + H2O(ж) = Ca(OH)2(к)
Ход опыта.
1. Во внутренний стакан калориметра налить 100 мл воды, выдержанной в комнате, температуру воды записать (Т).
2. На технохимических или электронных весах взять навеску оксида кальция от 5 до 10 г.
3. Всыпать оксид кальция в калориметр. Постоянно перемешивая, через каждую минуту замерять температуру и записывать её в таблицу, такую же, как в опыте 1.
В ходе опыта наблюдается три периода: 1) температура повышается, так как идет экзотермическая реакция; 2) температура на некоторое время стабилизируется; 3) температура понижается из-за рассеивания тепла. Для вычисления брать температуру второго периода.
Ход вычислений.
1. Вычислить количество тепла, выделившегося в калориметре по формуле
Q = К·ΔT = К·(θ – T),
где К – теплоемкость калориметра, определенная в опыте 1 (или вычисленная); θ – температура второго периода.
2. Исходя из молярной массы и навески оксида кальция, пересчитать полученный результат на тепловой эффект реакции, обозначив его ΔН0оп («дельта аш нулевое опытное») и выразив его в кДж/моль.
3. Исходя из энтальпии образования оксида кальция (-635,5 кДж/моль), воды (-285,3 кДж/моль) и гидроксида кальция (-986,6 кДж/моль), вычислить теоретическое значение теплового эффекта реакции ΔН0теор.
4. Вычислить погрешность опыта (в %) по формуле

В выводе указать на возможные причины погрешности.
Опыт 3. Определение теплоты реакции нейтрализации
Реакцией нейтрализации называется взаимодействие сильных кислот со щелочами, которое описывается одним и тем же ионным уравнением образования воды. Например:
HCl + NaOH = NaCl + H2O H+ + OH-= H2O
HNO3 + KOH = KNO3 + H2O H+ + OH-= H2O
По этой причине теплота нейтрализации не зависит от состава кислот и щелочей и всегда равна одной и той же величине –57,2 кДж/моль.
Ход опыта.
1. Получить у лаборанта однонормальные растворы кислоты и щелочи, выдержанные при комнатной температуре; температуру (Т) записать.
2. Отмерить мерным цилиндром 50 мл кислоты и налить ее в калориметр.
3. Отмерить с помощью другого мерного цилиндра 50 мл раствора щелочи, влить его через воронку в кислоту и перемешать. Наблюдать изменение температуры и записывать её значения в таблицу, такую же, как в опытах 1 и 2. В ходе опыта наблюдается три периода: 1) температура повышается, так как идет экзотермическая реакция нейтрализации; 2) температура стабилизируется и некоторое время остается постоянной; 3) температура понижается из-за рассеивания тепла. Для вычисления брать температуру второго периода, обозначив её θ.
Ход вычислений.
1. Вычислить количество тепла, выделившегося в калориметре, по формуле
Q = К·ΔT = К·(θ – T),
где К – теплоемкость калориметра, определенная в опыте 1 (или вычисленная).
2. Вычислить количество (моль) кислоты и щелочи, взятых для опыта, и количество образующейся воды.
3. Вычислить энтальпию нейтрализации в кДж/моль.
4. Определить погрешность опыта. В выводе указать на возможные причины погрешности.
Опыт 4. Определение теплоты реакции алюминия с соляной кислотой
Ход опыта.
1. Взять навеску порошка или стружек алюминия массой около 0,5 г.
2. Во внутренний стакан калориметра налить 100 мл одномолярного раствора соляной кислоты и всыпать в него навеску алюминия при постоянном перемешивании раствора.
3. Наблюдать протекание реакции, записывая в таблицу, такую же, как в опытах 1–3, значение температуры раствора.
4. По значению максимальной (равновесной) температуры вычислить количество выделившегося тепла и рассчитать опытное значение теплового эффекта реакции ΔНОоп.
5. По уравнению реакции
2Al(к) + 6HCl(p) = 2AlCl3(p) + 3H2(г)
вычислить теоретическое значение теплового эффекта этой реакции по энтальпиям образования НСl(р) (–167,5 кДж/моль) и АlCl3(р) (–672,3 кДж/моль).
6. Определить погрешность опыта и в отчете указать на возможные причины погрешности.
Дополнительные задания к лабораторной работе
1. Как называются реакции, идущие с выделением тепла, с поглощением? Какой знак имеют значения их энтальпий?
2. Почему энтальпия взаимодействия гидроксида натрия с различными сильными кислотами имеет одинаковое значение?
3. Вывести формулу для расчета постоянной калориметра, зная удельную теплоемкость стеклянного стакана и раствора. Почему в расчет не входит масса внешнего стакана?
4. Почему процесс нейтрализации всегда происходит с выделением тепла, а растворение твердых солей не всегда?
5. Сравнив графики изменения температуры раствора в двух калориметрах, выберите калориметр с лучшими характеристиками и обоснуйте свой выбор.

6. Экспериментально установлено, что при взаимодействии 2,3 г натрия с водой выделяется 14,0 кДж теплоты. Вычислите энтальпию реакции.
Лабораторная работа 6.
Тема: СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
Химические реакции очень сильно отличаются по скорости протекания. Например, взаимодействие водорода с хлором на свету происходит мгновенно (взрыв), а коррозия металлов длится годами. Скорость и механизм химических реакций изучает химическая кинетика.
В химической кинетике реакции подразделяются на простые и сложные. Простые реакции протекают без образования промежуточных соединений (в одну стадию), а сложные – с образованием промежуточных продуктов (в несколько стадий). Каждая стадия сложной реакции может рассматриваться как простая реакция. Среди последовательных стадий сложной реакции всегда имеется одна стадия, которая ограничивает скорость протекания всей реакции в целом. Она называется лимитирующей стадией сложной химической реакции.
Скорость реакции зависит от концентрации взаимодействующих веществ, эта зависимость устанавливается законом действующих масс для скорости реакций. Согласно этому закону, для реакции, протекающей по уравнению
a A + b B = Продукты
скорость реакции определятся выражением
V = kCAn1 CBn2,
в котором k – константа скорости реакции; CA и CB – молярные концентрации реагентов; показатели степени n1 и n2 называются частными кинетическими порядками реакции по веществам А и В, соответственно.
Сумма частных порядков реакции n1 + n2 = p представляет собой общий кинетический порядок реакции. Существуют реакции нулевого (p = 0), первого (р = 1), второго (р = 2) и третьего порядка (р = 3).
Для простых реакций частные порядки совпадают с коэффициентами перед реагентами в химическом уравнении реакции, а общий порядок равен сумме коэффициентов в левой части уравнения реакции.
Для сложной реакции общий кинетический порядок не совпадает с коэффициентами перед реагентами, но совпадает с порядком её лимитирующей стадии. Иногда порядок сложной реакции выражается не целым, а дробным числом.
Примечание. Для некоторых сложных реакций кинетический порядок сов-падает с коэффициентами перед реагентами; такие реакции в химической ки-нетике называются формально простыми.
Кинетический порядок реакции определяют экспериментально обычно графическим методом. В реакциях нулевого порядка скорость реакции остается постоянной. График экспериментальных данных для такой реакции в координатах V(скорость) – С(концентрация) представляет прямую линию, параллельную оси абсцисс (рис. 8а). В реакциях первого порядка скорость реакции увеличивается пропорционально концентрации (рис. 8б). В реакциях, порядок которых больше единицы, между V и С наблюдается экспоненциальная зависимость (рис. 8в).

|
Для того чтобы участвовать в реакции, молекулам необходима избыточная энергия по сравнению со средней энергией молекул при данной температуре. Эта избыточная энергия называется энергией активации реакции; она обозначается Еа и измеряется в кДж/моль. Константа скорости реакции и энергия активации связаны уравнением Аррениуса:

Энергия активации Еа и множитель ko (его называют предэкспоненциальным множителем) являются постоянными величинами, характеризующими данную реакцию; в отличие от константы скорости k, они не зависят от температуры.
Энергию активации можно найти, если измерить константу скорости реакции при двух температурах Т1 и Т2. При вычислении энергии активации потребуются не абсолютные значения константы скорости, а их отношение (k2 : k1). Это то же самое, что отношение скоростей реакции при двух температурах (V2 : V1) или отношение времени протекания реакции при Т1 к её времени при Т2 (τ1 : τ2), так как все эти отношения равны между собой:
k2 : k1 = V2 : V1 = τ1 : τ2.
Формулу для вычисления энергии активации можно получить, если записать уравнение Аррениуса два раза – для температур Т1 и Т2:

разделить второе уравнение на первое, прологарифмировать полученное уравнение. После преобразований получается формула:
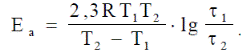
Экспериментальная часть
Целью работы является экспериментальное определение кинетических параметров химической реакции: порядка реакции и энергии активации.
Исследуется реакция между тиосульфатом натрия и серной кислотой, которая описывается уравнением:
Na2S2O3 + H2SO4 = Na2SO4 + SO22↑ + S↓+ H2O
Один из продуктов реакции (сера) по ходу реакции образуется в виде очень мелких, невидимых вначале, коллоидных частиц, взвешенных в воде. Когда количество серы возрастает, её частицы начинают соединяться между собой (коагулироват ь) и становятся заметными благодаря тому, что рассеивают свет.
Рассеяние света коллоидными частицами серы наблюдается в виде голубоватого окрашивания раствора, напоминающего слабое свечение. Это явление называется опалесценцией. При проведении эксперимента необходимо измерять промежуток времени между двумя моментами: моментом начала реакции и моментом, когда становится видимой опалесценция.
Этот промежуток принимается за время протекания реакции (τ). Величина, обратная τ, пропорциональна скорости реакции (V); единица её измерения – с-1. Далее для краткости эту величину будем называть скоростью реакции.
При выполнении работы проводятся три опыта.
Первый опыт выполняется при различных концентрациях тиосульфата натрия, в то время как концентрация серной кислоты берется одинаковой для всех измерений в этой серии. В этом опыте выявляется зависимость скорости реакции от концентрации тиосульфата натрия.
Во втором опыте переменной величиной является концентрация серной кислоты, в то время как концентрация тиосульфата натрия под-держивается постоянной. В этом опыте определяется скорость реакции в зависимости от концентрации серной кислоты.
Объединив измеренные зависимости скорости реакции от концен-траций тиосульфата натрия и серной кислоты, получают уравнение, свя-зывающее скорость реакции с обеими переменными концентрациями реагентов. Это и будет уравнение закона действующих масс или кине-тическое уравнение реакции:
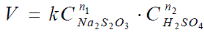
Неизвестными величинами, которые нужно определить, являются показатели степени n1 и n2, т.е. кинетический порядок реакции по тиосульфату натрия и серной кислоте. Их установление является целью двух первых опытов.
Опыт 1. Определение частного кинетического порядка по тиосульфату натрия
Ход опыта.
1. В пяти отдельных пробирках приготовить пять растворов тиосульфата натрия с различными концентрациями. В первую пробирку налить из капельницы 2 капли раствора Na2S2O3, во вторую – четыре, в третью – шесть, в четвёртую – восемь и в пятую – десять капель раствора. После этого объём раствора в каждой пробирке довести до 12 капель добавлением воды: в первую пробирку внести 10 капель воды, во вторую – 8, в третью – 6, в четвёртую – 4 и в пятую – 2. Если теперь принять концентрацию самого разбавленного раствора (первого) условно за единицу, то следующие будут иметь концентрацию два, три, четыре и пять.
2. В приготовленных пробирках с растворами Na2S2O3 провести реакции с серной кислотой. Для этого в каждую из них добавить одну каплю серной кислоты. Каждый раз по секундомеру определить время реакции – достижение одинаковой интенсивности опалесценции.
3. Вычислить значения скорости реакции и заполнить таблицу:
| Номер опыта | Число капель тиосульфата натрия | Число капель воды | Концентрация тиосульфата натрия, С | Время реакции, τ | Скорость реакции, V = 1/τ |
4. Построить график зависимости скорости реакции от концентра-ции раствора тиосульфата натрия Na2S2O3 по виду которого установить частный кинетический порядок реакции по тиосульфату натрия.
Опыт 2. Определение частного кинетического порядка по серной кислоте
1. Приготовить три пробирки с растворами H2SO4 разной концентрации. Для этого в первую пробирку налить одну каплю раствора серной кислоты, во вторую 2 капли, а в третью 3 капли; после этого в каждую пробирку добавить дистиллированную воду так, чтобы объемы растворов во всех трех пробирках были одинаковыми – по 8 капель.
2. Раствор тиосульфата натрия в этом опыте берется одинаковым – четыре капли. Чтобы результат опыта был более точным, рекомендуется четыре капли раствора Na2S2O3 поместить в отдельную пробирку, а затем в неё вливать раствор серной кислоты из одной (из трёх заранее приготовленных) пробирки. Время реакции измеряется таким же образом, как и в первой серии; затем также заполняется таблица:
| Номер опыта | Число капель серной кислоты | Число капель воды | Концентрация серной кислоты, С | Время реакции, τ | Скорость реакции, V = 1/τ |
3. По полученным опытным результатам построить график зависимости скорости реакции от концентрации серной кислоты. Вид полученного графика позволяет определить частный кинетический порядок реакции по серной кислоте. Зная оба частных порядка, найти (их сложением) общий кинетический порядок исследуемой реакции. По результатам опытов 1 и 2 в выводе записать кинетическое уравнение реакции тиосульфата натрия с серной кислотой.
Опыт 3. Определение энергии активации
В третьем опыте определяется энергия активации реакции между тиосульфатом натрия и серной кислотой. Для этого время её протекания измеряется при трёх разных температурах, но при одинаковых концен-трациях реагентов.
1. В трёх пробирках приготовить одинаковые объемы раствора Na2S2O3 одной и той же концентрации. Рекомендуется в каждой пробирке к двум каплям раствора тиосульфата натрия, взятого из штатива с реактивами, добавить десять капель дистиллированной воды.
2. В первой пробирке реакция проводится при комнатной температуре. Для этого пробирку перед началом реакции поместить на 3–5 мин в термостат, имеющий комнатную температуру, так, чтобы раствор в пробирке принял температуру термостата. В качестве термостата используется химический стакан с водой; температура воды в термостате контролируется термометром. После того как температура установилась, в пробирку добавляется одна капля серной кислоты и измеряется время реакции.
3. Температура термостата повышается (прибавлением горячей воды) на десять градусов. Вторая пробирка с Na2S2O3 термостатируется в течение 5 мин при новой температуре и в ней точно так же проводится реакция с одной каплей серной кислоты. Таким же образом с интервалом в десять градусов проводится измерение времени протекания реакции в третьей пробирке. Данные заносятся в таблицу:
| Номер пробирки | |||
| Температура, °С | |||
| Температура, К | |||
| Время реакции τ, с | |||
| Скорость реакции, V = 1/τ |
4. Для каждой пары из двух температур вычислить величину энергии активации. После этого, исходя из трёх полученных значений энергии активации, вычислить её среднее значение.
5. Определить ошибку опыта, сравнив найденное значение энергии активации с известным по литературе (35 кДж/моль).
6. Описать опыт и сделать вывод.
Дополнительные задания к лабораторной работе
1. По какому признаку реакции подразделяются на простые и слож-ные, гомогенные и гетерогенные?
2. Какие реакции называются сложными? Какая стадия сложной ре-акции является лимитирующей?
3. Перечислите факторы, от которых зависит скорость реакции.
4. Как формулируется и как записывается в математическом виде правило Вант-Гоффа?
5. Какая энергия называется энергией активации? Как она влияет на скорость химической реакции? Зависит ли она от температуры?
6. Каков физический смысл предэкспоненциального множителя в уравнении Аррениуса? От чего он зависит и не зависит?
7. Кинетическое уравнение реакции имеет вид V = k·CА·CВ0. Как изменится скорость при увеличении концентраций А и В в 2 раза? Как при этом изменится константа скорости?
Лабораторная работа 7.
Тема: ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Многие химические реакции при одной и той же температуре в зависимости от соотношения реагентов могут самопроизвольно протекать как в прямом, так и в обратном направлении. Такие реакции называются обратимыми. В обратимых реакциях существует общий предел и прямой и обратной реакции, который называется состоянием химического равновесия. В химической термодинамике состояние равновесия определяется как такое состояние, при котором реагирующая система характеризуется нулевым значением энергии Гиббса: ΔGT = 0. Но переход системы в состояние химического равновесия не означает прекращения реакции, а свидетельствует лишь о том, что перестают изменяться концентрации реагирующих веществ и продуктов.
В химической кинетике состоянием химического равновесия называется такое состояние, при котором скорость прямой реакции становится равной скорости обратной. В состоянии равновесия сколько молекул (или других частиц) продукта реакции в единицу времени образуется, столько их и разлагается, т.е. химическое равновесие является динамическим, или подвижным. Таким образом, в состоянии химического равновесия концентрации всех веществ (реагентов и продуктов) являются постоянными и не изменяются до тех пор, пока не изменятся внешние условия проведения реакции.
Концентрации реагентов (исходных веществ) и продуктов в состоянии химического равновесия называются равновесными.
Признаки химического равновесия следующие: 1) состояние системы не зависит от того, с какой стороны она подходит к равновесию – со стороны исходных веществ или со стороны продуктов реакции; 2) состояние системы остается неизменным при отсутствии внешних воздействий; 3) оно изменяется при изменении внешних условий, сколь бы малы они ни были.
Частное от деления произведения равновесных концентраций в степенях, равных стехиометрическим коэффициентам, продуктов реакции на произведение равновесных концентраций исходных веществ в соответствующих степенях является величиной постоянной при данной температуре и давлении (закон действующих масс для химическоого равновесия). Эта величина называется константой равновесия и обозначается символом К.
Для уравнения реакции в общем виде:

константа равновесия записывается так:

где [A], [B], [C], [D] – равновесные концентрации веществ А, В, С, D; а, в, с, d – показатели степени, в которые возводятся концентрации веществ и которые численно равны коэффициентам перед формулами веществ в уравнении реакции.
Данное математическое уравнение является выражением закона действующих масс для химического равновесия.
Например, константа равновесия для обратимой реакции синтеза аммиака записывается так:

а константа равновесия для обратимой реакции конверсии водяного пара имеет такое выражение:

Константа равновесия определяет полноту протекания реакции к моменту достижения равновесного состояния: чем больше значение константы равновесия, тем в большей степени в равновесной реакционной смеси преобладают продукты реакции, тем больше их выход.
При изменении условий, в которых находится система (температуры, давления, концентрации), химическое равновесие нарушается. Через некоторое время в системе устанавливается новое химическое равновесие, соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом или смещением равновесия.
Направление смещения равновесия в результате изменения внешних условий определяется принципом Ле Шателье: если находящаяся в равновесии система подвергается внешнему воздействию, равновесие смещается в том направлении, которое способствует ослаблению этого воздействия.
Рассмотрим, как влияет на направление смещения равновесия повышение или понижение давления, температуры и концентрации веществ, участвующих в реакции.
Давление. Давление влияет на равновесие обратимых реакций с участием газообразных веществ. При повышении давления равновесие смещается в направлении образования веществ с меньшим объемом; при понижении давления равновесие смещается в направлении образования веществ с большим объемом. Например, в реакции синтеза аммиака

объем продукта в два раза меньше объема реагентов. Поэтому равновесие этого обратимого процесса при увеличении давления смещается в сторону образования NH3, а при уменьшении давления – в сторону его разложения.
Температура. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, а при понижении температуры – в направлении экзотермической реакции. Например, та же реакция синтеза аммиака является экзотермической. Поэтому при повышении температуры её равновесие смещается в левую сторону (аммиак разлагается), а при понижении – направо (аммиак образуется).
Концентрация. При повышении концентрации одного из исходных веществ равновесие смещается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие смещается в направлении образования реагентов.
В качестве примера рассмотрим контактный метод получения сер-ной кислоты:

в котором желательно возможно более полное превращение оксида серы (IV) в оксид серы SO3 (VI) в первой (обратимой) реакции. Для увеличения выхода SO3 можно увеличить концентрацию SO2 в исходной реакционной смеси. Однако это нерентабельно и экологически вредно, так как избыток SO2 будет выбрасываться в атмосферу. Поэтому реакцию проводят при избытке воздуха, обогащенного кислородом. В результате достигается смещение равновесия вправо, то есть более полное превращение SO2 в SO3.
В ионообменных реакциях между растворенными веществами равновесие смещается в сторону образования осадков, газов или слабых электролитов. Если такие вещества находятся в обеих частях уравнения реакции, то вопрос о смещении равновесия решается расчетом константы равновесия.
Экспериментальная часть
Целью работы является экспериментальное изучение направления смещения химического равновесия в гомогенных и гетерогенных обратимых реакциях в зависимости от внешних воздействий.
Опыт 1. Влияние концентрации взаимодействующих веществ на смещение равновесия
В четыре пробирки внести по 5–7 капель раствора хлорида трёхвалентного железа и роданида аммония NH4SCN. Одну пробирку с раствором поставить в штатив и хранить как эталон для сравнения результатов опыта. В остальные три пробирки добавить следующие реактивы: в первую – пять–шесть капель хлорида железа (III); во вторую – столько же капель роданида аммония; в третью – один микрошпатель кристалликов хлорида аммония. Содержимое пробирок размешать стеклянной палочкой. Сравнить интенсивность окраски полученных растворов с интенсивностью окраски эталона.
В отчёте: а) написать уравнение обратимой ионообменной реакции FeCl3 c NH4SCN; б) записать свои наблюдения по изменению интенсивности окраски растворов в трёх пробирках по сравнению с интенсивностью окраски эталона; в) указать, в каком направлении смещается равновесие реакции в каждом из исследованных случаев и соответствует ли оно принципу Ле Шателье; г) написать выражение для константы равновесия этой обратимой реакции.
Опыт 2. Смещение равновесия в растворе аммиака
В две пробирки налить по одной трети дистиллированной воды, по 5 капель фенолфталеина и по 2–3 капли раствора аммиака. Отметить цвет растворов. Одну пробирку оставить для сравнения, а в другую добавить 3–4 микрошпателя хлорида аммония и размешать раствор. Как и почему изменилась интенсивность окраски? Написать схему равновесия в водном растворе аммиака и объяснить его смещение при добавлении кристаллического хлорида аммония.
Опыт 3. Влияние среды раствора на смещение равновесия перехода хромата в дихромат
Хром в шестивалентном состоянии образует два аниона: хромат-ион CrO и дихромат-ион Cr2O72-. Их существование определяется наличием щелочной (рН > 7) или кислой (рН < 7) среды.
В две пробирки внести по 3 капли раствора хромата калия (K2CrO4) и добавить несколько капель раствора серной кислоты до изменения окраски раствора. Одну пробирку оставить для сравнения, а в другую добавить раствор щелочи до изменения окраски раствора.
Повторить опыт, взяв в двух пробирках исходным веществом дихромат калия K2Cr2O7. Одну пробирку оставить для сравнения, а в другую добавить раствор щелочи до изменения окраски раствора.
Описать опыт. Написать молекулярные уравнения перехода хрома-та в дихромат и обратного процесса, используя следующие ионные уравнения:

Сделать вывод о влиянии среды на образование хроматов и дихроматов.
Опыт 4. Смещение равновесия при образовании нерастворимых веществ
В три пробирки внести по 3 капли хлорида магния и по каплям медленно добавлять в каждую пробирку щелочь NaOH до образования осадка. Хорошо перемешать полученную суспензию палочкой. Одну пробирку оставить для сравнения, во вторую добавить соляную кислоту, а в третью прилить насыщенный раствор NH4Cl до растворения осадка.
В отчёте описать опыт и наблюдения, написать ионные и молекулярные уравнения реакций образования осадка Mg(OH)2 и его растворения в результате взаимодействия с соляной кислотой и хлоридом аммония.
Сделать вывод об условиях и направлении смещения химического равновесия в обратимых реакциях ионного обмена в растворах электролитов.
Опыт 5. Смещение равновесия при диссоциации слабых кислот
Диссоциация всех электролитов при растворении происходит вследствие их взаимодействия с водой. Например, процесс электролитической диссоциация слабой уксусной кислоты, который выражается краткой схемой:

в действительности идёт с образованием гидратов неопределенного состава:

Равновесие этого обратимого физико-химического процесса, как и обратимых реакций, можно смещать в обе стороны с помощью внешних воздействий.
В две пробирки внести по 6 капель децимолярной (0,1 М) уксусной кислоты. В каждую прибавить одну каплю метилоранжа. Под влиянием каких ионов индикатор принимает розовую окраску?
Одну пробирку с кислотой оставить в качестве контрольной, а в другую внести 3–4 микрошпателя ацетата натрия и перемешать раствор стеклянной палочкой. Сравнить окраску полученного раствора с окраской в контрольной пробирке. На изменение концентрации каких ионов указывает изменение окраски индикатора?
В отчете описать опыт и наблюдения. Написать схему диссоциации уксусной кислоты в упрощенном виде (без участия воды) и выражение константы её диссоциации (константы равновесия). Объяснить смещение равновесия диссоциации кислоты при добавлении к ней ацетата натрия. Как изменяется при этом степень диссоциации кислоты и концентрация катионов водорода в растворе? Подтвердился ли в опытах принцип Ле Шателье? Сформулировать общий вывод по работе.
Дополнительные задания к лабораторной работе
1. Напишите выражение для константы равновесия реакции

Как изменится константа равновесия при увеличении концентрации продукта реакции (иодоводорода) в 2 раза?
2. Для реакции

записать выражение для константы равновесия через равновесные кон-центрации (КС) и равновесные парциальные давления (КР).
3. Как повлияет на равновесие обратимой реакции
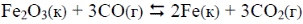
увеличение давления?
4. Как повлияет на равновесие обратимой реакции

повышение температуры?
5. Какую среду имеют раствор дихромата калия и раствор хромата калия в воде?
6. Какие условия (температура, давление, концентрации участников реакции, катализатор) необходимы для повышения выхода хлора по об-ратимой реакции

Глава третья. РАСТВОРЫ
Лабораторная работа 8.
Тема: ПРИГОТОВЛЕНИЕ И ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ РАСТВОРА
В химической практике, а также в быту часто возникает необходимость в приготовлении растворов различной концентрации. Способов приготовления растворов много, но каждый из них обладает своими преимуществами и недостатками.
Например, приготовление раствора по «правилу креста» не требует сложных расчетов, но довольно велика относительная погрешность приготовления (до 10 %).
Раствор можно приготовить с помощью фиксанала. Фиксанал – это герметично запаянная стеклянная ампула с точно взятой навеской сухого вещества или точным объемом кислоты. В этом случае достигается самая высокая точность концентрации приготовления, но из-за высокой стоимости фиксаналов растворы на их основе готовят в редких случаях – для проведения особо точных анализов.
Наиболее оптимальным является способ, когда более концентрированный раствор разбавляют водой до заданной концентрации. Это простой способ, позволяющий готовить растворы с довольно высокой точностью.
Для приготовления раствора необходимо знание различных способов выражения концентрации и умение переходить от одного способа к другому.
Наиболее распространены пять способов выражения концентрации растворов: 1) массовая доля растворенного вещества – масса растворенного вещества, содержащаяся в 100 массовых частях раствора; 2) молярная концентрация – количество вещества в одном литре раствора; 3) молярная концентрация эквивалента (эквивалентная концентрация) – количество эквивалентных масс вещества в одном литре раствора; 4) моляльность – количество вещества в одном килограмме растворителя; 5) титр – масса растворенного вещества в одном мл (см3) раствора.
При переходе от массовой доли и моляльности к остальным способам выражения концентрации необходимо знать плотность раствора, которая определяется опытным путем с помощью ареометра.
Ареометр – это прибор для измерения плотности жидкостей. Он представляет собой запаянную стеклянную трубку с грузом на конце и со шкалой. Шкала градуирована в единицах плотности (кг/м3 или г/л).
Когда ареометр погружен в жидкость, то уровень её поверхности совпадает с тем делением на шкале, которое указывает плотность этой жидкости. Зная плотность раствора, можно в справочной литературе найти массовую долю растворенного вещества. Например, для раствора гидроксида натрия имеются такие данные:
| ρ, кг/л | 1,00 | 1,05 | 1,10 | 1,15 | 1,20 | 1,25 | 1,30 | 1,40 | 1,50 |
| ω, % | 4,65 | 9,19 | 13,73 | 18.25 | 22,81 | 27,40 | 36,99 | 47,33 |
Наиболее точным и простым методом определения концентрации растворов является титрование. Это метод количественного химического анализа, основанный на измерении объема раствора с известной концентрацией, затраченного на реакцию с раствором вещества неизвестной концентрации, которую нужно измерить. В зависимости от типа реакции, протекающей при титровании, различают кислотно-основное титрование, окислительно-восстановительное и т.д.
Для определения концентрации щелочей применяется кислотно-основное титрование раствором кислоты. При этом протекает реакция нейтрализации
NaOH + HCl = NaCl + H2O,
к которой можно применить закон эквивалентов:

Если концентрация раствора является эквивалентной концентрацией (Cэк), то масса вещества (m) в объеме раствора (V) равна
m = Cэк·Mэк·V,
и выражение закона эквивалентов принимает вид:
V(NaOH) · Cэк(NaOH) = V(HCl) · Cэк(HCl).
Таким образом, для определения эквивалентной концентрации щелочи необходимо знать концентрацию кислоты и объемы растворов кислоты и щелочи, вступивших в реакцию.
Экспериментальная часть
Целью работы является: 1) определение с помощью ареометра плотности раствора гидроксида натрия и массовой доли растворенного вещества, 2) приготовление раствора гидроксида натрия заданной концентрации, 3) определение методом титрования концентрации приготовленного раствора.
Опыт 1. Определение плотности раствора ареометром
Получить у лаборанта раствор гидроксида натрия и налить его в стеклянны
|
|
|

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
© cyberpedia.su 2017-2025 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!