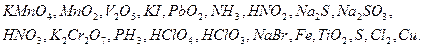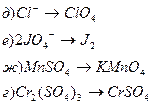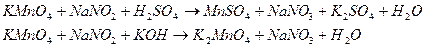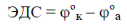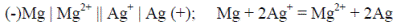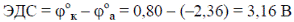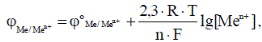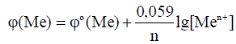а) Налейте в пробирку раствор иодида калия, подкислите его серной кислотой и добавьте немного пероксида водорода. Реакция протекает по схеме:
KJ +H2O2 + H2SO4 → J2 + K2SO4 + …
Что наблюдается? Какую функцию выполняет пероксид водорода в этой реакции?
Напишите уравнение реакции, составив схему электронного баланса. Укажите процессы окисления и восстановления, окислитель и восстановитель.
в) Налейте в пробирку раствор перманганата калия, подкислите его серной кислотой и добавьте пероксид водорода. Как меняется цвет раствора?
Реакция протекает по схеме:
KMnO4 +H2O2 + H2SO4 → MnSO4 + K2SO4 + O2…
Напишите уравнение реакции, составив схему электронного баланса. Укажите процессы окисления и восстановления, окислитель и восстановитель. Какие свойства проявляет пероксид водорода в этой реакции?
Примечание: В ряде вышеприведенных окислительно-восстановительных реакций изменяется цвет раствора. По изменению цвета раствора можно судить о продуктах окисления-восстановления, если знать цвета соответствующих ионов.
| Цвет катионов
| Цвет анионов
|
| Cu2+
| голубой
| CrO42-
| желтый
|
| Cr3+
| зеленый
| Cr2O72-
| оранжевый
|
| Mn2+
| бесцветный
| MnO4-
| фиолетовый
|
|
|
| MnO4-2
| зеленый
|
Опыт 5. Влияние характера среды на протекание окислительно -восстановительных реакций.
В 3 пробирки налейте раствор перманганата калия. В первую пробирку добавьте 2 капли разбавленной серной кислоты (кислая среда), во вторую пробирку добавьте 2 капли дистиллированной воды (нейтральная среда), в третью добавьте 2 капли разбавленного раствора гидроксида натрия (щелочная среда). В каждую из пробирок добаьте порошкообразный сульфит натрия. Отметьте наблюдаемые явления.
Обратите внимание, что перманганат ион (MnO4-1) - фиолетового цвета, манганат ион (MnO4-2) - зеленого, оксид марганца (IV) (MnO2) - бурого цвета, а ион Mn+2- бесцветный.
Напишите уравнения наблюдаемых реакций. Для всех уравнений составьте уравнения электронного баланса и подберите коэффициенты. К какому типу относятся данные окислительно-восстановительные реакции?
Опыт 6. Реакции внутримолекулярного окисления-восстановления. Термическое разложение бихромата аммония. (Опыт проводятся лаборантом)
Поместите небольшое количество кристаллического бихромата аммония в виде горки в фарфоровую чашку. Нагрейте в пламени газовой горелки стеклянную палочку и внести ее в середину подготовленной горки. Палочку подержите несколько секунд до начала реакции. Отметьте наблюдаемые явления. Учитывая, что при термическом разложении бихромата аммония образуется оксид хрома (III), азот и вода, с помощью метода электронного баланса составьте уравнение реакции. Укажите окислитель и восстановитель.
Опыт 7. Реакции диспропорционирования (самоокисления – самовосстановления)
Внесите в пробирку 5-7 капель бромной воды и добавьте к ней по каплям разбавленного раствора гидроксида натрия до обесцвечивания раствора. Запишите уравнение реакции, принимая во внимание, что продуктами являются бромид натрия, гипобромид натрия (NaBrO) и вода. Составьте уравнения электронного баланса,
укажите окислитель и восстановитель?
Дополнительные задания к лабораторной работе
1. Какие из приведенных ниже реакций являются окислительно-восстановительными?
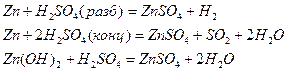
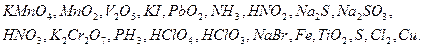
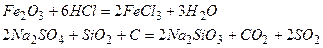
2. Окисление или восстановление происходит при переходах:

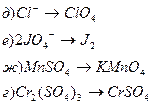
3. Заполните приведенную ниже таблицу, используя следующие вещества:
| Вещества, обладающие
|
| только окислительными свойствами
| только восстановительными свойствами
| двойственными окислительно-
восстановительными свойствами
|
|
|
|
|
4. Подберите коэффициенты и вычислите эквивалентную массу перманганата калия и нитрита натрия в следующих реакциях:
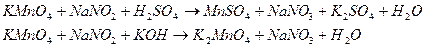
5. Подберите коэффициенты в уравнениях следующих межмолекулярных окислительно-восстановительных реакций:
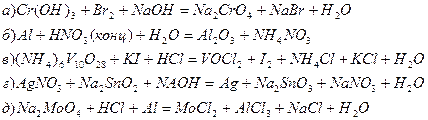
6. Подберите коэффициенты в следующих уравнениях реакций диспропорционирования:
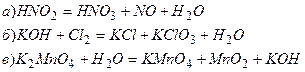

Лабораторная работа 14.
Тема: ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Гальванический элемент – это химический источник электроэнергии, в котором энергия химической реакции преобразуется в электрическую энергию.
Гальванический элемент состоит из двух электродов – катода и анода, погруженных в растворы электролитов. Электролитами обычно являются соли тех металлов, из которых изготовлены электроды. Электрический контакт между растворами электролитов осуществляется с помощью пористой перегородки или электролитического «мостика», который изготовляется из U-образной стеклянной трубки, заполненной раствором электролита. Такой «мостик» проводит ток благодаря наличию ионов, но препятствует смешиванию электролитов.
Работа гальванического элемента основана на протекающей в нём окислительно-восстановительной реакции, причем процессы окисления и восстановления разделены, они протекают на разных электродах: окисление на аноде, а восстановление на катоде. Электроны движутся во внешней цепи от анода к катоду (от восстановителя к окислителю).
Главной характеристикой гальванического элемента является его электродвижущая сила (ЭДС). ЭДС – это разность потенциалов электродов в состоянии, когда сила тока равна нулю, т.е. когда между электродами и растворами солей устанавливается химическое равновесие:
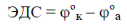
Обычно для создания гальванического элемента берут два разных металла, расположенных далеко друг от друга в электрохимическом ряду активности металлов (ряду напряжений), чтобы получить наибольшую ЭДС.
Для примера рассмотрим магниево-серебряный гальванический элемент.
Найдем в ряду напряжений эти металлы и их стандартные электродные потенциалы:

Магний – более активный металл, он при работе гальванического элемента является анодом, то есть окисляется, а на серебряном электроде происходит восстановление катионов серебра из раствора, то есть серебряный электрод является катодом:

Электрохимическая схема гальванического элемента и его токообразующая реакция в ионном виде записываются так:
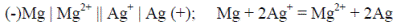
Уравнение токообразующей реакции в молекулярном виде показы-вает, что данный гальванический элемент производит электроэнергию за счёт окислительно-восстановительной реакции вытеснения менее ак-тивного металла более активным из раствора его соли:
Mg + 2AgNO3 = Mg(NO3)2 + 2Ag↓
Электродвижущая сила магниево-серебряного гальванического элемента при стандартных условиях рассчитывается по формуле:
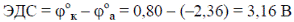
При работе гальванического элемента в нестандартных условиях вначале необходимо вычислить электродные потенциалы катода и анода по уравнению Нернста:
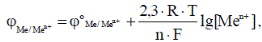
где j0Me/Men+ – стандартный электродный потенциал; Т – температура; n – число электронов, переходящих от восстановителя к окислителю; [Men+] – молярная концентрация катионов металла в растворе электролита; R – молярная газовая постоянная; F – постоянная (число) Фарадея.
При стандартной температуре (298 К), но нестандартном значении концентрации катионов пользуются упрощенным вариантом этого уравнения:
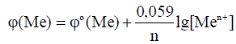
Экспериментальная часть
Целью работы является изучение электрохимической активности наиболее известных металлов, сборке гальванического элемента и определение его ЭДС.
Опыт 1. Исследование электрохимической активности металлов
В шесть пробирок налить по 10 капель растворов солей магния, цинка, железа (II), олова (II), свинца (II), меди (II). Опустить в пробирки по кусочку магния, исключая первую пробирку. Отметить изменения, наблюдаемые в пробирках, написать уравнения реакций. Повторить опыт ещё пять раз, опуская цинк, железо, олово, свинец и медь во все пробирки, кроме тех, в которых содержится раствор соли того же самого металла. Написать уравнения наблюдаемых реакций. Опытные данные занести в таблицу, поставив знак "+" под ионами металлов в тех случаях, когда эти металлы вытеснялись из их солей, и знак "0", когда вытеснения не происходило.
Способность металлов восстанавливать друг друга из растворов их солей
| Металл
| Ионы металла в растворе
|
| Mg2+
| Zn2+
| Fe2+
| Sn2+
| Pb2+
| Cu2+
|
| Mg
| ––
|
|
|
|
|
|
| Zn
|
| ––
|
|
|
|
|
| Fe
|
|
| ––
|
|
|
|
| Sn
|
|
|
| ––
|
|
|
| Pb
|
|
|
|
| ––
|
|
| Cu
|
|
|
|
|
| ––
|
В выводе охарактеризовать восстановительную способность изученных металлов и расположить их в ряд по уменьшению этого свойства. Соответствует ли расположение металлов в этом ряду их расположению в ряду электрохимической активности металлов?
Опыт 2. Cборка гальванического элемента и измерение его ЭДС
Собрать гальванический элемент, электродами которого служат цинк и медь. Для этого взять два химических стакана и заполнить их растворами солей с известной концентрацией: один – сульфатом цинка, а другой – сульфатом меди (II), и соединить их электролитическим мостиком. Электролитический мостик – это U-образная стеклянная трубка, заполненная раствором электролита, например хлорида или сульфата натрия, а в простейшем случае это лента фильтровальной бумаги, смоченная раствором любого электролита.
В первый стакан опустить цинковый электрод, во второй – медный. Подключить к клеммам вольтметр и замерить напряжение на электродах. В отчете отразить следующее: 1) записать собранный гальванический элемент его в виде электрохимической схемы; 3) написать схемы анодного и катодного процессов и уравнение токообразующей реакции; 4) вычислить теоретическое значение ЭДС, сравнить его с измеренным и рассчитать погрешность опыта; 5) в выводе объяснить, почему изме-ренное значение ЭДС отличается от теоретического.
Дополнительные задания к лабораторной работе
1. Расположите металлы железо, медь, марганец, магний, серебро в ряд по увеличению окислительных свойств их катионов.
2. Среди металлов свинец, золото, кадмий, кальций, медь укажите: а) взаимодействующие с соляной и разбавленной серной кислотами; б) вытесняющие никель из растворов его солей.
3. Вычислите значение электродного потенциала цинка, если цинк находится в растворе своей соли с концентрацией катионов 0,01 М, а температура раствора равна 15 °С.
4. Вычислите значение электродного потенциала меди, если элек-трод находится в растворе соли меди (II) с концентрацией катионов 0,1 М, температура раствора равна 10 °С.
5. Напишите электрохимическую схему гальванического элемента, составленного из медного и марганцевого электродов с растворами со-лей меди (II) и марганца (II). Вычислите ЭДС элемента при стандартных условиях и при концентрации катионов в растворах 0,1М (температура стандартная).
6. Напишите схему двух гальванических элементов, в одном из ко-торых цинк является катодом, а в другом анодом; вычислите их ЭДС.
7. Приведена электрохимическая схема гальванического элемента:
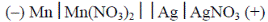
Напишите схему катодного и анодного процессов, уравнение токообразующей реакции в молекулярном и ионном виде. Определите ЭДС элемента при стандартных условиях.
Лабораторная работа 15.
Тема: ЭЛЕКТРОЛИЗ
Электролизом называется совокупность окислительно-восстановительных процессов, происходящих при пропускании постоянного электрического тока через раствор или расплав электролита.
Пропускание тока через электролиты осуществляется с помощью электродов: катода, на котором происходит процесс восстановления, и анода, на котором осуществляется процесс окисления.
При электролизе растворов солей закономерности восстановления на катоде следующие.
1. Катионы металлов, расположенных в ряду напряжений правее железа (от кадмия до золота), восстанавливаются согласно уравнению:
Меn+ + nе = Me
2. Катионы активных металлов, расположенных в левой части ряда напряжений (от лития до алюминия), не восстанавливаются. В этом случае на катоде происходит восстановление воды:
2Н2О + 2е = Н2↑ + 2ОН-
3. Катионы металлов, расположенных в средней части ряда напряжений (марганец, цинк, хром, железо и др.), восстанавливаются на катоде вместе с восстановлением воды, т.е. параллельно идут два процесса, уравнения которых приведены выше.
Закономерности окисления на аноде следующие.
1. Простые анионы (Сl-, Br-, I-, S2-), кроме F- -ионов, окисляются с образованием соответствующих простых веществ, например:
2Cl- – 2е = Сl2↑
2. Сложные анионы (NO3-, SO42-, PO43- и др.) и F--ионы не окисляются. В этом случае на аноде происходит окисление воды:
2Н2О – 4е = О2↑ + 4Н+
Эти закономерности относятся к электролизу с инертным (нерастворимым) электродом: платина, графит, электродная сталь.
Но если анод изготовлен из металла, соль которого является электролитом, то в этом случае сам анод окисляется, переходя в раствор в виде катионов
Ме – nе = Men+,
а на катоде происходит восстановление этого же металла
Меn+ + nе = Me
Такой электролиз называется электролизом с активным (растворимым) анодом.
Экспериментальная часть
Целью работы является экспериментальное ознакомление с различными типами электролиза солей.
Опыт 1. Электролиз хлорида никеля (II) с инертными электродами
Собрать электролизер, используя графитовые стержни в качестве электродов. Залить в электролизер раствор хлорида никеля (II), включить электроды в сеть постоянного электрического тока и вести электролиз 5–6 мин. Наблюдать выделение металла на одном электроде (как этот электрод называется?) и газа (какого?) – на другом электроде (как он называется?).
В отчете нарисовать схему электролизера, описать опыт и наблюдения. Записать уравнения катодного и анодного процессов и общее уравнение электролиза хлорида никеля (II).
Опыт 2. Электролиз хлорида натрия с инертными электродами
Очистить электроды после первого опыта наждачной бумагой и вновь собрать электролизер. Залить в него раствор хлорида натрия и вести электролиз 5–6 мин. Наблюдать выделение газов (каких?) на обоих электродах. После проведения электролиза установить с помощью индикатора среду раствора.
В отчете описать наблюдения и результаты электролиза. Записать уравнения катодного и анодного процессов, образования щелочи в растворе и общее уравнение электролиза раствора хлорида натрия.
Опыт 3. Электролиз сульфата натрия с инертными электродами
Собрать электролизер так, как это было сделано в первом опыте, и наполнить его раствором сульфата натрия. Вести электролиз 5–6 мин, наблюдать выделение газов (каких?) на обоих электродах. В конце опыта отобрать пипеткой пробы раствора из катодной и анодной части электролизера и установить среду растворов.
В отчёте описать опыт и наблюдения, написать схемы процессов на электродах, «вторичных» процессов и общее уравнение реакции элек-тролиза.
Опыт 4. Электролиз сульфата меди (II) с инертными электродами
Собрать электролизер так, как это было сделано в первом опыте, наполнить его раствором CuSO4 и вести электролиз 5–6 мин. Наблюдать выделение металла (какого?) на катоде и газа (какого?) на аноде.
В отчёте описать опыт и наблюдения, привести схемы электродных процессов и уравнения реакций.
Опыт 5. Электролиз сульфата меди (II) с активным анодом
Ничего не меняя в электролизере после четвёртого опыта, повернуть вилку электропитания на 180° и включить ее в сеть постоянного тока. В этом случае электрод, бывший катодом в четвертом опыте (покрытый слоем меди), становится анодом. Провести электролиз 5–6 мин, описать наблюдения, записать уравнения анодного и катодного процессов.
В отчете сделать общий вывод о закономерностях электролиза различных типов солей при использовании инертных электродов и активного анода.
Дополнительные задания к лабораторной работе
1. Приведите примеры металлов, которые можно получить элек-тролизом растворов их солей.
2. Установите последовательность восстановления металлов из расплава смеси: AlCl3, CuCl2, FeCl2, CdCl2.
3. Рассчитайте минимальное напряжение разложения, которое необходимо приложить к электродам для начала электролиза расплава хлорида алюминия.
4. Газообразными продуктами электролиза каких солей являются только хлор и водород?
5. Электролиз раствора какой соли приводит к увеличению её кон-центрации в растворе: FeCl3, NaNO3, Cu(NO3)2, NaCl?
6. На рисунке изображен электролизер с угольными электродами. Какая соль находится в растворе: Na2CO3, CuSO4, Na2S, AgNO3? Объясните свой выбор. Напишите уравнения происходящих процессов.
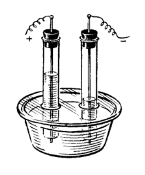
7. Вычислите объем газа, выделившегося на аноде при электролизе раствора нитрата натрия за 1 час, если сила тока равна 5А, а выход по току 90 %.
Лабораторная работа 16.
Тема: КОРРОЗИЯ МЕТАЛЛОВ
Коррозией называется разрушение металлов вследствие химического воздействия окружающей среды.
При коррозии металлы окисляются и теряют присущие им свойства. Коррозия приводит к большим материальным потерям, происходящим в результате нарушения целостности трубопроводов, цистерн, металлических частей машин, корпусов судов, морских сооружений и т.д. Безвозвратные потери металлов от коррозии составляют 8–10 % от ежегодного их выпуска.
По механизму протекания коррозия подразделяется на два типа:
1) химическую, которая наблюдается при взаимодействии металлов с сухими газами и жидкостями, не проводящими ток (неэлектролитами);
2) электрохимическую, которая наблюдается при взаимодействии металлов с растворами электролитов.
К электролитам относится вода обычная и морская, растворы солей, кислот и щелочей, влажные газы. Во влажных газах и в воздухе содержатся пары воды, которые адсорбируются на поверхности металлов, образуя тонкую невидимую для глаз пленку жидкой воды, в которой растворяются кислород, углекислый газ, сернистые газы, оксиды азота и другие газы, присутствующие в атмосфере; при этом образуются кислоты. Таким образом, во влажном воздухе на металлы действуют растворы электролитов.