Комплексными называют соединения, в узлах кристаллической решетки которых находятся комплексы, способные к самостоятельному существованию в растворе. Комплексные соединения образуются в результате взаимодействия между собой более простых неорганических соединений: солей, оснований, кислот. Например:
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Cu(OH)2 + 4NH3 + 2H2O = [Cu(NH3)4(OH2)2](OH)2
PtCl4 + 2HCl = H2[PtCl6]
По координационной теории Вернера в каждом комплексном соединении выделяют внутреннюю и внешнюю сферы. Во внутреннюю сферу, которую обозначают квадратными скобками, входит центральный атом, или комплексообразователь, и окружающие его ионы или молекулы, называемые лигандами. Наиболее часто комплексообразователями служат атомы (ионы) d -элементов. Лигандами могут быть анионы различных кислот (F -, Cl -, Br -, I -, CN -, NO 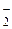 и др.), гидроксид-ион (ОН–), полярные молекулы (H2O, NH3, CO и др.) и сложные органические молекулы. В состав внутренней сферы одного соединения могут входить различные лиганды, например [Co(NH3)4Cl2]Cl. Число лигандов при комплексообразователе определяет координационное число центрального атома. Так, в соединении K[Ag(CN)2] координационное число серебра равно двум; в [Co(NH3)4Cl2]Cl координационное число кобальта равно шести.
и др.), гидроксид-ион (ОН–), полярные молекулы (H2O, NH3, CO и др.) и сложные органические молекулы. В состав внутренней сферы одного соединения могут входить различные лиганды, например [Co(NH3)4Cl2]Cl. Число лигандов при комплексообразователе определяет координационное число центрального атома. Так, в соединении K[Ag(CN)2] координационное число серебра равно двум; в [Co(NH3)4Cl2]Cl координационное число кобальта равно шести.
Внутренняя сфера комплексных соединений может быть электронейтральной или иметь заряд (положительный или отрицательный). Например:
[Ni(CO)4] – тетракарбонил никеля – нейтральная внутренняя сфера (соединение состоит только из внутренней сферы);
[Co(NH3)6]Cl3 – трихлорид гексаамминкобальта – положительно заряженная внутренняя сфера (комплексный катион);
K[Ag(CN)2] – дицианоаргенат (I) калия – отрицательно заряженная внутренняя сфера (комплексный анион).
Если внутренняя сфера заряжена, то комплексное соединение имеет внешнюю сферу – ионы с зарядом, противоположным по знаку заряду внутренней сферы. Если внутренняя сфера нейтральна, то соединение не имеет внешней сферы.
Название комплексного соединения читается справа налево, при этом первым называется анион, затем катион:
[Ag(NH3)2]Cl – хлорид диамминсеребра (I),
K2[CuCl3] – трихлорокупрат (I) калия.
В названии аниона употребляется корень латинского наименования комплексообразователя с добавлением суффикса - ат, а в названии катиона – его русское наименование в родительном падеже:
K3[Fe(CN)6] – гексацианоферрат (III) калия,
[Fe(OH2)6]Cl3 – хлорид гексаакважелеза (III).
Степень окисления комплексообразователя обозначается римской цифрой в скобках после его названия. Число лигандов указывается с помощью греческих числительных: моно – 1 (часто не указывается), ди – 2, три – 3, тетра – 4, пента – 5, гекса – 6 и т. д. К названию анионных лигандов добавляют окончание – о, а нейтральные лиганды называют так же, как молекулы. Особые названия имеют: H2O – аква, NH3 – аммин, CO – карбонил.
Пример 1. Назовите следующие соединения: [Cu(NH3)4(OH2)2](OH)2, [Co(NH3)3(NO2)3], K2[PtBr4]. Определите степень окисления центрального атома, его координационное число и тип комплекса.
Решение
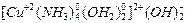 – гидроксид диакватетраамминмеди (II). Заряд комплексного иона равен заряду внешней сферы, взятому с противоположным знаком, следовательно, заряд комплексного иона 2+, комплекс катионный. Центральный атом (ц.а.) – медь, его окружают четыре молекулы аммиака и две молекулы воды, значит координационное число ц.а. равно 6. Лигандами являются нейтральные молекулы, поэтому степень окисления ц.а. равна заряду комплекса (степень окисления меди +2).
– гидроксид диакватетраамминмеди (II). Заряд комплексного иона равен заряду внешней сферы, взятому с противоположным знаком, следовательно, заряд комплексного иона 2+, комплекс катионный. Центральный атом (ц.а.) – медь, его окружают четыре молекулы аммиака и две молекулы воды, значит координационное число ц.а. равно 6. Лигандами являются нейтральные молекулы, поэтому степень окисления ц.а. равна заряду комплекса (степень окисления меди +2).
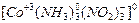 – тринитритотриамминкобальт (III); центральный атом – кобальт (степень окисления кобальта +3), координационное число ц.а. равно 6, комплекс нейтральный.
– тринитритотриамминкобальт (III); центральный атом – кобальт (степень окисления кобальта +3), координационное число ц.а. равно 6, комплекс нейтральный.
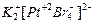 – тетрабромоплатинат (II) калия; центральный атом – платина (степень окисления платины +2), координационное число ц.а. равно 4, комплекс анионный.
– тетрабромоплатинат (II) калия; центральный атом – платина (степень окисления платины +2), координационное число ц.а. равно 4, комплекс анионный.
По характеру лигандов комплексы делят:
- на аквакомплексы – в качестве лигандов выступают молекулы воды, например: [Cr(OH2)6]3+, [Zn(OH2)4]2+
- амминокомплексы – в качестве лигандов выступают молекулы аммиака, например: [Ni(NH3)6]2+, [Ag(NH3)2]+
- гидроксокомплексы – в качестве лигандов выступают гидроксид-ионы, например: [Zn(OH)4]2–, [Cr(OH)6]3–
- ацидокомплексы – в качестве лигандов выступают анионы кислот, например: [CuBr4]2–, [Co(NO2)6]3–, [Fe(CN)6]3–
- карбонилы – комплексы, у которых лигандами являются молекулы СО, а комплексообразователями – атомы металлов со степенью окисления, равной нулю, например: [Ni(CO)4], [Fe(CO)5], [Cr(CO)6].
Теория валентных связей (ТВС) объясняет строение комплекса возникновением донорно-акцепторной связи между комплексо-образователем и лигандами. Комплексообразователь представляет на связь свободные орбитали и является акцептором, лиганды – электронную пару и выступают донорами.
Рассмотрим образование комплексов на примере соединений Cr (III). Валентная электронная конфигурация атома хрома 3d54s1, иона хрома(III) – 3d3:

У иона Cr (III) шесть свободных орбиталей, следовательно, Cr (III) является акцептором шести электронных пар и может присоединить шесть лигандов – доноров электронных пар. Например:
Координационное число хрома (III) равно шести, тип гибридизации – d2sp3; структура – октаэдр.
Пример 2. Определить пространственную структуру комплексных ионов [NiCl4] 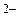 и [Ni(CN)4]
и [Ni(CN)4] 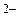 , если известно, что первый из них содержит два неспаренных электрона, а второй диамагнитен.
, если известно, что первый из них содержит два неспаренных электрона, а второй диамагнитен.
Решение
Схема распределения электронов по валентным орбиталям свободного иона никеля (II) в соответствии с правилом Хунда имеет следующий вид:
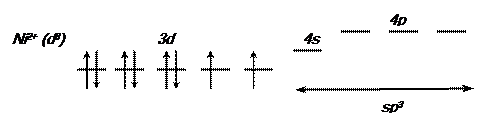
Парамагнетизм [NiCl4] 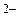 свидетельствует о том, что структура никеля (II) с двумя неспаренными электронами сохранилась в комплексном ионе. В образовании связей принимают участие одна s -орбиталь и три p -орбитали. Тип гибридизации – sp3, пространственная структура [NiCl4]
свидетельствует о том, что структура никеля (II) с двумя неспаренными электронами сохранилась в комплексном ионе. В образовании связей принимают участие одна s -орбиталь и три p -орбитали. Тип гибридизации – sp3, пространственная структура [NiCl4] 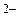 – тетраэдр.
– тетраэдр.

В диамагнитном ионе [Ni(CN)4] 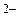 неспаренных электронов нет. Электроны под воздействием лиганда CN- размещаются на четырех 3d -орбиталях, а пятая принимает участие в образовании химической связи в комплексном ионе:
неспаренных электронов нет. Электроны под воздействием лиганда CN- размещаются на четырех 3d -орбиталях, а пятая принимает участие в образовании химической связи в комплексном ионе:
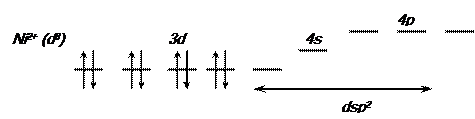
 Тип гибридизации – dsp2; структура – плоский квадрат. Структуру комплексов определяют по типу гибридизации атомных орбиталей комплексообразователя (см. табл. 3.6).
Тип гибридизации – dsp2; структура – плоский квадрат. Структуру комплексов определяют по типу гибридизации атомных орбиталей комплексообразователя (см. табл. 3.6).
Таблица 3.6
Пространственная конфигурация комплексов
| Координа-ционное число централь-ного атома
| Тип
комплекса
| Тип гибридизации орбиталей центрального атома
| Пространственная конфигурация комплекса
|
|
| ML2
| sp
|
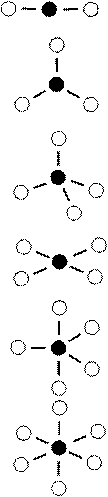
| Линейная
|
|
| ML3
| sp2
|
| Плоскотреугольная
|
|
| ML4
| sp3
|
| Тетраэдрическая
|
| dsp2
|
| Плоскоквадратная
|
|
| ML5
| dsp3
|
| Тригонально-бипирамидальная
|
|
| ML6
| d2sp3
|
| Октаэдрическая
|
Использованные в табл. 3.6 обозначения:
 – комплексообразователь (M)
– комплексообразователь (M)
 – лиганд (L)
– лиганд (L)
В водных растворах комплексные соединения (кроме тех, которые состоят только из внутренней сферы) диссоциируют практически полностью, т.е. являются сильными электролитами:
K[Ag(CN)2] 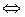 K+ + [Ag(CN)2] -
K+ + [Ag(CN)2] - 
[Co(NH3)4Cl2]Cl 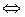 [Co(NH3)4Cl2] + + Cl -
[Co(NH3)4Cl2] + + Cl -
В результате диссоциации в растворе появляются комплексные ионы (катионы или анионы).
В значительно меньшей степени распадаются комплексные ионы:
[Ag(CN)2] - 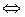 Ag+ + 2CN -
Ag+ + 2CN -
Как равновесный процесс распад комплексного иона можно охарактеризовать константой равновесия, называемой константой нестойкости комплекса:
Kн = 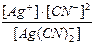 = 1,41∙10
= 1,41∙10 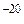 .
.
Величина Кн – важная постоянная, характеризующая устойчивость (нестойкость) комплексов: чем меньше Кн, тем устойчивее комплексный ион.
Величину, обратную константе нестойкости комплекса, называют общей константой устойчивости:
Kуст = 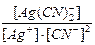 = 7,08∙10
= 7,08∙10 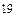 .
.
Чем больше значение Kуст , тем более устойчивым является комплексный ион. Например, для [Ag(NH3)2] + и [Ag(CN)2] - значения Kуст соответственно равны 1,62∙107 и 7,08∙1019 (25 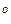 С). Очевидно, что ион [Ag(CN)2]- более устойчив, чем амминокомплекс серебра. Поэтому при добавлении к водному раствору, содержащему комплексы [Ag(NH3)2] +, цианид-ионов CN - будет протекать реакция замещения во внутренней сфере молекул NH3 на цианид-ионы CN -:
С). Очевидно, что ион [Ag(CN)2]- более устойчив, чем амминокомплекс серебра. Поэтому при добавлении к водному раствору, содержащему комплексы [Ag(NH3)2] +, цианид-ионов CN - будет протекать реакция замещения во внутренней сфере молекул NH3 на цианид-ионы CN -:
[Ag(NH3)2] + + 2CN - 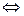 [Ag(CN)2] - + 2NH3 .
[Ag(CN)2] - + 2NH3 .
Контрольные задания
Задание 81
· Назовите следующие соединения: K[AuCl4], [Cr(OH2)6](NO3)3, [Ir(NH3)3Cl3].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру парамагнитного [Cr(OH2)6] 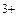 и диамагнитного [AuCl4] - комплексов.
и диамагнитного [AuCl4] - комплексов.
· Напишите уравнения ионизации [Cd(NH3)4]Cl2 и K2[Cd(CN)4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 82
· Назовите следующие соединения: K2[HgI4], [Ag(NH3)2]NO3, [Pt(NH3)2Cl4].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [HgI4]2-, [Ag(NH3)2] +.
· Напишите уравнения ионизации [Fe(NH3)6]Cl3 и Na3[Fe(CN)6] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы устойчивости этих комплексов.
Задание 83
· Назовите следующие соединения: Na[Au(CN)2], [Co(NH3)6]Cl3, [Pt(NH3)2Cl2].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Со(NH3)6] 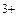 и [Au(CN)2] -.
и [Au(CN)2] -.
· Напишите уравнения ионизации [Co(NH3)6]Cl3 и K2[Cd(CN)4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 84
· Назовите следующие соединения: K4[Fe(CN)6], [Cu(NH3)2]NO3, [Co(NH3)3Cl3].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Fe(CN)6]4-, [Cu(NH3)2] +.
· Напишите уравнения ионизации [Ag(NH3)2]NO3 и Na3[CrF6] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 85
· Назовите следующие соединения: H[FeCl4], [Mn(OH2)6](NO3)2, [Cr(CO)6].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитного [Cr(СO)6] и парамагнитного [FeCl4] - комплексов.
· Напишите уравнения ионизации [Ni(NH3)6]Cl2 и K4[Ni(CN)6] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общих констант устойчивости этих комплексов.
Задание 86
· Назовите следующие соединения: K2[Zn(OH)4], [Cu(NH3)2]Cl, [Co(OH2)3F3].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Zn(OH)4]2-, [Cu(NH3)2] +.
· Напишите уравнения ионизации [Mn(NH3)6]Cl2 и Na4[MnF6] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 87
· Назовите следующие соединения: Na[Ag(CN)2], [Mn(NH3)6]Cl2, [Ru(CO)5].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Ru(CO)5] и [Ag(CN)2] -.
· Напишите уравнение ионизации [Co(NH3)6]Cl3 и K3[CoF6] в растворе и уравнение диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 88
· Назовите следующие соединения: K3[Cr(OH)6], [Zn(OH2)4]SO4, [Rh(NH3)3Cl3].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру комплексов [Zn(OH2)4] 2+, [Cr(OH)6] 3-.
· Напишите уравнения ионизации [Fe(NH3)6]Cl3 и Na[AuCl4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы устойчивости этих комплексов.
Задание 89
· Назовите следующие соединения: [Zn(NH3)4]Cl2, K2[MnF6], [Pd(NH3)2Cl2].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру комплексов [MnF6] 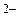 и [Zn(NH3)4] 2+.
и [Zn(NH3)4] 2+.
· Напишите уравнения ионизации [Cd(NH3)4]Cl2 и K2[Cd(CN)4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 90
· Назовите следующие соединения: K[AgI2], [Hg(NH3)4](NO3)2, [Co(NH3)3(OH)3].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [AgI2] -, [Hg(NH3)4] 2+.
· Напишите уравнения ионизации [Ag(NH3)2]NO3 и Na[Au(CN)4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 91
· Назовите следующие соединения: Na[Au(OH)4], [W(CO)6], [Cu(NH3)4(OH2)2]SO4.
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [W(СO)6] и [(Au(OH)4] -.
· Напишите уравнения ионизации [Co(NH3)6]Cl3 и H2[CoCl4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 92
· Назовите следующие соединения: [Cd(NH3)4]SO4, K3[Co(CN)6], [Pt(NH3)4Cl2].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Co(CN)6] 3-, [Cd(NH3)4] 2+.
· Напишите уравнения ионизации [Fe(NH3)6]Cl3 и H[FeCl4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 93
· Назовите следующие соединения: K[AuCl2], [Mn(OH2)6]SO4, [Ni(CO)4].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Ni(СO)4] и [AuCl2] -.
· Напишите уравнения ионизации [Cr(NH3)6]Cl3 и K2[Hg(CN)4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов
Задание 94
· Назовите следующие соединения: K2[Cd(CN)4], [V(OH2)6]Cl2, [Pt(NH3)4Br2].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру комплексов [Cd(CN)4] 2- и [V(OH2)6] 2+.
Напишите уравнение ионизации [Mn(NH3)6]Cl2 и K2[MnCl4] в растворе и уравнение диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 95
· Назовите следующие соединения: K2[MnCl4], [Ni(NH3)6]SO4, [Os(CO)5].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитного [Os(CO)5] и парамагнитного [MnCl4] 2- комплексов.
· Напишите уравнения ионизации [Cd(NH3)4]Cl2 и K2[CdBr4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 96
· Назовите следующие соединения: K[AgCl2], [Pd(NH3)4Br2], [Rh(NH3)6]Cl3.
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Rh(NH3)6] 3+, [AgCl2] -.
· Напишите уравнения ионизации [Ni(NH3)6]Cl2 и Na[Au(CN)4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 97
· Назовите следующие соединения: [Fe(OH2)6]Cl3, K2[Hg(CN)4], [Mo(CO)6].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Mo(CO)6] и [Hg(CN)4] 2-.
· Напишите уравнения ионизации [Rh(NH3)6]Cl3 и K[AgBr2] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 98
· Назовите следующие соединения: K[AgBr2], [Hg(NH3)2Cl2], [Ir(NH3)6]Cl3.
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Ir(NH3)6] 3+, [AgBr2] -.
· Напишите уравнения ионизации [Zn(NH3)4]Cl2 и Na3[Co(CN)6] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 99
· Назовите следующие соединения: K2[HgBr4], [Fe(CO)5]. [Co(OH2)6]Cl2.
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Fe(CO)5] и [HgBr4] 2 -.
· Напишите уравнения ионизации [Cd(NH3)4]Cl2 и K3[CrCl6] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Задание 100
· Назовите следующие соединения: K[Cu(CN)2], [Ti(OH2)6]Cl3, [Zn(NH3)2Cl2].
· Определите степень окисления центрального атома, его координационное число и тип комплекса (катионный, анионный или нейтральный).
· Определите пространственную структуру диамагнитных комплексов [Zn(NH3)2Cl2], [Cu(CN)2] -.
· Напишите уравнения ионизации [Ni(NH3)6]Cl2 и Na2[MnCl4] в растворе и уравнения диссоциации образующихся при этом комплексных ионов. Приведите выражения для общей константы нестойкости этих комплексов.
Тема 4. РАСТВОРЫ
Раствором называют однофазную систему, состоящую из двух или более компонентов. Растворителем считают тот компонент, агрегатное состояние которого не изменяется при образовании раствора, или тот компонент, количество которого преобладает. Остальные компоненты раствора относят к растворенным веществам. В зависимости от агрегатного состояния различают газовые, жидкие и твердые растворы. Наибольшее значение в природе, жизни человека, промышленности имеют жидкие растворы. Среди них различают истинные и коллоидные растворы. Они отличаются размерами частиц. Частицы растворенного вещества в истинных растворах имеют размеры 10–7–10–8 см, в коллоидных – 10–3–10–7 см. Мы остановимся на истинных жидких растворах.
Одной из важнейших характеристик раствора является его концентрация, которая выражает содержание растворенного вещества, отнесенное к массе или объему раствора. Известно много способов выражения концентрации растворов: массовая доля растворенного вещества, молярная, нормальная илимолярная концентрация химического эквивалента, моляльная концентрации, титр и др. Рассмотрим массовую долю растворенного вещества, молярную, моляльную концентрации и титр.
1. Массовая доля растворенного вещества 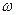 (читается «омега») – отношение массы растворенного вещества к массе раствора:
(читается «омега») – отношение массы растворенного вещества к массе раствора:
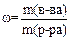 .
.
Ее выражают в долях единицы или в процентах. Так, запись 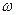 (KNO3) = 0,15 или 15% означает, что в 100 г раствора содержатся 15 г KNO3 и 85 г воды.
(KNO3) = 0,15 или 15% означает, что в 100 г раствора содержатся 15 г KNO3 и 85 г воды.
2. Молярная концентрация См , или молярность М, – число молей растворенного вещества в одном литре раствора, определяется соотношением
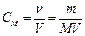 ,
,
где См – молярная концентрация, моль/л;
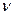 – количество вещества, моль;
– количество вещества, моль;
m – масса растворенного вещества, г;
М – молярная масса растворенного вещества, г/моль;
V - объем раствора, л.
3. Моляльная концентрация С m, или моляльность, – число молей растворенного вещества в 1 кг растворителя, определяется соотношением
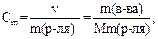
где Сm - моляльная концентрация, моль/кг;
v – количество вещества, моль;
m – масса растворенного вещества, г;
М – молярная масса растворенного вещества, г/моль
m(р–ля) – масса растворителя, кг.
4. Титром Т раствора называют число граммов растворенного вещества в 1 мл (см3) раствора.
Между массовой долей вещества и молярной или моляльной концентрациями существуют соотношения, которые полезно использовать при решении задач:
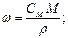
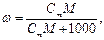
где ρ – плотность раствора, г/мл или г/см3.
Все растворы проявляют некоторые общие свойства, которые зависят только от концентрации молекул, ионов в растворе. Такие свойства называют коллигативными. К ним относят: понижение давления насыщенного пара раствора по сравнению с давлением насыщенного пара чистого растворителя; повышение температуры кипения и понижение температуры замерзания растворов по сравнению с чистым растворителем; осмотическое давление.
При испарении над жидкостью возникает паровая фаза. Давление пара над раствором ниже давления пара над растворителем. Оно понижается за счет уменьшения концентрации молекул растворителя в растворе. Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества (первый закон Рауля). Это отражается на температуре кипения и замерзания растворов. Растворитель закипает при температуре, при которой давление насыщенного пара равно внешнему давлению. Давление паров над раствором меньше, чем над чистым растворителем, и, следовательно, необходима более высокая температура, чтобы давление насыщенного пара над раствором было равно внешнему давлению. Поэтому температура кипения раствора выше, чем температура кипения чистого растворителя.
Из первого закона Рауля вытекают два следствия, которые известны как второй закон Рауля: повышение температуры кипения раствора ΔТкип и понижение температуры его замерзания ΔТзам пропорциональны концентрации раствора:
ΔТкип = iECm,
ΔТзам = iKCm,
где Cm – моляльная концентрация раствора;
i – коэффициент диссоциации, показывающий, во сколько раз число частиц в растворе электролита больше числа частиц в растворе неэлектролита той же концентрации (для раствора неэлектролита i = 1, для раствора электролита i > 1);
Е – эбулиоскопическая постоянная растворителя, К∙кг/моль;
К – криоскопическая постоянная растворителя, К∙кг/моль.
Эбулиоскопическая и криоскопическая постоянные растворителя показывают, на сколько градусов повышается температура кипения и понижается температура замерзания при растворении 1моль неэлектролита в 1 кг растворителя.
Пример 1. К 25 мл раствора серной кислоты с массовой долей H2SO4 85,16% (плотность 1,78 г/мл) прибавили 100 мл воды. Рассчитайте массовую долю H2SO4 в полученном растворе и молярную концентрацию раствора (плотность 1,19 г/мл).
Решение
1. Рассчитываем массу 25 мл первоначального раствора серной кислоты:
m (р-ра) = V (р-ра) × ρ (р-ра),
где m (р-ра) – масса раствора, г;
V – объем раствора, мл;
ρ – плотность раствора, г/мл.
m (р-ра) = 25 мл × 1,78 г/мл = 44,5 г.
2. Рассчитываем массу H2SO4 в растворе:
m(H2SO4) = m(р-ра) × ω(H2SO4),
где m (H2SO4)- масса H2SO4 в первоначальном растворе, г;
ω (H2SO4) - массовая доля H2SO4 в растворе.
m (H2SO4) = 44,5 г × 0,8516 = 37,9 г.
3. Рассчитываем массу 100 мл Н2О:
m (Н2О) = V(Н2О)× ρ (Н2О) = 100 мл × 1,0 г/мл = 100 г.
4. Рассчитываем массу полученного раствора
m1 (р-ра) = m (р-ра) + m (Н2О) = 44,5 г+ 100 г = 144,5 г.
5. Рассчитываем массовую долю H2SO4 в полученном растворе:
ω (H2SO4) = m (H2SO4): m1 (р-ра) = 37,9 г: 144,5 г = 0,2623 или 26,23 %
6. Рассчитываем количество вещества H2SO4:
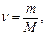
моль
где m – масса вещества, г;
М – молярная масса вещества, г/моль; (M(h2so4) = 98 г/моль).
ν(H2SO4) = 37,9 г: 98 г/моль = 0,39 моль.
7. Рассчитываем объем полученного раствора:
V(р-ра) = m1 (р-ра): ρ (р-ра) = 144,5 г: 1,19 г/мл = 121,43 мл.
8. Рассчитываем молярную концентрацию полученного раствора:
См = ν (H2SO4): V(р-ра) = 0,39 моль: 0,12 л = 3,18 моль/л.
Ответ: ω (H2SO4) = 26,23 %; См = 3,18 моль/л.
Пример 2. Рассчитайте объем раствора азотной кислоты с массовой долей 19,19% (плотность 1,11 г/мл), необходимый для приготовления 3 л раствора кислоты молярной концентрации 0,2 М.
Решение
1. Рассчитываем молярную массу HNO3:
M(HNO3) = M(H)+ M (N)+3M(O) = 1×1 + 1×14 + 3×16 = 63 г/моль.
2. Рассчитываем количество вещества HNO3, необходимое для приготовления 3 л 0,2 М раствора:
ν(HNO3) = CM × V(р-ра) = 0,2 моль/л × 3 л = 0,6 моль.
3.Рассчитываем массу HNO3, необходимую для приготовления 3л 0,2 М раствора:
m(HNO3) = ν(HNO3)× M(HNO3) = 0,6×63 г/моль = 37,8 г.
4. Рассчитываем массу исходного раствора HNO3:
m(р-ра) = m(HNO3): ω(HNO3) = 37,8 г: 0,1919 = 196,98 г.
5.Рассчитываем объем исходного раствора HNO3:
V(р-ра) = m(р-ра): ρ(р-ра) = 196,98 г: 1,11 г/мл = 177,5 мл.
Ответ: V(р-ра) = 177,5 мл.
Пример 3. Определите температуру кипения и температуру замерзания 5% водного раствора этилового спирта. Эбулиоскопическая постоянная воды Э = 0,52 К∙ кг/моль, криоскопическая постоянная воды К = 1,86 К∙ кг/моль.
Решение
Ткип(раствора) = Ткип(Н2О) + ΔТкип.
Тзам(раствора) = Тзам(Н2О) – ΔТзам.
Для неэлектролита: ΔТкип = Э× Сm; ΔТзам = К× Сm, где Сm – моляльная концентрация водного раствора спирта. Сm рассчитывают по формуле
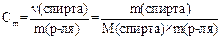 ,
,
где М – молярная масса этилового спирта, г/моль;
m(р-ля) – масса растворителя, кг.
Для определения моляльной концентрации раствора Сm проводим следующие действия.
1. Определяем массу этилового спирта, содержащуюся в 5% водном растворе:
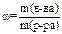
m(C2H5OH) = m(р-ра) × ω(р-ра) = 100г × 0,05=5 г.
2. Определяем массу воды, содержащуюся в 5% водном растворе этилового спирта:
M(H2O) = m(р-ра) – m(в-ва)= 100 – 5 = 95 г.
3. Определяем моляльность раствора:
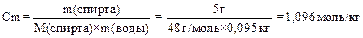
4. Определяем ΔТкип :
ΔТкип = 0,52 К∙ кг/моль × 1,096 моль/кг = 0,52 К или 0,520С. Тогда
Ткип(раствора) = Ткип(Н2О) + ΔТкип = 1000С + 0,520С = 100,520С
5. Определяем ΔТзам:
ΔТзам = 1,86 К∙ кг/моль × 1,096 моль/кг = 2,038 К или 2,0380С. Тогда
Тзам(раствора) = Тзам (Н2О) – ΔТзам = 00С – 2,0380С = –2,0380С.
Ответ: температура кипения и замерзания 5% водного раствора спирта составляет 100,520С и –2,0380С соответственно.
Пример 4. Рассчитайте массовую долю водного раствора глюкозы С6Н12О6, температура кипения которого 100,50С. Эбулиоскопическая постоянная воды Э = 0,52 К∙ кг/моль.
Решение
Первый способ
1. Определяем, на сколько градусов повысилась Ткип раствора по сравнению с Ткипрастворителя:
Ткип(раствора) = Ткип(Н2О) + ΔТкип, тогда
ΔТкип = Ткип(раствора) - Ткип(Н2О) = 100,5 -100,0 = 0,50С или 0,5 К.
2. Определяем моляльную концентрацию раствора. Для раствора неэлектролита
ΔТкип = Э ∙ С; С = ΔТкип / Э;
С = 0,5 К / 0,52 К∙ кг/моль = 0,961 моль/кг.
3. Определяем массу глюкозы, содержащейся в 1 кг растворителя:
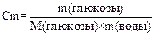 ,
,
где Сm – моляльная концентрация глюкозы; М(С6Н12О6) = 180 г/моль.
m(С6Н12О6) = Сm× M(С6Н12О6) × m(Н2О)
m(С6Н12О6) = 0,961 моль/кг × 180 г/моль × 1 кг = 173,1 г.
4. Определяем массу раствора:
m(р-ра) = m(С6Н12О6) + m(Н2О) = 1173 г.
5. Определяем массовую долю глюкозы:
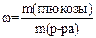 ; ω = 173 г / 1173 г = 0, 147 или 14,7%.
; ω = 173 г / 1173 г = 0, 147 или 14,7%.
Второй способ.
1. Определяем, на сколько градусов повысилась Ткип раствора по сравнению с Ткипрастворителя:
Ткип(р-ра) = Ткип(Н2О) + ΔТкип.
Тогда
ΔТкип = Ткип(р-ра) - Ткип(Н2О) = 100,5 -100,0 = 0,50С или 0,5 К.
2. Определяем моляльную концентрацию раствора. Для раствора неэлектролита
ΔТкип = Э ∙ С; С = ΔТкип / Э
С = 0,5 К / 0,52 К∙ кг/моль = 0,961 моль/кг.
3. Для расчета массовой доли глюкозы используем формулу
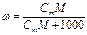 ;
;
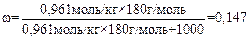 или 14,7%.
или 14,7%.
Ответ: ω = 14,7%
Контрольные задания
Задание 101. К 100 мл раствора серной



 и др.), гидроксид-ион (ОН–), полярные молекулы (H2O, NH3, CO и др.) и сложные органические молекулы. В состав внутренней сферы одного соединения могут входить различные лиганды, например [Co(NH3)4Cl2]Cl. Число лигандов при комплексообразователе определяет координационное число центрального атома. Так, в соединении K[Ag(CN)2] координационное число серебра равно двум; в [Co(NH3)4Cl2]Cl координационное число кобальта равно шести.
и др.), гидроксид-ион (ОН–), полярные молекулы (H2O, NH3, CO и др.) и сложные органические молекулы. В состав внутренней сферы одного соединения могут входить различные лиганды, например [Co(NH3)4Cl2]Cl. Число лигандов при комплексообразователе определяет координационное число центрального атома. Так, в соединении K[Ag(CN)2] координационное число серебра равно двум; в [Co(NH3)4Cl2]Cl координационное число кобальта равно шести.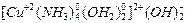 – гидроксид диакватетраамминмеди (II). Заряд комплексного иона равен заряду внешней сферы, взятому с противоположным знаком, следовательно, заряд комплексного иона 2+, комплекс катионный. Центральный атом (ц.а.) – медь, его окружают четыре молекулы аммиака и две молекулы воды, значит координационное число ц.а. равно 6. Лигандами являются нейтральные молекулы, поэтому степень окисления ц.а. равна заряду комплекса (степень окисления меди +2).
– гидроксид диакватетраамминмеди (II). Заряд комплексного иона равен заряду внешней сферы, взятому с противоположным знаком, следовательно, заряд комплексного иона 2+, комплекс катионный. Центральный атом (ц.а.) – медь, его окружают четыре молекулы аммиака и две молекулы воды, значит координационное число ц.а. равно 6. Лигандами являются нейтральные молекулы, поэтому степень окисления ц.а. равна заряду комплекса (степень окисления меди +2).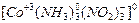 – тринитритотриамминкобальт (III); центральный атом – кобальт (степень окисления кобальта +3), координационное число ц.а. равно 6, комплекс нейтральный.
– тринитритотриамминкобальт (III); центральный атом – кобальт (степень окисления кобальта +3), координационное число ц.а. равно 6, комплекс нейтральный.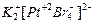 – тетрабромоплатинат (II) калия; центральный атом – платина (степень окисления платины +2), координационное число ц.а. равно 4, комплекс анионный.
– тетрабромоплатинат (II) калия; центральный атом – платина (степень окисления платины +2), координационное число ц.а. равно 4, комплекс анионный.
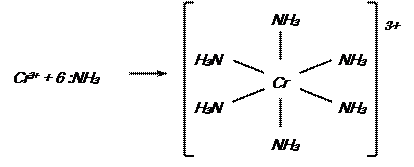
 и [Ni(CN)4]
и [Ni(CN)4] 

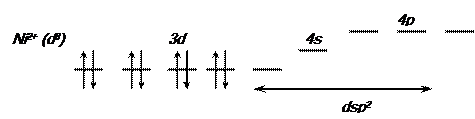
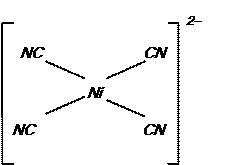 Тип гибридизации – dsp2; структура – плоский квадрат. Структуру комплексов определяют по типу гибридизации атомных орбиталей комплексообразователя (см. табл. 3.6).
Тип гибридизации – dsp2; структура – плоский квадрат. Структуру комплексов определяют по типу гибридизации атомных орбиталей комплексообразователя (см. табл. 3.6).
 – комплексообразователь (M)
– комплексообразователь (M) – лиганд (L)
– лиганд (L)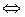 K+ + [Ag(CN)2] -
K+ + [Ag(CN)2] - 
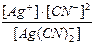 = 1,41∙10
= 1,41∙10 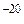 .
.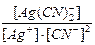 = 7,08∙10
= 7,08∙10 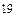 .
. С). Очевидно, что ион [Ag(CN)2]- более устойчив, чем амминокомплекс серебра. Поэтому при добавлении к водному раствору, содержащему комплексы [Ag(NH3)2] +, цианид-ионов CN - будет протекать реакция замещения во внутренней сфере молекул NH3 на цианид-ионы CN -:
С). Очевидно, что ион [Ag(CN)2]- более устойчив, чем амминокомплекс серебра. Поэтому при добавлении к водному раствору, содержащему комплексы [Ag(NH3)2] +, цианид-ионов CN - будет протекать реакция замещения во внутренней сфере молекул NH3 на цианид-ионы CN -: [Ag(CN)2] - + 2NH3 .
[Ag(CN)2] - + 2NH3 .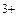 и диамагнитного [AuCl4] - комплексов.
и диамагнитного [AuCl4] - комплексов.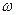 (читается «омега») – отношение массы растворенного вещества к массе раствора:
(читается «омега») – отношение массы растворенного вещества к массе раствора: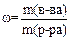 .
.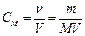 ,
,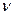 – количество вещества, моль;
– количество вещества, моль;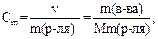
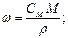
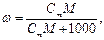
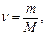
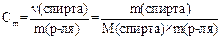 ,
,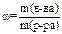
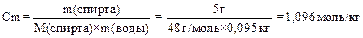
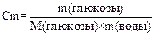 ,
,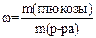 ; ω = 173 г / 1173 г = 0, 147 или 14,7%.
; ω = 173 г / 1173 г = 0, 147 или 14,7%.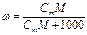 ;
;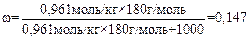 или 14,7%.
или 14,7%.


