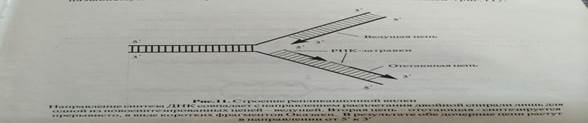
Участок молекулы днк в котором происходит расплетение двух ее нитей и начинается репликация, образует специфичную структуру, называемую за ее характерной вид репликативнойвилки.сигналом к началу репликации служит связывание со стартовым или о-сайтом особого регуляторного белка.прокариоты имеют один стартовый сайт, эукариоты- множества стартовых сайтов.
Репликация отстающей цепи начинается: 1 с активации праймазыхеликазой.активированная праймаза синтезирует рнк-праймеры длиной 10-20 нуклеотидов каждая.2 рнкпраймеры узнаются днк рол 3 НЕ и используются для синтеза днк-фрагментов(фрагментов оказаки). Данный процесс начинается с того, что каждый вновь синтезированный праймер узнается гамма субьединицей, затем происходит присоединение веттасубьединицей фермента. Праймер соединенный с бетта связывается с кор-ферментом. После образования комплекса праймербеттасубьединицаднк рол 3 НЕ –кло фермент днк рол 3 НЕ, начинается синтез фрагментов оказаки.3. после завершения синтеза фрагментов оказакирнк-затравки удаляются днк-полимеразой с 1 последующим заполнением бреши в молекуле днк нуклеотидами, комплементарными матричной цепи.4 концы фрагментов оказаки сшиваются между собой днк-лигазой с образованием единой, целостной молекулы днк. Лидирующая цепь: стадия инициации репликации ведущей цепи протекает сходным образом за исключением предварительного синтеза единичного праймера с помощью фермента рнк-полимеразы.рост лидирующей цепи происходит при помощи фермента днк рол 3НЕ. Завершают репликацию ведущей цепи фермента днк-полимеразой 1 и днклигаза, действующие аналогичным образом, как и при репликации отстающей цепи.
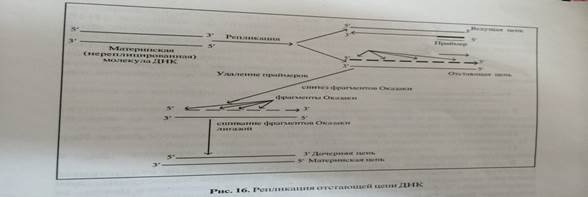
6 Перечислить основные ферменты, обеспечивающие репликацию ДНК, и объяснить их роль в процессе репликации
Репликация днк. Ферменты репликации
Репликация ДНК — ключевое событие в ходе деления клетки. Принципиально, чтобы к моменту деления ДНК была реплицирована полностью и при этом только один раз. Это обеспечивается определёнными механизмами регуляции репликации ДНК. Репликация проходит в три этапа:
1. инициация репликации
2. элонгация
3. терминация репликации.
ДНК – полимераза
ДНК-полимераза — фермент, участвующий в репликации ДНК. Ферменты этого класса катализируют полимеризацию дезоксирибонуклеотидов вдоль цепочки нуклеотидов ДНК, которую фермент «читает» и использует в качестве шаблона. Тип нового нуклеотида определяется по принципу комплементарности с шаблоном, с которого ведётся считывание. Собираемая молекула комплементарна шаблонной моноспирали и идентична второму компоненту двойной спирали.
Выделяют ДНК-зависимую ДНК-полимеразу, использующую в качестве матрицы одну из цепей ДНК, и РНК-зависимую ДНК-полимеразу, способную также к считыванию информации с РНК (обратная транскрипция).
ДНК-полимеразу считают холоферментом, поскольку для нормального функционирования она требует присутствия ионов магния в качестве кофактора. В отсутствии ионов магния о ней можно говорить как об апоферментe.
ДНК-полимераза начинает репликацию ДНК, связываясь с отрезком цепи нуклеотидов. Среднее количество нуклеотидов, присоединяемое ферментов ДНК-полимеразой за один акт связывания/диссоциации с матрицей, называют процессивностью.
ДНК – лигазы
Лигаза — фермент, катализирующий соединение двух молекул с образованием новой химической связи (лигирование). При этом обычно происходит отщепление (гидролиз) небольшой химической группы от одной из молекул.
Лигазы относятся к классу ферментов EC 6.
В молекулярной биологии лигазы разделяют на две большие группы — РНК-лигазы и ДНК-лигазы. ДНК-лигаза, осуществляющая репарацию ДНК
ДНК-лигазы — ферменты, катализирующие ковалентное сшивание цепей ДНК в дуплексе при репликации, репарации и рекомбинации. Они образуют фосфодиэфирные мостики между 5'-фосфорильной и 3'-гидроксильной группами соседних дезоксинуклеотидов в местах разрыва ДНК или между двумя молекулами ДНК. Для образования этих мостиков лигазы используют энергию гидролиза пирофосфорильной связи АТФ. Один из самых распространённых коммерчески доступных ферментов — ДНК-лигаза бактериофага Т4.
ДНК – геликазы
ДНК геликазы - ферменты раскручивающие двуцепочечную спираль ДНК с затратой энергии гидролиза трифосфатов NTP. Образуемая одноцепочечная ДНК участвует в различных процессах, таких как репликация, рекомбинация, и репарация. ДНК геликазы необходимы для репликации, репарации, рекомбинации и транскрипции. Геликазы присутствуют во всех организмах.
ДНК-топоизомеразы
ДНК-топоизомеразы—ферменты, изменяющие степень сверхспиральности и тип сверхспирали. Путём одноцепочечного разрыва они создают шарнир, вокруг которого нереплецированный дуплекс ДНК, находящейся перед вилкой, может свободно вращаться. Это снимает механическое напряжение, возникающее при раскручивании двух цепей в репликативной вилке, что является необходимым условием для её непрерывного движения. Кроме того, топоизомеразы (типа II) обеспечивают разделение или образование катенанов - сцепленных кольцевых ДНК (образуются в результате репликации кольцевой ДНК), а также устранение узлов и спутанных клубков из длинной линейной ДНК. Существует два типа топоизомераз. Топоизомеразы типа I уменьшают число сверхвитков в ДНК на единицу за один акт. Эти топоизомеразы надрезают одну из двух цепей, в результате чего фланкирующие дуплексные области могут повернутся вокруг интактной цепи, и затем воссоединяют концы разрезанной цепи. Эта реакция не требует энергии АТФ, т.к. энергия фосфодиэфирной связи сохраняется благодаря тому, что тирозиновый остаток в молекуле фермента выступает то в роли акцептора, то в роли донора фосфорильного конца разрезанной цепи.
Топоизомеразы типа II вносят временные разрывы в обе комплиментарные цепи, пропускают двухцепочечный сегмент той же самой или другой молекулы ДНК через разрыв, а затем соединяют разорванные концы. В результате за один акт снимаются два положительных или отрицательных сверхвитка. Топоизомеразы типа II тоже используют тирозиновые остатки для связывания 5¢-конца каждой разорванной цепи в то время. когда другой дуплекс проходит через место разрыва.
Праймаза
Праймаза—фермент, обладающий РНК-полимеразной активностью; служит для образования РНК-праймеров, необходимых для инициации синтеза ДНК в точке ori и дальнейшем для синтеза отстающей цепи.

7 Нарисовать и объяснить причины недорепликации, механизмы удлинения концов линейных молекул ДНК
Известно, что ДНК-полимеразы, синтезируя дочернюю цепь ДНК, прочитывают родительскую цепь в направлении от ее 3'-конца к 5'-концу. Соответственно дочерняя цепь синтезируется в направлении от 5' к 3'. В противоположном направлении синтез цепи ДНК фермент катализировать не может. Кроме того, ДНК-полимераза начинает синтез только со специального РНК-праймера - короткой РНК-затравки, комплементарной ДНК. После окончания синтеза ДНК РНК-праймеры удаляются, а пропуски в одной из дочерних цепей ДНК заполняются ДНК-полимеразой. Однако на 3'-конце ДНК такой пропуск заполнен быть не может, и поэтому 3'-концевые участки ДНК остаются однотяжевыми, а их 5'-концевые участки - недореплицированными. Отсюда ясно, что каждый цикл репликации хромосом будет приводить к их укорочению и прежде всего будет сокращаться длина теломерной ДНК.
Первым на проблему "концевой недорепликации ДНК" обратил внимание А.М. Оловников в 1971 году. Он высказал гипотезу о том, что потеря концевых последовательностей ДНК вследствие их недорепликации ведет к старению клетки. Иными словами, предполагалось, что процесс укорочения теломер и есть тот часовой механизм, который определяет репликативный потенциал "смертной" клетки, и когда длина теломер становится угрожающе короткой, этот механизм предотвращает дальнейшее деление клетки. А.М. Оловников предположил также, что в нестареющих клетках (а к ним кроме раковых относятся зародышевые, стволовые и другие генеративные клетки) должна существовать специализированная ферментативная система, которая контролирует и поддерживает длину теломерной ДНК.
Теломераза.
Теломераза — фермент, добавляющий особые повторяющиеся последовательности ДНК (TTAGGG у позвоночных) к 3'-концу цепи ДНК на участках теломер, которые располагаются на концах хромосом в эукариотических клетках. Теломеры содержат уплотненную ДНК и стабилизируют хромосомы.
Теломераза была впервые обнаружена в 1985 году у равноресничной инфузории Tetrahymena thermophila. Впоследствии она была обнаружена в дрожжах, растениях, животных, в.т.ч. яичниках человека и иммортализованных (бессмертных) линиях раковых клеток Hela.
Теломераза является ДНК-полимеразой, достраивающей 3'-концы линейных молекул ДНК хромосом короткими(6-8 нуклеотидов), повторяющимися последовательностями(у позвоночных она представлена нуклеотидами ТТАГГГ). Теломераза называется также ДНК-нуклеотидилэкзотрансферазой или теломерной терминальной трансферазой. Она состоит из белков и РНК, выполняющей роль матрицы для удлинения молекулы ДНК повторами нуклеотидов. Длина теломеразной РНК составляет от 150(простейшие) до 1400 нуклеотидов у дрожжей. У человека ее протяженность составляет 450 нуклеотидов.
Принцип действия теломеразы основан на удлинении не вновь синтезированной дочерней цепи, а материнской цепи ДНК. Процесс удлинения(достраивания) материнской(матричной) цепи ДНК теломеразой происходит до того, как эндонуклеазы отщепляет концевые нуклеотиды дочерней цепи.
По составу теломерных повторов в теломерах ДНК различают Г-цепь (гуаниновая цепь) и Ц-цепь (цитозиновая цепь). Обе цепи входят в состав двуцепочной молекулы ДНК. Теломераза удлиняет Г-цепь каждой теломеры.
РНК, содержащаяся в составе теломеразы, имеет матричный участок с помощью которого теломераза распознает теломерный повтор. После распознавания теломеры и связывания теломеразы с молекулрй ДНК последовательность оснований в составе молекулы полимеразы: 5'-ЦААЦЦЦАА-3' синтезирует последовательность, комплиментарную с последовательностью в теломерном повторе: 5'-ТТГГГГ-3'. Нуклеотиды ААЦ в РНК теломеразы остаются неспаренными, к ним присоединяются нуклеотиды ТТГ молекулы ДНК. Данный процесс осуществляется путем перемещения теломеразы на самый конец теломерной последовательности ДНК. В результате этого конец материнской ДНК удлиняется на повтор нуклеотидов-ТТГГГГТТГ.
Процесс образования нового теломерного повтора носит название элонгации.
Образование следующего теломерного повтора происходит путём перемещения теломеразы(вместе с РНК) на один повтор к 3'-концу удлиняемой цепи ДНК. Процесс перемещения теломеразы носит название транслокации. Таким образом процесс наращивания теломерного участка материнской хромосомы включает в себя этапы элонгации и транслокации теломеразы.
В конечном итоге теломераза может удлинить цепь ДНК на несколько десятков или сотен теломерных повторов(количество повторов зависит по-видимому от видовой принадлежности организма и количества делений,пройденных той или иной клеткой).
На удлиненной части ДНК достраивается дочерняя цепь ДНК. Мутации в теломерной РНК приводят не к синтезу ошибочных нуклеотидов, а к утрате активности всей теломеразы.
Следует особо подчеркнуть, что теломераза функционирует и восстанавливает дочернюю молекулу ДНК только в генеративных, раковых и линиях иммортализованных(бессмертных) клеточных культурах.
В соматических клетках теломеразная активность отсутствует и, следовательно, теломеры соматических клеток постепенно, после каждой репликации, укорачиваются.
В этой связи было высказано предположение, что постепенное укорочение ДНК хромосом в процессе репликации, может лежать в основе ограниченного числа делений клеток, культивируемых in vitro. Данное ограничение носит название «лимита Хейфлика». Хейфлик показал в начале 60-х годов XX века зависимость числа клеточных делений от возраста человека. У новорожденных соматические клетки могут делиться 80-90 раз, а у 70-летних людей- только 20-30 раз.
Укорочение теломерных концов хромосом можно считать молекулярным индикатором количества делений, но не старения клетки.
Прекращение работы теломеразы, наблюдаемое в большинстве дифференцированных соматических клеток, является свидетельством их зрелости и одновременно специфическим сигналом для запуска процессов, приводящих клетки к естественной гибели(апоптозу). 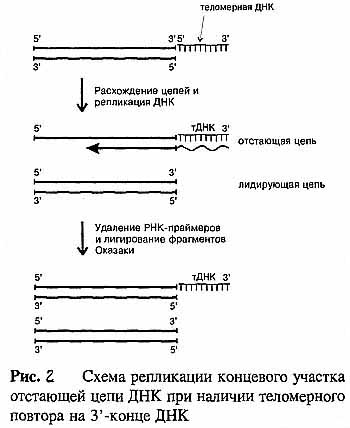
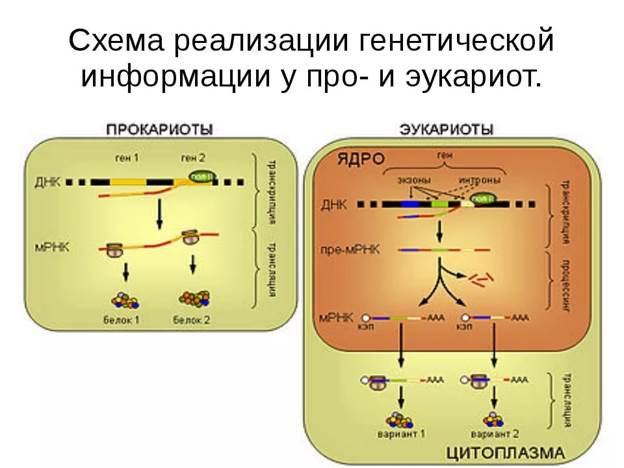
1. 8 9 Нарисовать, дать определение процессу транскрипции, охарактеризовать стадии транскрипции, строение и функции ферментов, обеспечивающих процесс транскрипции прокариот
ДНК-зависимая РНК-полимераза — это фермент, катализирующий синтез РНК. Он состоит из несколько субъединиц: двух α, одной β, одной β' и одной σ. Их комплекс называется холоферментом (α2ββ'σ) и имеет мол. массу (Мг) около 500 000. Фермент, лишенный σ-субъединицы, называется кор-ферментом. Для инициации транскрипции необходимы холо-фермент, нуклеозидтрифосфат (всегда АТР или GTP) и наличие специального участка в ДНК, называемого промотором. Когда полимераза связывается с промотором, происходит локальное расплетание двойной спирали ДНК и образуется открытый промоторный комплекс. Промотор - это участок молекулы ДНК, имеющий размер около 40 пар оснований и расположенный непосредственно перед участком инициации транскрипции. Синтез РНК всегда начинается с оснований А или G в «+»-цепи ДНК. Участок связывания холофермента расположен «левее» сайта инициации (в направлении 3' - 5' в «+»-цепи) на расстоянии примерно 10 оснований. Если сравнить последовательности оснований «+»-цепи ДНК у разных промоторов, то мы обнаружим, что они весьма близки, хотя и не идентичны. Эта так называемая последовательность Прибнова имеет вид TATPuATPu, где Рu означает пурин (А или G). Таким образом, холофермент связывается со специфической последовательностью или группой последовательностей. Обычно на расстоянии около 40 оснований «левее» участка инициации находится второе место связывания РНК-полимеразы, где, как полагают, происходит связывание а-субъединицы с ДНК.
Элонгация цепи РНК — это та стадия транскрипции, которая наступает после присоединения примерно восьми рибонуклеотидов. В этот момент РНК- полимераза претерпевает структурное изменение, при котором от комплекса отделяется σ-субъединица и остается кор-фермент (α2ββ'), катализирующий дальнейшее удлинение цепи РНК. При этом к цепи присоединяются те рибонуклеозидтрифосфаты, которые обеспечивают правильное спаривание с «—»-цепью ДНК. Движущийся вдоль ДНК кор-фермент действует подобно застежке-молнии, «раскрывая» двойную спираль, которая замыкается позади фермента по мере того, как соответствующие основания РНК спариваются с основаниями ДНК в «—»-цепи. «Раскрытая» ферментом область простирается только на несколько пар оснований.
Терминация (прекращение роста) цепи РНК происходит на специфических участках ДНК, называемых терминаторами. Начало этих участков обычно обогащено GC-парами, а остальная последовательность — АТ-парами. GC-богатый участок часто представляет собой палиндром. Это означает, что при движении вдоль «+»-цепи в одном направлении, а вдоль «—»-цепи - в противоположном читается одна и та же последовательность оснований. В остановке синтеза РНК именно на терминаторе важную роль играет р-белок.
^ Посттранскрипционный процессинг — это процесс созревания, при котором первичный РНК-транскрипт модифицируется и превращается в зрелую РНК. Характер и степень модификации РНК зависят от типа РНК.
Молекулы мРНК у прокариот не подвергаются процессингу. У некоторых бактерий транскрипция и трансляция сопряжены, т. е. происходят одновременно. 5'-конец мРНК может транслироваться на рибосоме и затем подвергаться деградации еще до завершения синтеза ее 3'-конца. Молекулы тРНК вначале синтезируются в виде про-тРНК, которая примерно на 20% длиннее, чем соответствующая тРНК. Лишние последовательности, расположенные у 5'- и 3'- концов, удаляются с помощью таких ферментов, как рибонуклеазы Q и Р. Иногда молекула про-тРНК состоит из двух или более молекул тРНК, соединенных между собой. Их разделение также осуществляется с помощью рибонуклеаз. Если 3'-конец тРНК не несет концевой последовательности ССА, то эти основания присоединяются при постсинтетической модификации. Все тРНК содержат минорные основания, которые являются химически модифицированными формами четырех главных оснований (А, С, G и U).
Эта модификация происходит после завершения транскрипции. Гены рРНК прокариот расположены в транскрипционных блоках. Три генарРНК Е. coli (16S, 23S и 5S) располагаются вместе с генами нескольких тРНК в одном таком блоке и транскрибируются в виде одной молекулы РНК. Эти молекулы рРНК и тРНК отделены друг от друга спейсерной РНК. Расщепление первичного транскрипта на отдельные составляющие катализирует рибонуклеаза Q; поскольку этот фермент специфичен к двухцепочечной РНК, предполагают, что в области спейсеров образуются двухцепочечные шпильки, которые фермент узнает и вырезает.
^ 3. Транскрипция у эукариот
У эукариот для транскрипции используются три ДНК - зависимых РНК-полимеразы. Полимераза I локализована в ядрышке, где она катализирует синтез рРНК в виде большого первичного транскрипта, содержащего молекулы рРНК 18S, 5,8S и 28S. Полимераза II находится в нуклеоплазме и, вероятно, участвует в синтезе первичного транскрипта мРНК. Полимераза III также локализована в нуклеоплазме и участвует в синтезе тРНК и 5S-pPHK.
Синтез РНК включает стадии инициации, элонгации и терминации, но в этих процессах часто принимают участие другие ферменты и последовательности оснований, чем у прокариот. Например, промоторные последовательности у эукариот отличаются от таковых у прокариот. Однако первыми основаниями, включаемыми в РНК при инициации, являются, как и у прокариот, А или G.
Молекулы мРНК обычно образуются из больших по размеру молекул-предшественников, называемых гетерогенной ядерной РНК (гяРНК). Для образования зрелой мРНК эти молекулы подвергаются модификации по 5'- и З'-концами и сплайсингу. После такой модификации транскрипты переносятся из ядра в цитоплазму.
Сплайсинг гяРНК — это удаление последовательностей РНК, соответствующих интронам ДНК, и соединение участков, которые транскрибированы с кодирующих последовательностей (экзонов). Место сплайсинга должно быть определено с высокой точностью, поскольку ошибка даже в одно основание приведет к синтезу белка с неправильной аминокислотной последовательностью. Такая специфичность сплайсинга обеспечивается строго определенной последовательностью оснований в интроне, отвечающей обычно основаниям GU или GA в начале соответствующей РНК и основаниям AG - в конце.
Модификация 5'-конца мРНК приводит к образованию особой последовательности, называемой кэп-структурой. При модификации 3'-конца к нему присоединяется последовательность poly(A) длиной 150-200 нуклеотидов.
Процессинг тРНК у эукариот протекает по такому же механизму, как и у прокариот. Функционально активные молекулы образуются из более длинного предшественника, который подвергается расщеплению и модификации с включением минорных оснований.
Процессинг рРНК также аналогичен соответствующему процессу у прокариот. Первичный транскрипт содержит участки, отвечающие 18S-, 5,8S- и 28S-рРНК, разделенные спейсерами. Как и у прокариот, эти три рРНК образуются при расщеплении спейсерных последовательностей.
2. 10 Нарисовать и объяснить процессы созревания ядерной и-РНК эукариот
11 Рибонуклеиновая кислота (РНК) – это однонитевой биополимер, в качестве мономеров которого выступают нуклеотиды.
Матрицей для синтеза новых молекул РНК являются молекулы дезоксирибонуклеиновой кислоты (транскрипция РНК). Хотя в ряде случаев возможен и обратный процесс (образование новых ДНК на матрице РНК в ходе репликации некоторых вирусов). Также основой для биосинтеза РНК могут быть другие молекулы рибонуклеиновой кислоты (репликация РНК). В транскрипции РНК, происходящей в ядре клетки, участвует целый ряд ферментов, наиболее значимым из которых является РНК-полимераза.
Строение РНК
Молекула имеет однонитевое строение. Полимер. В результате взаимодействия нуклеотидов друг с другом молекула РНК приобретает вторичную структуру, различной формы (спираль, глобула и т.д.). Мономером РНК является нуклеотид (молекула, в состав которой входит азотистое основание, остаток фосфорной кислоты и сахар (пептоза)). РНК напоминает по своему строению одну цепь ДНК.
Нуклеотиды, входящие в состав РНК: гуанин, аденин, цитозин, урацил. Аденин и гуанин относятся к пуриновым основаниям, цитозин и урацил к пиримидиновым. В отличие от молекулы ДНК, в качестве углеводного компонента рибонуклеиновой кислоты выступает не дезоксирибоза, а рибоза. Вторым существенным отличием в химическом строении РНК от ДНК является отсутствие в молекуле рибонуклеиновой кислоты такого нуклеотида как тимин. В РНК он заменён на урацил.











