Массопередача в системах с твёрдой фазой представляет собой особенно сложный процесс. В этом процессе, кроме массоотдачи от поверхности раздела фазы в поток жидкости (газа, пара), имеет место и перемещение вещества в твёрдой фазе массопроводностью.
К указанным процессам представляется возможным отнести процессы адсорбции, сушки и выщелачивания (извлечение вещества растворителем из пор твёрдого тела).
Количество вещества, переместившегося в твёрдой фазе за счёт массопроводности, пропорционально градиенту концентрации, площади, перпендикулярной направлению потока вещества, и времени, то есть:
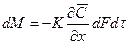 .
.
В этом уравнении коэффициент пропорциональности К (м2/ч), имеющий размерность коэффициента диффузии, может быть назван коэффициентом массопроводности.
При принятом законе массопроводности процесс перемешивания вещества внутри твёрдой фазы может быть описан дифференциальным уравнением массопроводности:
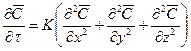 (11.70)
(11.70)
Коэффициент массопроводности зависит от природы проходящего процесса (адсорбция, сушка, выщелачивание), от ряда факторов, определяющих величину коэффициента молекулярной диффузии, и от структуры твёрдого пористого тела.
Диффузионный критерий Био:

Диффузионный критерий Фурье:
 ,
,
характеризующий изменение скорости потока вещества, перемещаемого массопроводностью в твёрдом теле.
Диффузионные критерии  и
и  должны войти в критериальное уравнение, которое описывает перемещение вещества в твёрдой фазе и является теоретической базой для обработки всех опытных исследований этого процесса. Дифференциальное уравнение массопроводности для простейших случаев одномерного перемещения вещества имеет аналитическое решение в виде:
должны войти в критериальное уравнение, которое описывает перемещение вещества в твёрдой фазе и является теоретической базой для обработки всех опытных исследований этого процесса. Дифференциальное уравнение массопроводности для простейших случаев одномерного перемещения вещества имеет аналитическое решение в виде:
 (11.74),
(11.74),
где  - параметрический критерий, представляющий собой безразмерную концентрацию распределяемого вещества в твёрдой фазе в точке с координатой х;
- параметрический критерий, представляющий собой безразмерную концентрацию распределяемого вещества в твёрдой фазе в точке с координатой х;  - концентрация в точке с координатой
- концентрация в точке с координатой 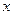 в момент времени
в момент времени  , соответствующий определённому
, соответствующий определённому  ;
;  - коэффициент, определяющий размер тела, составляющего твёрдую фазу;
- коэффициент, определяющий размер тела, составляющего твёрдую фазу; 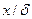 - безразмерная координата точки, в которой концентрация равна
- безразмерная координата точки, в которой концентрация равна 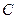 .
.
РАЗДЕЛ 2
АБСОРБЦИЯ
Абсорбция – поглощение газов или паров из газовых или паровых смесей жидкими поглотителями, называемыми абсорбентами. Этот процесс является избирательным и обратимым, что даёт возможность применять его не только с целью получения растворов газов в жидкостях, но также и для разделения газовых или паровых смесей.
В последнем случае после избирательной абсорбции одного или нескольких компонентов из газовой или паровой смеси проводят десорбцию – выделение этих компонентов из жидкости – и таким образом осуществляют разделение. Регенерированный абсорбент вновь возвращается на абсорбцию (круговой процесс).
Различают физическую абсорбцию и хемосорбцию. При физической абсорбции растворение газа не сопровождается химической реакцией. При хемосорбции абсорбируемый компонент вступает в химическую реакцию в жидкой фазе.
Примерами использования процессов абсорбции в технике могут служить разделение углеводородных газов на нефтеперерабатывающих установках, получение соляной кислоты, получение аммиачной воды, очистка отходящих газов с целью улавливания ценных продуктов или обезвреживание газосбросов и другие.
Аппаратурно-технологическое оформление процессов сравнительно просто, поэтому процессы абсорбции широко используются в технике.
- Равновесие в процессах абсорбции.
Условием равновесия между газовой и жидкой фазами является равенство температур и давлений обеих фаз и равенство химических потенциалов для всех компонентов обеих фаз.
При постоянстве температуры и давления в фазах химический потенциал распределяемого компонента пропорционален концентрациям его в фазах. Поэтому в состоянии равновесия между концентрациями распределяемого компонента в обеих фазах устанавливается некоторое соотношение, характеризуемое константой фазового равновесия, которая равна отношению распределяемого компонента в газовой фазе к его концентрации в жидкой фазе.
В общем случае константа фазового равновесия зависит от давления (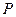 ), температуры (
), температуры (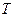 ) и концентрации распределяемого компонента (
) и концентрации распределяемого компонента (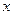 ) в жидкости:
) в жидкости:

В качестве основного закона, характеризующего равновесие в системе газ-жидкость, обычно используется закон растворимости газов в жидкостях, сформулированный Генри. Согласно этому закону при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:
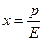 (12.1)
(12.1)
или
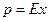 (12.2),
(12.2),
где 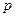 - парциальное давление газа над раствором в мм.рт.ст;
- парциальное давление газа над раствором в мм.рт.ст; 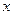 - концентрация газа в растворе в долях моля;
- концентрация газа в растворе в долях моля; 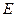 - коэффициент пропорциональности (коэффициент Генри) в мм.рт.ст.
- коэффициент пропорциональности (коэффициент Генри) в мм.рт.ст.
Коэффициент 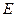 зависит от природы растворяющегося вещества и температуры:
зависит от природы растворяющегося вещества и температуры:
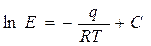 (12.3),
(12.3),
где 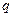 - теплота растворения газа в ккал/кмоль;
- теплота растворения газа в ккал/кмоль; 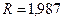 ккал/кмоль·град – универсальная газовая постоянная;
ккал/кмоль·град – универсальная газовая постоянная; 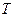 - абсолютная температура растворения в
- абсолютная температура растворения в 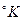 ;
; 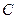 - постоянная, зависящая от природы газа и жидкости и определяемая опытным путём.
- постоянная, зависящая от природы газа и жидкости и определяемая опытным путём.
С ростом температуры растворимость газов в жидкостях уменьшается. При растворении газа в жидкости, температура жидкости обычно повышается вследствие выделения значительного количества тепла.
Количество тепла, выделяющегося при абсорбции, может быть найдено как:
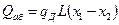 (12.4),
(12.4),
где 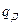 - дифференциальная теплота растворения в пределах измерения концентрации
- дифференциальная теплота растворения в пределах измерения концентрации 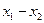 в ккал/кг;
в ккал/кг; 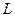 - количество абсорбента в кг.
- количество абсорбента в кг.
Если абсорбция ведётся без отвода тепла, то можно допустить, что всё выделяющееся тепло идёт на нагревание жидкости и температура последней повышается на величину:
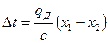 (12.5),
(12.5),
где с – теплоёмкость раствора в ккал/(кг·град).
Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть заменено равновесной концентрацией. Согласно закону Дальтона, парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси, то есть:
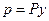 и
и 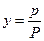 ,
,
где 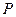 - общее давление газовой смеси;
- общее давление газовой смеси; 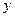 - концентрация распределяемого газа в смеси в мольных долях.
- концентрация распределяемого газа в смеси в мольных долях.
Сопоставляя последнее равенство с уравнением (12.22), найдём
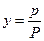 или
или 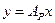 (12.6),
(12.6),
где 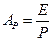 - константа фазового равновесия.
- константа фазового равновесия.
Уравнение (12.6) выражает зависимость между равновесными концентрациями распределяемого газа в газовой и жидкой фазах. Если заменить в этом уравнении концентрации 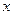 и
и 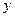 , выраженные в мольных долях, на
, выраженные в мольных долях, на 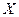 и
и 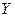 , выраженные в относительных мольных долях, то, имея в виду соотношения:
, выраженные в относительных мольных долях, то, имея в виду соотношения:
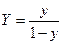 ,
, 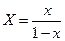 ,
, 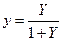 ,
, 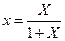 ,
,
уравнение (12.6) можно переписать так:
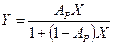 (12.7)
(12.7)
При незначительных концентрациях Х величина 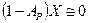 и уравнение (12.7) приобретает более простой вид:
и уравнение (12.7) приобретает более простой вид:
 (12.8)
(12.8)
На равновесные концентрации в процессах абсорбции оказывают существенное влияние вещества, добавочно растворённые в абсорбенте. Их присутствие уменьшает равновесную концентрацию газа в жидкости согласно закономерности, установленной Сеченовым в 1892 г.:
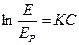 ,
,
где 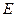 - коэффициент Генри для чистого растворителя;
- коэффициент Генри для чистого растворителя; 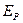 - коэффициент Генри для раствора;
- коэффициент Генри для раствора; 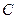 - концентрация добавляемого компонента;
- концентрация добавляемого компонента; 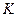 - постоянная, зависящая от природы растворяемых веществ и растворителя.
- постоянная, зависящая от природы растворяемых веществ и растворителя.
Из изложенного следует, что к факторам, улучшающим условия абсорбции, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, пониженное давление, повышенная температура и прибавление к абсорбенту добавок, уменьшающих растворимость газов в жидкостях.
Жидкий абсорбент, как правило, обладает значительной летучестью, и пары его насыщают газовую фазу. Это обстоятельство учитывают при расчётах процессов абсорбции следующим образом.
Пусть 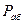 - давление паров чистого абсорбента в условиях абсорбции;
- давление паров чистого абсорбента в условиях абсорбции; 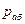 - давление абсорбента в растворе;
- давление абсорбента в растворе; 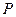 - общее давление;
- общее давление; 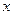 - мольная доля абсорбируемого газа в растворе;
- мольная доля абсорбируемого газа в растворе; 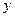 - мольная доля распределяемого газа в газовой фазе;
- мольная доля распределяемого газа в газовой фазе;  - мольная доля абсорбента в газовой фазе;
- мольная доля абсорбента в газовой фазе; 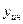 - мольная доля инертных газов в газовой фазе.
- мольная доля инертных газов в газовой фазе.
Согласно закону Рауля, парциальное давление компонента в растворе равно давлению пара чистого компонента, умноженному на его мольную долю в растворе; таким образом:
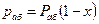
По закону Дальтона парциальное давление абсорбента в газовой фазе равно:
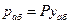
При равновесии
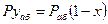
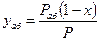 (12.9)
(12.9)
В этом случае для выражения равновесных и рабочих концентраций целесообразно пользоваться относительной мольной долей. Имея в виду:
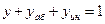
найдём концентрацию поглощаемого газа в газовой фазе:
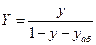 (12.10)
(12.10)
Выбранный способ выражения концентраций предполагает, что во всех последующих рассуждениях в качестве общего давления принимается:
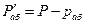
- Материальный баланс и кинетические закономерности абсорбции.
Материальный баланс процесса абсорбции выражается общим уравнением
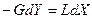 ,
,
где  - поток газовой смеси в кмоль/ч инертного газа;
- поток газовой смеси в кмоль/ч инертного газа; 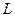 - поток абсорбента в кмоль/ч абсорбента.
- поток абсорбента в кмоль/ч абсорбента.



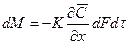 .
.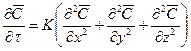 (11.70)
(11.70)
 ,
, и
и  должны войти в критериальное уравнение, которое описывает перемещение вещества в твёрдой фазе и является теоретической базой для обработки всех опытных исследований этого процесса. Дифференциальное уравнение массопроводности для простейших случаев одномерного перемещения вещества имеет аналитическое решение в виде:
должны войти в критериальное уравнение, которое описывает перемещение вещества в твёрдой фазе и является теоретической базой для обработки всех опытных исследований этого процесса. Дифференциальное уравнение массопроводности для простейших случаев одномерного перемещения вещества имеет аналитическое решение в виде: (11.74),
(11.74), - параметрический критерий, представляющий собой безразмерную концентрацию распределяемого вещества в твёрдой фазе в точке с координатой х;
- параметрический критерий, представляющий собой безразмерную концентрацию распределяемого вещества в твёрдой фазе в точке с координатой х;  - концентрация в точке с координатой
- концентрация в точке с координатой 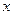 в момент времени
в момент времени  , соответствующий определённому
, соответствующий определённому  ;
;  - коэффициент, определяющий размер тела, составляющего твёрдую фазу;
- коэффициент, определяющий размер тела, составляющего твёрдую фазу; 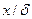 - безразмерная координата точки, в которой концентрация равна
- безразмерная координата точки, в которой концентрация равна 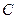 .
.
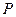 ), температуры (
), температуры (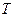 ) и концентрации распределяемого компонента (
) и концентрации распределяемого компонента (
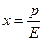 (12.1)
(12.1)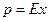 (12.2),
(12.2),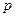 - парциальное давление газа над раствором в мм.рт.ст;
- парциальное давление газа над раствором в мм.рт.ст; 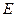 - коэффициент пропорциональности (коэффициент Генри) в мм.рт.ст.
- коэффициент пропорциональности (коэффициент Генри) в мм.рт.ст.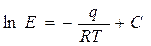 (12.3),
(12.3),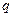 - теплота растворения газа в ккал/кмоль;
- теплота растворения газа в ккал/кмоль; 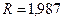 ккал/кмоль·град – универсальная газовая постоянная;
ккал/кмоль·град – универсальная газовая постоянная; 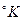 ;
; 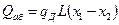 (12.4),
(12.4),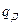 - дифференциальная теплота растворения в пределах измерения концентрации
- дифференциальная теплота растворения в пределах измерения концентрации 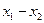 в ккал/кг;
в ккал/кг; 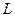 - количество абсорбента в кг.
- количество абсорбента в кг.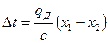 (12.5),
(12.5),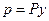 и
и 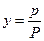 ,
,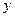 - концентрация распределяемого газа в смеси в мольных долях.
- концентрация распределяемого газа в смеси в мольных долях.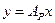 (12.6),
(12.6),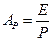 - константа фазового равновесия.
- константа фазового равновесия.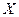 и
и 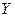 , выраженные в относительных мольных долях, то, имея в виду соотношения:
, выраженные в относительных мольных долях, то, имея в виду соотношения: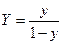 ,
, 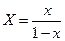 ,
, 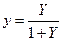 ,
, 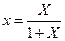 ,
,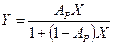 (12.7)
(12.7)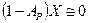 и уравнение (12.7) приобретает более простой вид:
и уравнение (12.7) приобретает более простой вид: (12.8)
(12.8)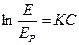 ,
,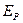 - коэффициент Генри для раствора;
- коэффициент Генри для раствора; 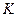 - постоянная, зависящая от природы растворяемых веществ и растворителя.
- постоянная, зависящая от природы растворяемых веществ и растворителя.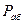 - давление паров чистого абсорбента в условиях абсорбции;
- давление паров чистого абсорбента в условиях абсорбции; 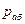 - давление абсорбента в растворе;
- давление абсорбента в растворе;  - мольная доля абсорбента в газовой фазе;
- мольная доля абсорбента в газовой фазе; 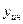 - мольная доля инертных газов в газовой фазе.
- мольная доля инертных газов в газовой фазе.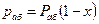
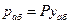
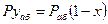
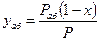 (12.9)
(12.9)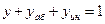
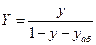 (12.10)
(12.10)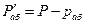
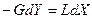 ,
, - поток газовой смеси в кмоль/ч инертного газа;
- поток газовой смеси в кмоль/ч инертного газа; 

