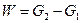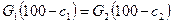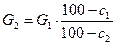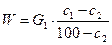РАЗДЕЛ 1

Основное уравнение массопередачи
Основной закон массопередачи можно сформулировать, исходя из общих физических кинетических закономерностей химико-технологических процессов: скорость процесса равна движущей силе, делённой на сопротивление, то есть
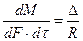 ,
,
где 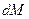 - количество вещества, перешедшего из одной фазы в другую;
- количество вещества, перешедшего из одной фазы в другую; 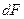 - поверхность фазового контакта;
- поверхность фазового контакта; 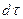 - время;
- время; 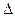 - движущая сила массообменного процесса;
- движущая сила массообменного процесса; 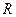 - сопротивление.
- сопротивление.
Если вместо 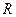 взять обратную величину
взять обратную величину 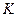 - коэффициент скорости или, как его называют в рассмотренном явлении, коэффициент массопередачи, предыдущее уравнение имеет вид:
- коэффициент скорости или, как его называют в рассмотренном явлении, коэффициент массопередачи, предыдущее уравнение имеет вид:
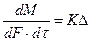 (11.5)
(11.5)
При условии, когда 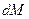 отнесено к единице времени, уравнение (11.5) можно переписать так:
отнесено к единице времени, уравнение (11.5) можно переписать так:
 (11.6)
(11.6)
Уравнения (11.5) и (11.6) называются основными уравнениями массопередачи.
В аппаратуре, используемой для проведения массообменных процессов, равновесные концентрации распределяемого вещества никогда не достигаются. Действительные концентрации распределяемого вещества, или рабочие концентрации, всегда отличаются от равновесных. Разность между этими концентрациями, характеризующая степень отклонения от равновесия, и представляет собой движущую силу массообменных процессов.
Материальный баланс массообменных процессов
В общем виде материальный баланс массообменных (диффузионных) процессов может быть составлен на основе следующих рассуждений. Обозначим весовые скорости распределяющих фаз вдоль поверхности их раздела, выраженные в килограммах инертного вещества в час, через  и
и 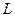 , а концентрация распределяемого вещества соответственно
, а концентрация распределяемого вещества соответственно 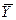 кг/кг инертного вещества и
кг/кг инертного вещества и 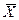 кг/кг инертного вещества.
кг/кг инертного вещества.
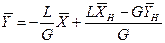 (11.10)
(11.10)
Для противоточного взаимодействия фаз может быть получено уравнение:
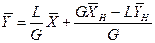 (11.12)
(11.12)
Из этих уравнений следует, что концентрации распределяемого вещества в фазах  и
и 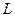 связаны линейной зависимостью. Поэтому удобно процессы массообмена представлять графически в координатах
связаны линейной зависимостью. Поэтому удобно процессы массообмена представлять графически в координатах 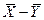 , то есть в виде зависимости между так называемыми рабочими концентрациями. Уравнение прямой, выражающей зависимость между рабочими концентрациями, называют обычно рабочей линией процесса.
, то есть в виде зависимости между так называемыми рабочими концентрациями. Уравнение прямой, выражающей зависимость между рабочими концентрациями, называют обычно рабочей линией процесса.
РАЗДЕЛ 2
АБСОРБЦИЯ
Абсорбция – поглощение газов или паров из газовых или паровых смесей жидкими поглотителями, называемыми абсорбентами. Этот процесс является избирательным и обратимым, что даёт возможность применять его не только с целью получения растворов газов в жидкостях, но также и для разделения газовых или паровых смесей.
В последнем случае после избирательной абсорбции одного или нескольких компонентов из газовой или паровой смеси проводят десорбцию – выделение этих компонентов из жидкости – и таким образом осуществляют разделение. Регенерированный абсорбент вновь возвращается на абсорбцию (круговой процесс).
Различают физическую абсорбцию и хемосорбцию. При физической абсорбции растворение газа не сопровождается химической реакцией. При хемосорбции абсорбируемый компонент вступает в химическую реакцию в жидкой фазе.
Примерами использования процессов абсорбции в технике могут служить разделение углеводородных газов на нефтеперерабатывающих установках, получение соляной кислоты, получение аммиачной воды, очистка отходящих газов с целью улавливания ценных продуктов или обезвреживание газосбросов и другие.
Аппаратурно-технологическое оформление процессов сравнительно просто, поэтому процессы абсорбции широко используются в технике.
- Равновесие в процессах абсорбции.
Условием равновесия между газовой и жидкой фазами является равенство температур и давлений обеих фаз и равенство химических потенциалов для всех компонентов обеих фаз.
При постоянстве температуры и давления в фазах химический потенциал распределяемого компонента пропорционален концентрациям его в фазах. Поэтому в состоянии равновесия между концентрациями распределяемого компонента в обеих фазах устанавливается некоторое соотношение, характеризуемое константой фазового равновесия, которая равна отношению распределяемого компонента в газовой фазе к его концентрации в жидкой фазе.
В общем случае константа фазового равновесия зависит от давления (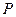 ), температуры (
), температуры (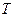 ) и концентрации распределяемого компонента (
) и концентрации распределяемого компонента (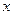 ) в жидкости:
) в жидкости:

В качестве основного закона, характеризующего равновесие в системе газ-жидкость, обычно используется закон растворимости газов в жидкостях, сформулированный Генри. Согласно этому закону при данной температуре мольная доля газа в растворе (растворимость) пропорциональна парциальному давлению газа над раствором:
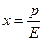 (12.1)
(12.1)
или
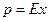 (12.2),
(12.2),
где 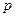 - парциальное давление газа над раствором в мм.рт.ст;
- парциальное давление газа над раствором в мм.рт.ст; 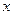 - концентрация газа в растворе в долях моля;
- концентрация газа в растворе в долях моля; 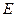 - коэффициент пропорциональности (коэффициент Генри) в мм.рт.ст.
- коэффициент пропорциональности (коэффициент Генри) в мм.рт.ст.
Коэффициент 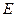 зависит от природы растворяющегося вещества и температуры:
зависит от природы растворяющегося вещества и температуры:
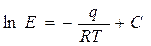 (12.3),
(12.3),
где 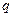 - теплота растворения газа в ккал/кмоль;
- теплота растворения газа в ккал/кмоль; 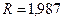 ккал/кмоль·град – универсальная газовая постоянная;
ккал/кмоль·град – универсальная газовая постоянная; 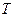 - абсолютная температура растворения в
- абсолютная температура растворения в 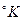 ;
; 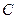 - постоянная, зависящая от природы газа и жидкости и определяемая опытным путём.
- постоянная, зависящая от природы газа и жидкости и определяемая опытным путём.
С ростом температуры растворимость газов в жидкостях уменьшается. При растворении газа в жидкости, температура жидкости обычно повышается вследствие выделения значительного количества тепла.
Количество тепла, выделяющегося при абсорбции, может быть найдено как:
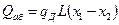 (12.4),
(12.4),
где 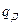 - дифференциальная теплота растворения в пределах измерения концентрации
- дифференциальная теплота растворения в пределах измерения концентрации 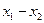 в ккал/кг;
в ккал/кг; 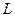 - количество абсорбента в кг.
- количество абсорбента в кг.
Если абсорбция ведётся без отвода тепла, то можно допустить, что всё выделяющееся тепло идёт на нагревание жидкости и температура последней повышается на величину:
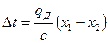 (12.5),
(12.5),
где с – теплоёмкость раствора в ккал/(кг·град).
Парциальное давление растворяемого газа в газовой фазе, соответствующее равновесию, может быть заменено равновесной концентрацией. Согласно закону Дальтона, парциальное давление компонента в газовой смеси равно общему давлению, умноженному на мольную долю этого компонента в смеси, то есть:
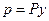 и
и 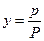 ,
,
где 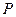 - общее давление газовой смеси;
- общее давление газовой смеси; 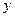 - концентрация распределяемого газа в смеси в мольных долях.
- концентрация распределяемого газа в смеси в мольных долях.
Сопоставляя последнее равенство с уравнением (12.22), найдём
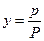 или
или 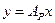 (12.6),
(12.6),
где 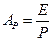 - константа фазового равновесия.
- константа фазового равновесия.
Уравнение (12.6) выражает зависимость между равновесными концентрациями распределяемого газа в газовой и жидкой фазах. Если заменить в этом уравнении концентрации 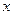 и
и 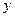 , выраженные в мольных долях, на
, выраженные в мольных долях, на 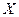 и
и 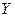 , выраженные в относительных мольных долях, то, имея в виду соотношения:
, выраженные в относительных мольных долях, то, имея в виду соотношения:
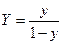 ,
, 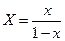 ,
, 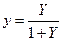 ,
, 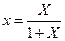 ,
,
уравнение (12.6) можно переписать так:
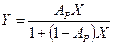 (12.7)
(12.7)
При незначительных концентрациях Х величина 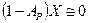 и уравнение (12.7) приобретает более простой вид:
и уравнение (12.7) приобретает более простой вид:
 (12.8)
(12.8)
На равновесные концентрации в процессах абсорбции оказывают существенное влияние вещества, добавочно растворённые в абсорбенте. Их присутствие уменьшает равновесную концентрацию газа в жидкости согласно закономерности, установленной Сеченовым в 1892 г.:
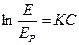 ,
,
где 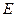 - коэффициент Генри для чистого растворителя;
- коэффициент Генри для чистого растворителя; 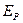 - коэффициент Генри для раствора;
- коэффициент Генри для раствора; 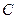 - концентрация добавляемого компонента;
- концентрация добавляемого компонента; 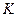 - постоянная, зависящая от природы растворяемых веществ и растворителя.
- постоянная, зависящая от природы растворяемых веществ и растворителя.
Из изложенного следует, что к факторам, улучшающим условия абсорбции, относятся повышенное давление и пониженная температура, а к факторам, способствующим десорбции, пониженное давление, повышенная температура и прибавление к абсорбенту добавок, уменьшающих растворимость газов в жидкостях.
Жидкий абсорбент, как правило, обладает значительной летучестью, и пары его насыщают газовую фазу. Это обстоятельство учитывают при расчётах процессов абсорбции следующим образом.
Пусть 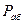 - давление паров чистого абсорбента в условиях абсорбции;
- давление паров чистого абсорбента в условиях абсорбции; 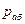 - давление абсорбента в растворе;
- давление абсорбента в растворе; 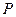 - общее давление;
- общее давление; 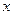 - мольная доля абсорбируемого газа в растворе;
- мольная доля абсорбируемого газа в растворе; 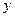 - мольная доля распределяемого газа в газовой фазе;
- мольная доля распределяемого газа в газовой фазе;  - мольная доля абсорбента в газовой фазе;
- мольная доля абсорбента в газовой фазе; 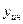 - мольная доля инертных газов в газовой фазе.
- мольная доля инертных газов в газовой фазе.
Согласно закону Рауля, парциальное давление компонента в растворе равно давлению пара чистого компонента, умноженному на его мольную долю в растворе; таким образом:
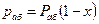
По закону Дальтона парциальное давление абсорбента в газовой фазе равно:
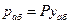
При равновесии
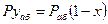
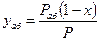 (12.9)
(12.9)
В этом случае для выражения равновесных и рабочих концентраций целесообразно пользоваться относительной мольной долей. Имея в виду:
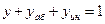
найдём концентрацию поглощаемого газа в газовой фазе:
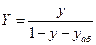 (12.10)
(12.10)
Выбранный способ выражения концентраций предполагает, что во всех последующих рассуждениях в качестве общего давления принимается:
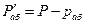
- Материальный баланс и кинетические закономерности абсорбции.
Материальный баланс процесса абсорбции выражается общим уравнением
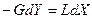 ,
,
где  - поток газовой смеси в кмоль/ч инертного газа;
- поток газовой смеси в кмоль/ч инертного газа; 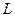 - поток абсорбента в кмоль/ч абсорбента.
- поток абсорбента в кмоль/ч абсорбента.
РЕКТИФИКАЦИЯ
Ректификация – разделение жидких однородных смесей на составляющие вещества или группы составляющих веществ в результате противоточного взаимодействия паровой смеси и жидкой смеси.
Этот процесс имеет большое значение в химической технике. В качестве примеров достаточно указать на разделение природных углеводородов нефти и синтетических углеводородов с целью получения моторного топлива, на выделение индивидуальных газов из их смесей путём предварительного ожижения и последующей ректификации жидкой смеси.
Возможность разделения жидкой смеси на составляющие её компоненты ректификацией обусловлена тем, что состав пара, образующегося над жидкой смесью, отличается от состава жидкой смеси в условиях равновесного состояния пара и жидкости. Известные равновесные данные для конкретной смеси позволяют проанализировать возможность разделения этой смеси, найти предельные концентрации разделения и рассчитать движущую силу процесса.
Принцип ректификации.
Сущность процесса ректификации можно охарактеризовать как разделение жидкой смеси на дистиллят и остаток в результате двухступенчатого взаимодействия жидкости с парами.
Материальный баланс разделения:
Для всей смеси:
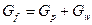
Для легколетучего компонента в смеси:
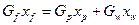
Флегмовое число – отношение количества возвращённого в колонну дистиллята (флегмы) к количеству отобранного дистиллята в виде продукта.
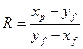 ,
,
где 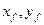 - исходная смесь,
- исходная смесь, 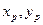 - итоговая смесь.
- итоговая смесь.
Разделение смеси при ректификации возможно в результате взаимодействия потоков паров и жидкостей в ректификационном аппарате при кратности испарения 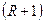 и кратности конденсации
и кратности конденсации 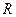 .
.
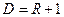
или
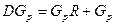
Материальный баланс ректификации по летучему компоненту:
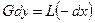
С уменьшением флегмового числа и, следовательно, затрат тепла на провеение процесса уменьшается движущая сила, и наоборот.
РАЗДЕЛ 3
ЭКСТРАКЦИЯ
Экстракция – извлечение одного или нескольких растворённых веществ из одной жидкой фазы другой, практически не смешивающейся с первой.
Процесс широко используется для извлечения ценных продуктов из разбавленных растворов, а также для получения концентрированных растворов. Но главное, экстракцию следует рассматривать, наряду с ректификацией, как один из основных способов разделения жидких однородных смесей.
1. Равновесие в процессах экстракции.
Равновесие для некоторых систем «жидкость – распределяемое вещество – жидкость» следует так называемому закону распределения. Согласно этому закону отношение равновесных концентраций распределённого между двумя жидкими фазами вещества при постоянной температуре есть величина постоянная, она называется коэффициентом распределения.
Пусть распределяющими фазами являются  и
и 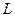 , а равновесными концентрациями будут
, а равновесными концентрациями будут 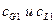 ,
,  , …
, … 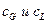 , тогда по закону распределения:
, тогда по закону распределения:
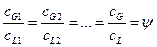 (14.1)
(14.1)
или
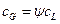 (14.2),
(14.2),
где  - коэффициент распределения.
- коэффициент распределения.
В уравнении (14.2) концентрации выражены в кг/м3. Если обозначить концентрации распределяемого в фазах вещества через 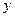 и
и 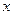 (в кг/кг инертного вещества (растворителя)) и обозначить плотности фаз
(в кг/кг инертного вещества (растворителя)) и обозначить плотности фаз  и
и 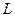 через
через 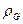 и
и  , уравнение (14.2) примет вид:
, уравнение (14.2) примет вид:
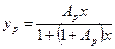 (14.3),
(14.3),
где
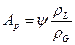 (14.4)
(14.4)
Произведением 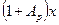 при малых концентрациях
при малых концентрациях 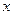 можно пренебречь, поэтому допустимо принимать:
можно пренебречь, поэтому допустимо принимать:
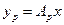
2. Материальный баланс экстракции.
Уравнение материального баланса по общим потокам:
 (14.10),
(14.10),
где 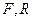 - соответственно весовые количества исходного раствора и полученного рафината в кг/ч;
- соответственно весовые количества исходного раствора и полученного рафината в кг/ч; 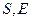 - соответственно весовые количества экстрагента и полученного экстракта в кг/ч.
- соответственно весовые количества экстрагента и полученного экстракта в кг/ч.
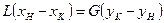
РАЗДЕЛ 4
АДСОРБЦИЯ
Адсорбция – поглощение газов или паров из газовых смесей или растворённых веществ из растворов твёрдыми поглотителями, называемыми адсорбентами.
Особенностью процессов адсорбции являются избирательность и обратимость. Благодаря этой особенности процесса возможно поглощение из паро-газовых смесей или растворов одного или нескольких компонентов, а затем в других условиях, десорбирование их, то есть выделение нужного компонента из твёрдой фазы в более или менее чистом виде.
Адсорбция широко распространена в различных отраслях химической технологии как метод разделения смесей. В качестве конкретных примеров можно указать выделение бензола из паро-газовых смесей, разделение смесей газообразных углеводородов, сушку воздуха, очистку жидких нефтепродуктов от распространённых в них примесей и т.д.
РАЗДЕЛ 5
СУШКА
Наиболее распространённым способом удаления влаги из твёрдых влажных материалов является сушка. Сушкой называется процесс удаления влаги из твёрдых влажных материалов путём её испарения и отвода образующихся паров.
Сушка в технике осуществляется двумя основными способами:
а) нагреванием влажных материалов теплоносителем через твёрдую непроницаемую перегородку – так называемый процесс контактной сушки;
б) нагреванием влажных материалов путём непосредственного контакта с газовым теплоносителем (воздух, поточные газы и др.) – так называемая газовая, или воздушная сушка.
Иногда тепло отводится к высушиваемому материалу токами высокой частоты или инфракрасными лучами; указанные способы сушки называют соответственно диэлектрической и радиационной сушкой.
- Равновесные соотношения в процессах сушки.
Давление водяного пара в высушиваемом материале 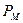 зависит от влажности материала, температуры и характера связи влаги с материалом.
зависит от влажности материала, температуры и характера связи влаги с материалом.
Различают несколько форм связи влаги с материалом (в порядке убывающей энергии связи):
= Химически связанная влага. Под химически связанной влагой понимают воду гидроокиси, которая в результате реакции гидратации вошла в состав гидроокисей и соединений типа кристаллогидратов. Связь нарушается только в результате химического взаимодействия (иногда в результате прокаливания), и влага не удаляется при сушке.
= Адсорбционно-связанная влага. Влажность обусловлена адсорбцией воды на наружной поверхности материала и на поверхности его пор. Осмотически связанная влага находится внутри структурного скелета материала и удерживается осмотическими силами. В этих случаях связь воды с материалом имеет физико-химическую природу.
= Капиллярно связанная влага заполняет макро- и микрокапилляры. Она механически связана с материалом и наиболее легко удаляется. Давление пара над поверхностью материала тем меньше, чем прочнее связь между водой и материалом. Наиболее прочна эта связь у гигроскопичных веществ. Давление пара над ними наиболее отличается от давления насыщенных паров.
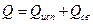 ,
,
где 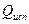 - тепло, расходуемое на испарение свободной воды;
- тепло, расходуемое на испарение свободной воды; 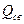 - энергия, расходуемая на преодоление связи влаги с материалом.
- энергия, расходуемая на преодоление связи влаги с материалом.
- Материальный и тепловой Баланы сушки.
Обозначим количество влажного материала, поступающего на сушку, 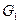 в кг/ч, количество высушенного материала
в кг/ч, количество высушенного материала 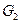 в кг/ч, начальную и конечную влажность материала (вес. %) соответственно через
в кг/ч, начальную и конечную влажность материала (вес. %) соответственно через  и
и 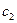 , а количество влаги, удаляемой при сушке, через
, а количество влаги, удаляемой при сушке, через 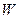 кг/ч.
кг/ч.
Тогда материальный баланс процесса можно представить равенством:
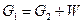 или
или 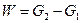
Для количеств сухого вещества:
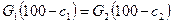
или
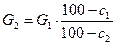
Сопоставление равенств и даёт:
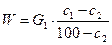
РАЗДЕЛ 6
РАЗДЕЛ 1

Общие сведения о массообменных процессах.
Технологические процессы, скорость протекания которых определяется скоростью переноса вещества (массы) из одной фазы в другую, называются массообменными процессами, а аппаратура, предназначенная для проведения этих процессов, - массообменной аппаратурой.
Между реакционными и разделительными аппаратами существует тесная технологическая связь. Общий закон этой связи таков: чем меньше нагрузка на реакционный аппарат, то есть чем меньше превращение исходного сырья в продукты реакции, тем больше нагрузка на разделительный агрегат, и наоборот.
Оптимальное сочетание нагрузок на реакционный и разделительный аппараты и приводит к минимальным производственным затратам – к оптимизированному процессу. Основа химического производства – реакционный аппарат – работает оптимально только в сочетании с оптимально работающим разделительным агрегатом и работа последнего имеет в химической промышленности не меньшее значение, чем работа самого реакционного аппарата.
В разделительном агрегате могут производиться разнообразные процессы. Основными и важнейшими из них являются абсорбция, экстракция, ректификация, адсорбция и сушка.
Абсорбция – избирательное поглощение газов или паров жидкими поглотителями – абсорбентами. Процесс используется во многих производствах, где из смеси газов необходимо извлечь какой либо компонент или группу компонентов. В этом процессе имеет место переход вещества или группы веществ из газовой или паровой фазы в жидкую.
Экстракция (жидкостная) – извлечение растворённого в одной жидкости вещества или группы веществ другой жидкостью. Процесс используется в случаях, когда из раствора необходимо извлечь растворённое вещество или группу веществ. В этом процессе имеет место переход вещества из одной жидкой фазы в другую жидкую фазу.
Ректификация – разделение жидкой смеси на чистые или обогащённые составляющие в результате противоточного взаимодействия потоков пара и жидкости. Процесс имеет большое значение в тех производствах, где необходимо частичное или полное разделение жидких однородных смесей на чистые компоненты или их группы. Очевидно, в этом процессе имеет место переход вещества из жидкой фазы в паровую, и наоборот.
Адсорбция – избирательное поглощение газов, паров или растворённых в жидкостях веществ твёрдым поглотителем – адсорбентом, способным поглощать одно или несколько веществ из их смеси. Процесс используется во многих производствах, где из смеси газов, паров или растворённых веществ необходимо извлечение того или другого вещества. В этом процессе вещества переходят из газовой или жидкой фаз в твёрдую.
Сушка – удаление влаги из твёрдых влажных материалов путём её испарения. При этом процессе имеет место переход влаги из твёрдого влажного материала в паровую или газовую среду.
Для всех перечисленных процессов общим является переход вещества из одной фазы в другую, или массопередача. Переход вещества из одной фазы в другую связан с явлениями конвективного переноса и молекулярной диффузии, поэтому перечисленные выше процессы получили название массообменных, или диффузионных процессов.
Массопередача – переход вещества (или нескольких веществ) из одной фазы в другую в направлении достижения равновесия.
В массообмене участвуют как минимум три вещества: распределяющее вещество (или вещества), составляющее первую фазу; распределяющее вещество (или вещества), составляющее вторую фазу; распределяемое вещество, (или вещества), которое переходит из одной фазы в другую.
Через определённый промежуток времени скорости перехода распределяемого вещества из одной фазы в другую и обратно становятся одинаковыми. Такое состояние называется равновесным. В состоянии равновесия в каждом конкретном случае существует строго определённая зависимость между концентрациями распределяемого вещества, которые при равновесии системы называются равновесными.
Так как концентрация пропорциональна числу частиц, то, следовательно, скорость перехода распределяемого вещества из одной фазы в другую пропорциональна разности между фактической концентрацией распределяемо вещества в данной фазе и равновесной концентрацией.
Основными вопросами, изучаемыми в массопередаче, являются: законы фазового равновесия, позволяющие установить равновесные концентрации и направление течения процесса; движущая сила массообменных процессов; коэффициенты скорости массообменных процессов.
Два последних вопроса составляют так называемую кинетику массопередачи и рассматриваются самостоятельно; вопросы фазового равновесия, рассматриваются раздельно при изучении каждого конкретного процесса.




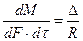 ,
,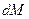 - количество вещества, перешедшего из одной фазы в другую;
- количество вещества, перешедшего из одной фазы в другую; 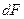 - поверхность фазового контакта;
- поверхность фазового контакта; 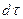 - время;
- время; 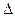 - движущая сила массообменного процесса;
- движущая сила массообменного процесса; 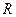 - сопротивление.
- сопротивление.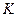 - коэффициент скорости или, как его называют в рассмотренном явлении, коэффициент массопередачи, предыдущее уравнение имеет вид:
- коэффициент скорости или, как его называют в рассмотренном явлении, коэффициент массопередачи, предыдущее уравнение имеет вид: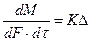 (11.5)
(11.5) (11.6)
(11.6) и
и 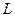 , а концентрация распределяемого вещества соответственно
, а концентрация распределяемого вещества соответственно 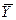 кг/кг инертного вещества и
кг/кг инертного вещества и 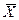 кг/кг инертного вещества.
кг/кг инертного вещества.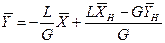 (11.10)
(11.10)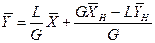 (11.12)
(11.12)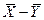 , то есть в виде зависимости между так называемыми рабочими концентрациями. Уравнение прямой, выражающей зависимость между рабочими концентрациями, называют обычно рабочей линией процесса.
, то есть в виде зависимости между так называемыми рабочими концентрациями. Уравнение прямой, выражающей зависимость между рабочими концентрациями, называют обычно рабочей линией процесса.
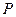 ), температуры (
), температуры (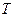 ) и концентрации распределяемого компонента (
) и концентрации распределяемого компонента (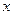 ) в жидкости:
) в жидкости:
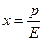 (12.1)
(12.1)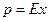 (12.2),
(12.2),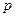 - парциальное давление газа над раствором в мм.рт.ст;
- парциальное давление газа над раствором в мм.рт.ст; 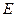 - коэффициент пропорциональности (коэффициент Генри) в мм.рт.ст.
- коэффициент пропорциональности (коэффициент Генри) в мм.рт.ст.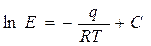 (12.3),
(12.3),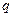 - теплота растворения газа в ккал/кмоль;
- теплота растворения газа в ккал/кмоль; 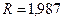 ккал/кмоль·град – универсальная газовая постоянная;
ккал/кмоль·град – универсальная газовая постоянная; 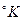 ;
; 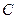 - постоянная, зависящая от природы газа и жидкости и определяемая опытным путём.
- постоянная, зависящая от природы газа и жидкости и определяемая опытным путём.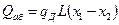 (12.4),
(12.4),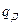 - дифференциальная теплота растворения в пределах измерения концентрации
- дифференциальная теплота растворения в пределах измерения концентрации 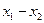 в ккал/кг;
в ккал/кг; 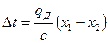 (12.5),
(12.5),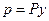 и
и 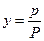 ,
,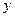 - концентрация распределяемого газа в смеси в мольных долях.
- концентрация распределяемого газа в смеси в мольных долях.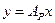 (12.6),
(12.6),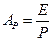 - константа фазового равновесия.
- константа фазового равновесия.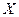 и
и 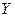 , выраженные в относительных мольных долях, то, имея в виду соотношения:
, выраженные в относительных мольных долях, то, имея в виду соотношения: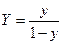 ,
, 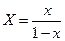 ,
, 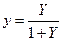 ,
, 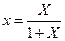 ,
,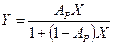 (12.7)
(12.7)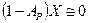 и уравнение (12.7) приобретает более простой вид:
и уравнение (12.7) приобретает более простой вид: (12.8)
(12.8)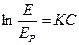 ,
,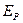 - коэффициент Генри для раствора;
- коэффициент Генри для раствора; 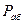 - давление паров чистого абсорбента в условиях абсорбции;
- давление паров чистого абсорбента в условиях абсорбции; 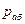 - давление абсорбента в растворе;
- давление абсорбента в растворе;  - мольная доля абсорбента в газовой фазе;
- мольная доля абсорбента в газовой фазе; 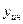 - мольная доля инертных газов в газовой фазе.
- мольная доля инертных газов в газовой фазе.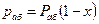
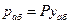
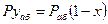
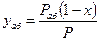 (12.9)
(12.9)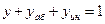
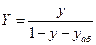 (12.10)
(12.10)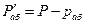
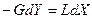 ,
,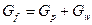
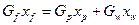
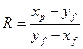 ,
,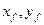 - исходная смесь,
- исходная смесь, 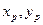 - итоговая смесь.
- итоговая смесь.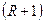 и кратности конденсации
и кратности конденсации 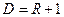
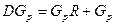
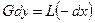
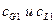 ,
,  , …
, … 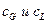 , тогда по закону распределения:
, тогда по закону распределения: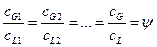 (14.1)
(14.1)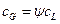 (14.2),
(14.2), - коэффициент распределения.
- коэффициент распределения.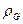 и
и  , уравнение (14.2) примет вид:
, уравнение (14.2) примет вид: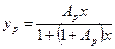 (14.3),
(14.3),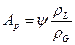 (14.4)
(14.4)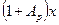 при малых концентрациях
при малых концентрациях 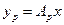
 (14.10),
(14.10),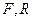 - соответственно весовые количества исходного раствора и полученного рафината в кг/ч;
- соответственно весовые количества исходного раствора и полученного рафината в кг/ч; 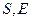 - соответственно весовые количества экстрагента и полученного экстракта в кг/ч.
- соответственно весовые количества экстрагента и полученного экстракта в кг/ч.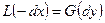
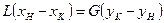
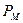 зависит от влажности материала, температуры и характера связи влаги с материалом.
зависит от влажности материала, температуры и характера связи влаги с материалом.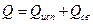 ,
,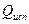 - тепло, расходуемое на испарение свободной воды;
- тепло, расходуемое на испарение свободной воды; 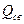 - энергия, расходуемая на преодоление связи влаги с материалом.
- энергия, расходуемая на преодоление связи влаги с материалом.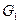 в кг/ч, количество высушенного материала
в кг/ч, количество высушенного материала 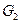 в кг/ч, начальную и конечную влажность материала (вес. %) соответственно через
в кг/ч, начальную и конечную влажность материала (вес. %) соответственно через  и
и 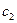 , а количество влаги, удаляемой при сушке, через
, а количество влаги, удаляемой при сушке, через 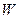 кг/ч.
кг/ч.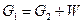 или
или