

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Дисциплины:
|
из
5.00
|
Заказать работу |
Оглавление
1. Теоретическая часть
1.1 Эпитаксия
1.2 Прогнозирование возможности и характера процесса эпитаксии
1.3 Параметры хлоридного процесса эпитаксии
1.4 Расчет технологических параметров процесса диффузии
1.4.1 Диффузия в полубесконечное тело из бесконечного источника
1.4.2 Диффузия в полубесконечное тело из ограниченного источника
2. Практическая часть
2.1. Выбор легирующей примеси
2.2. Уход металлургической границы скрытого слоя
3. Список литературы
Эпитаксия – процесс наращивания монокристаллических слоев на монокристаллических подложках. Монокристаллические подложки в процессе эпитаксиального наращивания выполняют ориентирующую роль заставки, на которой происходит кристаллизация. Основная особенность – слои и локальные области противоположного типа проводимости или с отличной от полупроводниковой пластины концентрацией примеси представляют собой новые образования над исходной поверхностью. В процессе роста эпитаксиальные слои легируют, т.е. в них вводят донорные или акцепторные примеси. Особенностью также является то, что появляется возможность получения высокоомных слоев полупроводника на низкоомных пластинах.
Диффузия в полубесконечное тело из бесконечного источника
Полубесконечным телом любую монокристаллическую пластину можно считать при условии, что диффузия проводится на глубину, много меньшую толщины подожки. Бесконечным (или постоянным) источником называют такое состояние системы, когда количество примеси, уходящей с поверхности в объем полупроводника, равно количеству, поступающему на поверхность. Это означает, что количество примеси вокруг пластины, например в газовой фазе, значительно больше, чем в ее объеме.
В этом случае граничные условия записываются как С(x, t) = 0 при t = 0;
C (x, 0) = C0 при t > 0 ,x = 0.
Решение уравнения (4.3) при данных граничных условиях описывается дополнительной функцией ошибок
 . (4.4)
. (4.4)
Количество примеси, введенное в подложку за время диффузии из бесконечного источника Qt, определяется как
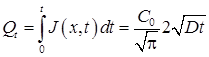 . (4.5)
. (4.5)
Коэффициент диффузии D – величина, экспоненциально зависящая от температуры:
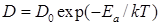 , (4.6)
, (4.6)
где Еa – энергия активации диффузии, эВ; k –постоянная Больцмана, 8,6×10-5 эВ / К; Т –температура, К.
Если в объеме подложки присутствует другая примесь с концентрацией CB, то суммарное количество примеси СS будет равно
 , (4.7)
, (4.7)
при этом знак минус соответствует случаю, когда примесь в подложке и вводимая примесь имеют разный знак, т.е. формируется гетеропереход. Глубина залегания p-n перехода определяется условием

или (см. рис. 4.1)
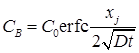 . (4.8)
. (4.8)

Рис. 4.1 Характер распределения донорных примесей в подложке с концентрацией акцепторов СВ.
Практическая часть
1. Задание. Выбрать легирующую примесь и состав ПГС для процесса эпитаксии. Рассчитать «расползание» скрытого слоя во время процесса эпитаксии.
1. Выбор метода эпитаксии.
· Наиболее удобным для реализации процесса является хлоридный метод эпитаксии;
2. Выбор легирующей примеси.
· Основная цель — изменить тип проводимости и концентрацию носителей в объёме полупроводника для получения заданных свойств (проводимости, получения требуемой плавности p-n-перехода). Самыми распространёнными легирующими примесями для кремния являются фосфор и мышьяк (позволяют получить n-тип проводимости).
· В качестве легирующей примеси выбираем мышьяк.
Рис.1 графическое представление желаемого результата
3. Выбор пгс
В качестве исходных реагентов первой реакции используются тетрахлорид кремния (SiCl4), трихлорсилан (SiHCl3), дихлорсилан (SiH2Cl2) и т. п., но наиболее часто—тетрахлорид кремния SiCl4.
4. 
Рис. 1. Температурная зависимость равновесного парциального давления соединений, образующихся в газовой фазе при давлении в 1 атм и отношении Сl/Н=0,01
Согласно положениям о химическом равновесии, при избытке водорода первая реакция идет с образованием кремния, а при подаче в систему соляной кислоты НСl можно осуществить газовое травление кремниевой подложки. Поясним это более подробно. Как уже говорилось, первая реакция является обобщающей. В действительности в системе протекают, как минимум, следующие реакции:
SiCl4+H2↔SiHCl3+HCl,
SiHCl3+H2↔SiH2Cl2+HCl,
SiH2Cl2 ↔SiCl2 +H2
SiHCl3↔SiCl2+HCl,
SiCl2+H2↔Si+2HCl,
На рис. 1 показана зависимость состава смеси от температуры для обычно используемого в технологии отношения концентрации хлора к концентрации водорода, равном 0,01. Сразу же сделаем ряд выводов из вышесказанного.
Подходящая ПГС – SiH4 или SiH2Cl2
4. Рассчитать «расползание» скрытого слоя во время процесса эпитаксии.
Известные параметры:
Толщина слоя – s – 3 мкм
Скорость роста эпитаксиальноего слоя – v - примерно 0.1 мкм/мин
Температура процесса = 1200 с
Константы, полученные исходя из заданных параметров
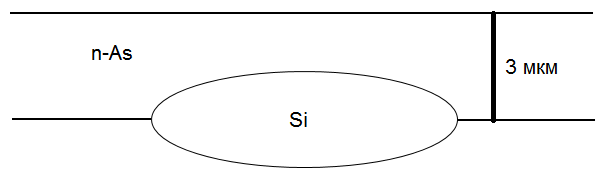
Рис. Схематичное изображения результата проведенного процесса. X - «расползание» скрытого слоя во время процесса эпитаксии
Расчет времени процесса:
T = время = s/v = 3/0.1 = 30 минут
Расчет диффузии
Для As в Si: коэффициент диффузии 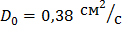 , энергия активации
, энергия активации 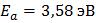
При Т = 1200 С°:
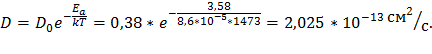
Расчет расползания слоя.
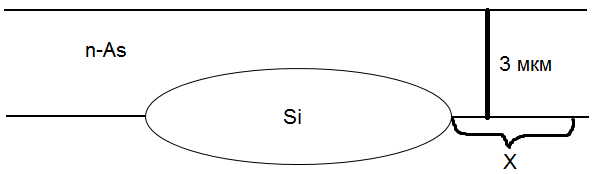
Рис. Схематичное изображения результата проведенного процесса. X - «расползание» скрытого слоя во время процесса эпитаксии
 - формула для расчета расползания слоя
- формула для расчета расползания слоя
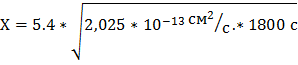 = 103.1 нм
= 103.1 нм
Ответ: 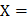 103.1 нм
103.1 нм
Оглавление
1. Теоретическая часть
1.1 Эпитаксия
1.2 Прогнозирование возможности и характера процесса эпитаксии
1.3 Параметры хлоридного процесса эпитаксии
1.4 Расчет технологических параметров процесса диффузии
1.4.1 Диффузия в полубесконечное тело из бесконечного источника
1.4.2 Диффузия в полубесконечное тело из ограниченного источника
2. Практическая часть
2.1. Выбор легирующей примеси
2.2. Уход металлургической границы скрытого слоя
3. Список литературы
Эпитаксия – процесс наращивания монокристаллических слоев на монокристаллических подложках. Монокристаллические подложки в процессе эпитаксиального наращивания выполняют ориентирующую роль заставки, на которой происходит кристаллизация. Основная особенность – слои и локальные области противоположного типа проводимости или с отличной от полупроводниковой пластины концентрацией примеси представляют собой новые образования над исходной поверхностью. В процессе роста эпитаксиальные слои легируют, т.е. в них вводят донорные или акцепторные примеси. Особенностью также является то, что появляется возможность получения высокоомных слоев полупроводника на низкоомных пластинах.
Прогнозирование возможности и характера процесса эпитаксии
Основные физико-химические факторы, которые оказывают влияние на характер взаимодействия веществ в процессе эпитаксии и тип диаграммы фазовых равновесий, весьма разнообразны, и возможность их полного учета затруднена.
Наиболее общей характеристикой, от которой зависит тип диаграммы состояния является величина теплоты (энергии) смешения взаимодействующих компонентов Есм. Соотношение между Есм обеих фаз и величиной kT (k ‑ постоянная Больцмана) является критерием типа диаграмм фазовых равновесий.
Прежде всего, положительное значение Есм характеризует стремление компонентов системы к обособлению, а при Есм ≥ 2kT наблюдается расслаивание (начиная с температуры Tр ≥ Есм/2k). Отрицательное значение Есм указывает на тенденцию к объединению (рис. 1.1).

Рис. 1.1 Типы диаграмм фазовых равновесий и вероятность протекания процессов эпитаксии
Критерии, используемые для теоретического построения диаграмм фазового равновесия, могут быть использованы для определения вероятности эпитаксии двух веществ. Так, например, критерии, указывающие на вероятность образования химических соединений в системе между двумя веществами, могут быть использованы как критерии невозможности процессов гетероэпитаксии. При полной несмешиваемости компонентов в твердом и жидком состоянии образования сплошного ПЭС, способного компенсировать несоответствие срастающихся решеток, не происходит, и вероятность срастания может быть определена только по структурно-геометрическому соответствию.
Если критерии, используемые для прогноза типа диаграмм состояния, указывают на возможность простого эвтектического взаимодействия и наличия некоторой растворимости в твердом состоянии, то можно с уверенностью предсказать возможность гетероэпитаксии при конденсации из газовой фазы или из молекулярного пучка в вакууме.
Процессы автоэпитаксии возможны практически для любых систем, однако распределение примеси в переходном эпитаксиальном слое будет различным в зависимости от эффективного коэффициента распределения.
Прогнозирование вероятности и характера процесса эпитаксии (протекающего, как правило, в неравновесных условиях) по диаграммам состояния взаимодействующих веществ осуществляют с учетом представлений о механизме фазовых превращений при изотермической диффузии компонентов и существовании переходного эпитаксиального слоя на границе раздела подложка – эпитаксиальный слой. Протяженность ПЭС определяется внешними факторами процесса эпитаксии и зависит от диаграммы состояния данной системы (рис. 1.2, а). Для того чтобы этот слой имел достаточно высокую степень совершенства кристаллической структуры, необходима взаимная растворимость срастающихся веществ и определенная температура процесса. ПЭС во многом похож на когерентные границы зерен. В нем возможно возникновение значительных механических напряжений. Если растворимость в твердом состоянии мала и не способна обеспечить когерентность перехода одной кристаллической решетки в другую, то для компенсации несоответствия в переходной области срастания возникает двух- или трехмерная сетка дислокаций.

Рис. 1.2 Формирование ПЭС при гетероэпитаксии
Если растворимость двух срастающихся веществ друг в друге очень мала или совсем отсутствует, то роль переходного слоя могут выполнять отдельные несовершенства реального монокристалла подложки. Известно, что по границам субзерен и дислокациям имеет место повышенная растворимость, которая и обеспечивает реальный контакт и перенос информации о структуре подложки в растущий авто- или гетероэпитаксиальный слой. В случае полного отсутствия растворимости срастающихся веществ друг в друге решающее значение приобретает структурно-геометрический фактор, на основании которого можно оценить возможность или невозможность ориентированного нарастания.
Применительно к процессу эпитаксии величина несоответствия может быть определена следующим образом:
 (1.1)
(1.1)
где аС, аП – межатомные расстояния соответственно слоя и подложки.
Поверхность, через которую осуществляется совершенное сопряжение атомов обоих веществ (аС = аП), определяется как когерентная поверхность раздела. Эпитаксия возможна при срастании веществ с подобной и различной кристаллической решеткой, однако в обеих структурах должны быть параллельные атомные плоскости, в которых расположение атомов идентично или подобно, а разность межатомных (D а) расстояний не превышает 15%.
Фазовые превращения в бинарной системе могут быть вызваны изменением температуры или давления. Однако возможен и другой путь изменения фазового состава. На рис. 1.3, а показано, что состояние, определяемое фигуративной точкой О, можно получить, меняя не только температуру в системе, но и состав при постоянной температуре. Во втором случае система переходит из одного фазового состояния в другое за счет изотермической диффузии компонентов.

Рис. 1.3 Диаграмма состояния (а) и распределение концентрации компонентов при изотермической диффузии (б) в системе эвтектического типа с ограниченной растворимостью вблизи компонентов
Рассмотрим общие закономерности процессов, протекающих при изотермической диффузии компонентов на примере бинарной системы эвтектического типа с ограниченной растворимостью компонентов в твердом состоянии – случай диффузии компонента Ав объем компонента В(рис. 1.3 а ). Пусть компонент Апоступает на поверхность при температуре Т 1. Вначале в приповерхностных участках создается слой ненасыщенного β -твердого раствора, толщина которого возрастает со временем. Концентрация компонента Аплавно уменьшается от поверхности в глубь образца В.
К некоторому моменту t 1на поверхности достигается концентрация насыщения Сβ. Дальнейшее поступление атомов Априводит к пересыщению β -твердого раствора. При критическом пересыщении на поверхности начнется перекристаллизация β ® α. Кристаллы α -твердого раствора могут расти только на поверхности пересыщенного β -раствора, т.е. α -раствор начинает выделяться в виде тонкого слоя. В дальнейшем толщина его будет увеличиваться и фронт перекристаллизации β ® α будет перемещаться в глубь образца.
При выделении α -фазы пересыщение β -твердого раствора уменьшается, состав его приближается к Сβ. Как в наружном слое β -твердого раствора, так и в слое α -твердого раствора концентрация компонента А плавно снижается по мере удаления от поверхности. В зоне перехода от слоя α - к слою β -твердого раствора имеет место скачок концентрации (рис. 1.3 б).
Кристалл α -твердого раствора сначала имеет состав, близкий к Сa. В дальнейшем концентрация в нем компонента А повышается. При длительной диффузии может произойти полная перекристаллизация β -твердого раствора в α -твердый раствор.
Таким образом, в системах эвтектического типа с ограниченной растворимостью вблизи компонентов при изотермической диффузии зависимость концентрации вещества от координаты всегда претерпевает разрыв, обусловленный ограниченной взаимной растворимостью при температуре диффузии.
Рассмотренному выше случаю соответствует равенство коэффициентов диффузии веществ А и B (D А= D В), которое, однако, сравнительно редко реализуется на практике. В наиболее общем случае D А≠ D В, и график зависимости концентрации от координаты при Т = Т 1 имеет вид, качественно изображенный на рис. 1.3, откуда следует, что положение границы раздела (плоскости Матано, определяемой как плоскость, полный диффузионный поток через которую равен нулю) изменяется во времени, причем направление смещения зависит от соотношения коэффициентов диффузии в твердых растворах.
Графический материал, относящийся к системам с неограниченной растворимостью и с химическими соединениями, представлен на рис. 1.4, 1.5.
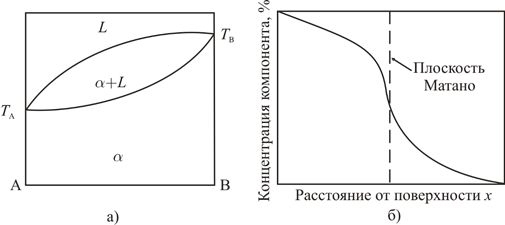
Рис. 1.4 Диаграмма состояния (а) и распределение концентрации компонентов при изотермической диффузии (б) в системе с неограниченной в жидком и твердом состоянии
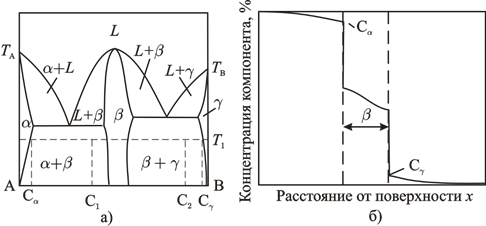
Рис. 1.5 Диаграмма состояния (а) и изменение состава диффузионной зоны (б) в бинарной системе, образующей химическое соединение и ограниченные твердые растворы

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!