Зная локальное поле, действующее на каждую молекулу (уравнение (1.29)), можно вычислить индивидуальные вклады в поляризацию из уравнения (1.7):
 . (1.30)
. (1.30)
Полная поляризация получается подстановкой в уравнение (1.8):
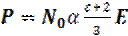 (1.31)
(1.31)
Подставляя выражение для Р из уравнения (1.5), получаем соотношение Клаузиуса–Мосотти:
 (1.32)
(1.32)
Если MW молекулярная масса вещества, а ρ – его плотность, соотношение можно переписать в виде
 (1.33)
(1.33)
где NA. число Авогадро. Величина NAα/(3εo) называется молярной поляризацией Рм и имеет размерность объема. В рамках сделанных допущений молярная поляризация постоянна для данного материала и не зависит от температуры и давления. Можно ожидать, что это утверждение справедливо для газов и паров, где межмолекулярное взаимодействие играет незначительную роль, так что допущение ЕM = 0 справедливо. Надо также помнить, что до сих пор нами не учитывалось влияние ориентации диполей во внешнем поле. К счастью, это затруднение можно обойти, используя высокочастотное значение диэлектрической проницаемости из соотношения Максвелла, связывающего диэлектрическую проницаемость и квадрат показателя преломления света n:
 .(1.34)
.(1.34)
Ориентация молекул слишком медленный процесс, чтобы ее вклад в поляризацию был заметен на столь высоких частотах. Тогда, подставляя (1.34) в (1.33), получаем величину, которая называется молярной рефракцией материала:
 . (1.35)
. (1.35)
Уравнение (1.35), известное как соотношение Лоренц–Лоренца, дает возможность рассчитывать молярную поляризуемость, зная макроскопическую наблюдаемую величину, показатель преломления. При этом важно, чтобы значение показателя преломления бралось вне областей резонансного поглощения, где оно аномально велико. Если показатель преломления относится к оптическим частотам, поляризуемость α будет только электронной. На практике электронная поляризуемость, полученная таким образом, не зависит от температуры и давления даже для веществ в конденсированном состоянии, когда велико межмолекулярное взаимодействие. В табл. 2.1 это продемонстрировано на примере ксенона.
Таблица 2.1. Молярная поляризуемость ксенона
| Состояние
| Поляризуемость, 10–40 Ф•м–2
|
| Газ при нормальных условиях
| 4,45
|
| Жидкость в точке кипения
| 4,27
|
| Жидкость в точке плавления
| 4,26
|
| Твердое тело в точке плавления
| 4,32
|
Ценным свойством молярной поляризуемости является ее аддитивность. В первом приближении молярная рефракция молекул может быть вычислена как сумма вкладов ее отдельных частей. Применяя этот принцип последовательно, можно получить набор значений поляризуемости для широкого ряда атомов, ионов и молекул. В случае органических соединений оказалось плодотворным рассматривать молярную рефракцию симметричных углеводородов, например метана, как сумму рефракций четырех связей С—Н. Таким образом, были получены значения рефракций связи, часть которых [4] приведена в табл. 1.2.
Таблица 1.2. Рефракции связи для D–линии натрия
| Связь
| Рефракция
10–6 м3
| Связь
| Рефракция
10–6 м3
| Связь
| Рефракция
10–6 м3
|
| С–Н
| 1,676
| С–Cℓ
| 6,51
| С–N
| 1,54
|
| С–С
| 1,296
| С–Br
| 9,39
| С=N
| 3,76
|
| С=Н
| 4,17
| С–I
| 14,61
| С≡N
| 4,82
|
| С≡Н (концевая)
| 5,87
| С–O (эфир)
| 1,54
| O–Н (спирт)
| 1,66
|
| С≡Н
(в середине цепи)
| 6,24
| С=О
| 3,32
| О–Н (кислота)
| 1,80
|
| С–Н (ароматическая)
| 2,688
| С–S
| 4,61
| N≡Н
| 1,76
|
| С–F
| 1,44
|
|
|
|
|
Молярную рефракцию любого соединения можно легко вычислить, суммируя значения для всех имеющихся в нем связей. Так, молярная рефракция бутан–2–она, CH3─CO─CH2─CH3, вычисленная таким образом, равна 20,66 см3. Экспериментальное значение составляет 20,79 см3, что с точностью 1% совпадает с расчетной величиной. Причина того, что этот метод хорошо работает, в том, что он неявно учитывает поляризуемость электронов различных связей. В случае полимерных соединений, например полиэтилена CH3─(CH2)n─CH3, можно не учитывать концевые группы и вычислять молярную рефракцию повторяющегося звена ─(CH2)n─. Такой подход не работает в случае молекул, содержащих сопряженные двойные связи, где электроны делокализованы на многих атомах. Значения молярной рефракции в этих случаях исключительно велики, и этот эффект называется экзальтацией рефракции.
Полярные молекулы
В отличие от молярной поляризации, вычисляемой из оптической рефракции, использование для этой цели низкочастотной диэлектрической проницаемости дает величины, которые зависят от температуры. При этом вещества можно разделить на две группы. Для веществ из первой группы молярная поляризация практически постоянна, в соответствии с простым соотношением Клаузиуса–Мосотти, тогда как для веществ второй группы, обладающих высокой диэлектрической проницаемостью, молярная поляризация с ростом температуры уменьшается. Дебай первым осознал, что такое аномальное поведение обусловлено наличием в веществе постоянных диполей [4]. Из теории химической связи известно, что связи в молекулах, содержащих атомы с различной электроотрицательностью, частично ионные и, следовательно, имеют постоянный дипольный момент. Так, хлор обладает большой электроотрицательностью и связь углерод–хлор имеет избыточный отрицательный заряд у атома хлора и положительный у атома углерода:
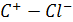
По порядку величины момент такого диполя равен произведению заряда электрона (1,9•10–19 Кл) на типичное значение длины связи (10–10 м), т.е. ~ 10–29 Кл•м.
Использовавшаяся ранее в электростатике единица измерения дипольного момента 1 Д эквивалентна 3,335•10–30 Кл•м. Ориентация молекулярных диполей очевидным образом вносит дополнительный вклад в молярную поляризацию индуцированных диполей, и вполне можно ожидать, что равновесная степень ориентации в данном поле окажется зависящей от температуры.
Рассмотрим воздействие внешнего электрического поля на систему жестких молекулярных диполей, в которой отсутствует деформационная поляризация. Если принять момент каждого из диполей равным μ, его потенциальная энергия и во внешнем поле запишется в виде
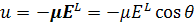 , ( 1.36)
, ( 1.36)
где θ угол между осью диполя и направлением локального электрического поля EL (рис. 1.6).
Если ориентационное воздействие на молекулы ограничивается только внешним электрическим полем, распределение ориентации диполей будет подчиняться закону Больцмана. Таким образом, число диполей ориентированных в пределах элементарного телесного угла dΩ, запишется в виде
Ae –u/(kT) dΩ,
где А постоянная, величина которой зависит от числа диполей в единице объема. Отсюда для среднего молекулярного момента m в направлении электрического поля имеем
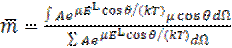 , (1.37)
, (1.37)
где интегрирование ведется по всем возможным направлениям.
Элемент телесного угла dΩ, включающий все направления ориентации диполей в диапазоне углов от θ до θ+dθ относительно направления внешнего поля, равен dΩ=2πsinθdθ=2πd(cosθ).
Подставляя и делая замену переменной x=μEL/(2kT), получаем
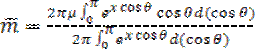 (1.38)
(1.38)
Интегрируя по частям, имеем

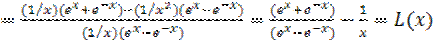 , (1.39)
, (1.39)
где L(x) функция Ланжевена, известная из теории магнетизма, которая разлагается в ряд
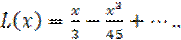 (1.40)
(1.40)
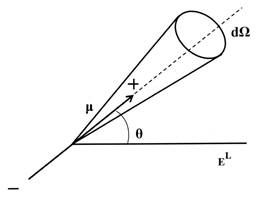
Рис. 1.6. Ориентация молекулярного диполя во внешнем электрическом поле
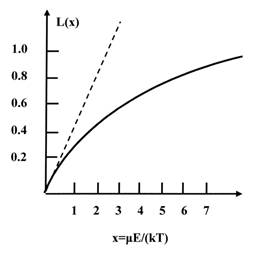
Рис. 1.7. Графический вид функции Ланжевена L(x)
Рис. 1.7 изображает график функции Ланжевена. Видно, что при очень сильных полях должно иметь место насыщение. В действительности такие поля недостижимы и достаточно учесть первый член ряда, так что
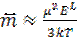 . (1.41)
. (1.41)
Таким образом, поляризация вследствие ориентации диполей оказывается прямо пропорциональна локальной напряженности поля и обратно пропорциональна температуре. Величину μ2/(3kT) можно рассматривать как ориентационную поляризацию и, суммируя ее с деформационной поляризацией αo, получаем полную эффективную поляризуемость:
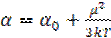 . (1.42)
. (1.42)
Учет анизотропии деформационной поляризуемости молекул приводит к требованию:
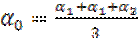 , (1.43)
, (1.43)
где (α1 α2 α3) определяют эллипсоид тензора деформационной поляризуемости.
В окончательном виде выражение для молярной поляризации (уравнение Дебая) запишется в виде
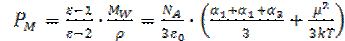 (1.44)
(1.44)
С помощью этой формулы достаточно просто определять дипольные моменты молекул из экспериментальных данных. На графике зависимости молярной поляризации или эффективной поляризуемости от 1/Т, как на рис. 1.8, угол наклона прямой простым образом связан с квадратом дипольного момента.
Метод наилучшим образом применим к газам, для которых эта простая модель, не учитывающая межмолекулярные взаимодействия, достаточно точна. Этот метод также может использоваться в случае разбавленных растворов полярных соединений в неполярных растворителях. При этом предполагается аддитивное сложение поляризаций растворителя и растворенного вещества пропорционально их мольной доле в растворе. Поляризация определяемая из экспериментальных значений диэлектрической проницаемости, подчиняется следующему выражению:
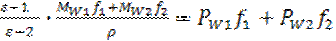 , (1.45)
, (1.45)
где индексы 1, 2 обозначают растворенное вещество и растворитель соответственно. Зная молярную поляризацию чистого растворителя РM2. можно оценить поляризацию растворенного вещества РM1. В действительности последняя величина зависит от концентрации, увеличиваясь с ее ростом (высокие значения f 1). Этот эффект приписывают ассоциации молекул растворенного вещества,
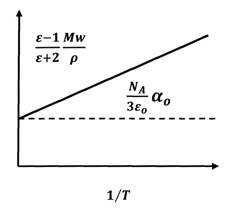
Рис. 1.8. Температурная зависимость молярной поляризации
которую можно исключить, экстраполируя результаты к бесконечному разбавлению, когда каждая молекула растворенного вещества окружена исключительно молекулами растворителя. Данный подход широко применялся и позволил получить значения дипольных моментов для широкого ряда соединений [4]. Логично предположить, что различные атомные группы характеризуются определенными значениями дипольного момента и при объединении в сложную молекулу их дипольные моменты векторно суммируются. Такой принцип оказался полезным тестом для оценки моделей конфигурации молекул и их дипольных моментов, табл.1.3.
Таблица 1.3. Дипольные моменты молекул [4]
| Соединение
| Дипольный момент,
10–30 Кл•м
| Соединение
| Дипольный момент,
10–30 Кл•м
| Соединение
| Дипольный момент,
10–30 Кл•м
|
| Н2О
| 6.1
| CCℓ4
|
| (C2H5)2 O
| 3.8
|
| HF
| 6.4
| CO2
|
| C6H5Cℓ
| 5.7
|
| HCℓ
| 3.6
| NH3
| 4.9
| C6H5Br
| 5.8
|
| HBr
| 2.6
| CH3Cℓ
| 5.3
| C6H5NO2
| 14.0
|
| CH4
|
| C2H5OH
| 5.7
| C6H5CH3
| 1.2
|
Моменты атомных групп существенным образом зависят от типа их химической связи с молекулой, в которую они входят, что приводит к расхождению численных значений. Так, дипольный момент заместителя атома хлора различен у алифатических и ароматических соединений, причем соседние группы в молекуле могут оказывать влияние друг на друга. Тем не менее, существующие данные по дипольным моментам атомных групп, табл.1.4, позволяют делать хорошие оценки дипольных моментов большинства молекул.
Таблица 1.4. Дипольные моменты атомных групп [4]
| Группа
| Алифатические соединения, момент, 10–10 Кл•м
| Угол,
Град а)
| Ароматические соединения, момент, 10–10 Кл•м
| Угол,
град а)
|
| ─СН3
|
|
| 1.3
|
|
| ─F
| 6.3
|
| 5.3
|
|
| ─Br
| 6.7
|
| 5.7
|
|
| ─I
| 6.3
|
| 5.7
|
|
| ─OH
| 5.7
|
| 4.7
|
|
| ─NН2
| 4.0
|
| 5.0
|
|
| ─СOOН
| .5.7
|
| 5.3
|
|
| ─NO2
| 12.3
|
| 14.0
|
|
| ─СN
| .13.4
|
| 14.7
|
|
| ─СOOCН3
| 6.0
|
| 6.0
|
|
| ─OCН3
| 4.0
|
| 4.3
|
|
а) Угол означает направление момента по отношению к связи, соединяющей группу с остальной молекулой.
Направление вектора момента группы обычно можно установить из химической структуры или путем сравнения дипольного момента соединений с различными полярными заместителями.
В твердых телах ситуация гораздо сложнее, так как эффектами межмолекулярных взаимодействий пренебречь невозможно, т. е. приближение ЕM = 0, сделанное при выводе простой формулы для локального поля (1.29) в общем виде не выполняется. Следовательно, рассчитывать дипольные моменты молекул исходя из моментов атомных групп, вычисление молярной поляризации и диэлектрической проницаемости становится невозможным без дальнейшего уточнения модели диэлектрика. В случае полимеров возникают дополнительные сложности, связанные с гибкостью длинных цепей.
Недостатки простой модели становятся очевидны, если решить уравнение Дебая для соотношения Клаузиуса–Мосотти (1.44) относительно ε, пренебрегая вкладом αo:
 . (1.46)
. (1.46)
Полученное выражение предсказывает, что ε стремится к бесконечности, когда температура приближается к Тс,
 (1.47)
(1.47)
и уравнение может быть записано в виде функции этой критической температуры:
 . (1.48)
. (1.48)
Трудность в том, что отсюда следует, что при понижении температуры поляризация возрастает настолько, что диполи спонтанно выстраиваются параллельно друг другу, даже в отсутствии внешнего поля [4].
Такое явление называется сегнетоэлектрическим эффектом и аналогично ферромагнетизму, а уравнение (1.48) напоминает закон Кюри–Вейса. Сегнетоэлектрический эффект имеет место в некоторых кристаллических соединениях, однако встречается достаточно редко. Это означает, что уравнение Дебая не справедливо для большинства материалов при высоких локальных полях и для использования в этих условиях его необходимо модифицировать.
Существует улучшенная модель для расчета локального поля, согласно которой рассматривается сферическая полость вокруг молекулы в диэлектрике [4]. Диполь молекулы μ считается точечным и находится в центре сферы радиусом а. Предполагается, что локальное поле, действующее на диполь в центре полости, состоит из двух компонент поля полости G и поля противодействия R:
E L= G+ R. (1.49)
Поле полости определяется как поле, действующее внутри пустой сферы во внешнем поле Е, т.е.
 . (1.50)
. (1.50)
Поле противодействия определяется как дополнительное поле полости, обусловленное поляризацией вещества вне ее, вызванной наличием точечного диполя в центре сферы, т. е.
 . (1.51)
. (1.51)
Используя это локальное поле, окончательно получаем уравнение Онзагера [4]:
 , (1.52)
, (1.52)
где деформационная поляризуемость молекул учитывается посредством уравнения для молярной рефракции (1.35). Это выражение достаточно успешно описывает поведение многих жидкостей и является улучшенной формой соотношения Клаузиуса–Мосотти, поскольку не приводит к появлению сегнетоэлектрического эффекта (часто называемого сегнетоэлектрической катастрофой). Сильные локальные взаимодействия, однако, в этой модели по–прежнему не учитываются, и не удивительно, что она терпит неудачу при попытке описания свойств ассоциированных жидкостей, например воды и многих соединений в твердой фазе.
Существует строгий подход в рамках статистической механики для учета влияния локального упорядочения [4]. Эта модель, однако, справедлива лишь для жестких диполей, ее удалось распространить на систему поляризуемых полярных молекул. Конечным результатом явилось следующее уравнение Фрёлиха, которое связывает макроскопическую диэлектрическую проницаемость с дипольным моментом молекулы [4]:
 . (1.53)
. (1.53)
Параметр  является коэффициентом корреляции, учитывающим локальную упорядоченность:
является коэффициентом корреляции, учитывающим локальную упорядоченность:
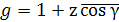 , (1.54)
, (1.54)
где z число ближайших соседей молекулы в системе и γ угол между молекулой в точке отсчета и ее ближайшим соседом. Уравнение Фрёлиха (1.53) сводится к уравнению Онзагера при g = 1.
Уравнение Фрёлиха (1.53) применимо настолько, насколько нам известен коэффициент корреляции g, который зависит от формы молекулы и расположения в ней постоянных диполей, а также от анизотропии поляризуемости и распределения зарядов более высокого порядка симметрии. Теория дает возможность понять поведение полярных соединений, однако отклонения от простого уравнения Дебая (1.44) во многих случаях могут обсуждаться только качественно.
Влияние эффектов локального упорядочения при измерении дипольных моментов полярных соединений в неполярных растворителях известно, полученные с использованием простой модели значения даже при экстраполяции к бесконечному разбавлению отличаются от значений, измеренных в газовой фазе. Этот так называемый эффект растворителя обусловлен наличием противодействующего поля Онзагера. При отсутствии сильного локального упорядочения формула Онзагера (1.52) справедлива и кажущееся значение момента в растворе связано со значением в газовой фазе соотношением
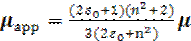 ( 1.55)
( 1.55)
Обычно же по причинам, указанным выше, молекулы растворителя определенным образом упорядочиваются вокруг полярных молекул. Эффект главным образом зависит от анизотропии молекул растворенного соединения, и имеется множество полуэмпирических уравнений, выведенных в попытке объяснить кажущееся изменение дипольного момента в растворе. Альтернативным выходом может быть оценка, полученных в растворе и газовой фазе значений дипольного момента и использование того или другого в каждом конкретном случае [4].
В случае полимеров основной эффект упорядочения является по свой природе внутримолекулярным, как это будет видно из следующего параграфа.





 . (1.30)
. (1.30)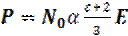 (1.31)
(1.31) (1.32)
(1.32) (1.33)
(1.33) .(1.34)
.(1.34) . (1.35)
. (1.35)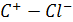
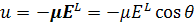 , ( 1.36)
, ( 1.36)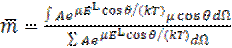 , (1.37)
, (1.37)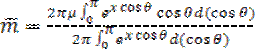 (1.38)
(1.38)
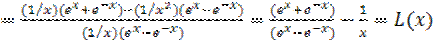 , (1.39)
, (1.39)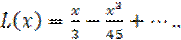 (1.40)
(1.40)

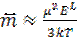 . (1.41)
. (1.41)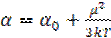 . (1.42)
. (1.42)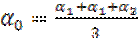 , (1.43)
, (1.43)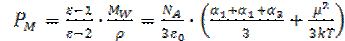 (1.44)
(1.44)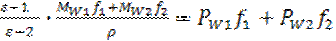 , (1.45)
, (1.45)
 . (1.46)
. (1.46) (1.47)
(1.47) . (1.48)
. (1.48) . (1.50)
. (1.50) . (1.51)
. (1.51) , (1.52)
, (1.52) . (1.53)
. (1.53) является коэффициентом корреляции, учитывающим локальную упорядоченность:
является коэффициентом корреляции, учитывающим локальную упорядоченность: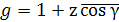 , (1.54)
, (1.54)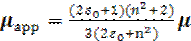 ( 1.55)
( 1.55)


