а) Получение сульфида свинца (II) из сульфата свинца (II)
В пробирку внесите 2 капли раствора нитрата свинца (II) и прибавьте 3 капли раствора сульфата натрия.
Отметьте цвет образовавшегося осадка. Какое вещество выпадает в осадок? Напишите молекулярное и краткое ионно-молекулярное уравнения реакции. Сделайте вывод об условии образования полученного малорастворимого сильного электролита, приведя численное значение ПР.
Осадку дайте отстояться. Отберите пипеткой жидкую фазу. К осадку добавьте 3-4 капли сульфида натрия и перемешайте осадок стеклянной палочкой. Как изменился цвет осадка? Какое вещество образовалось? Напишите молекулярное и краткое ионно-молекулярное уравнения реакции.
Объясните, пользуясь следствием из правила произведения растворимости и численными значениями ПР солей, переход одного осадка в другой.
Сделайте вывод об условии получения одного малорастворимого соединения из другого.
б). Получение хромата свинца (II) из сульфата свинца (II)
Внесите в пробирку 2 капли раствора нитрата свинца (II) и добавьте к нему 3 капли раствора сульфата натрия.
Отметьте цвет образовавшегося осадка. Какое вещество выпадает в осадок? Напишите молекулярное и краткое ионно-молекулярное уравнения реакции. Сделайте вывод об условии образования полученного малорастворимого сильного электролита, приведя численное значение ПР.
Осадку дайте отстояться. Отберите пипеткой жидкую фазу. К осадку добавьте 3-4 капли хромата калия и перемешайте осадок стеклянной палочкой. Как изменился цвет осадка? Какое вещество образовалось? Напишите молекулярное и краткое ионно-молекулярное уравнения реакции.
Объясните, пользуясь следствием из правила произведения растворимости и численными значениями ПР солей, переход одного осадка в другой.
Сделайте вывод об условии получения одного малорастворимого соединения из другого.
Составьте отчет по лабораторной работе в соответствии с рекомендуемым планом:
1. Напишите номер и название опыта.
2. В каждом опыте пошагово (взаимоувязывая выполняемые действия, наблюдения, объяснение наблюдений):
- опишите ход работы;
- запишите наблюдения;
- объясните наблюдения, приведя соответствующие уравнения реакций;
- ответьте на вопросы, поставленные в опыте.
3. Сделайте вывод.
4. Ответьте на контрольные вопросы.
Перечень вариантов лабораторной работы
| Варианты
| Опыты
| Контрольные вопросы
|
|
|
| 2а
| 1;8
|
|
| 2а
| 3б
| 2;7а
|
|
| 2б
| 3а
| 3;7б
|
|
|
| 2б
| 4;7в
|
|
| 2б
| 3б
| 5;7г
|
|
| 2а
| 3а
| 6;7д
|
Контрольные вопросы и задачи
1. Пользуясь величинами ПР, сравните растворимость (моль/л) солей: a) AgI и Аg2СОз; б) PbS и PbCl2.
2. Напишите выражения для произведения растворимости следующих малорастворимых соединений: AgCl, Ag2CO3, Саз(РО4)2. Можно ли с помощью произведения растворимости характеризовать растворимость NaCl, Rb2CO3, Al2(SO 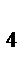 )3? Почему?
)3? Почему?
3. В 100 мл насыщенного раствора сульфата бария при комнатной температуре содержится 2,45*10-4 г BaSO4. Вычислите ПРBaSO4.Сравните полученное значение ПР с его табличным значением.
4. В насыщенном растворе Mg3(PO4)2 объемом 10 л содержится соль массой 3 г. Вычислите ее растворимость и найдите молярные концентрации каждого иона в этом растворе.
5. При какой концентрации хромат-ионов СгО  начнется выпадение осадка РЬСгО4 из раствора Pb(NO3)2 концентрации 0,1 моль/л?
начнется выпадение осадка РЬСгО4 из раствора Pb(NO3)2 концентрации 0,1 моль/л?
6. Добавлением какого электролита достигается наибольшая полнота осаждения иона Ва2+:
а) К2Сг04; б) КС1; в) (NH4)2SO4; г) Na3PO4; д) NaOH? Ответ обоснуйте, написав уравнения соответствующих реакций и учитывая значения ПР.
7. Вычислите растворимость в молях и граммах на 1 л растворов следующих соединений: а) хромата бария,  =1,6*10-10; б) карбоната кальция,
=1,6*10-10; б) карбоната кальция,  = 5*10-9; в)сульфида свинца (II),
= 5*10-9; в)сульфида свинца (II),  = 1*10-27; г) хромата серебра,
= 1*10-27; г) хромата серебра,  = 4* 10-12; д) фосфата кальция, ПР Саз(РО4)2 =1*10-26.
= 4* 10-12; д) фосфата кальция, ПР Саз(РО4)2 =1*10-26.
8. Вычислите ПР иодида свинца (II), если известно, что растворимость его при комнатной температуре равна 0,058 г на 100 г раствора.
Литература
1. Коровин Н.В. Общая химия [Текст]: Учебник для студентов вузов, обучающихся по техническим направлениям и специальностям / Коровин Н.В. – М.: Высшая школа, 2007 – 558 с.
2. Ахметов Н.С.Общая и неорганическая химия [Текст]: учебник для студентов химико-технологических специальностей вузов / Н. С. Ахметов – М.: Высшая школа, 2009. – 743 с.
3. Коровин Н.В. Лабораторные работы по химии [Текст]: учебное пособие /Мингулина Э.И., Рыжкова Н.Г. – М.: Высшая школа, 2001. – 256 с.
4. Ахметов Н. С., Азизова М. К., Бадыгина Л. И. Лабораторные и семинарские занятия по неорганической химии [Текст]: Учебное пособие. – М.: Высшая школа, 2003. – 368 с.
5. Глинка, Н.Л. Задачи и упражнения по общей химии [Текст]: учебное пособие для студентов вузов / Под ред. В. А. Рабиновича, Х. М. Рубиной. – М.: Интеграл-Пресс, 2007. - 240 с.
Оглавление
Введение. 3
Правила работы в химической лаборатории и техника безопасности. 4
РАБОТА № 4. ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ.. 6
Краткое теоретическое обоснование. 6
Экспериментальная часть. 9
Перечень вариантов лабораторной работы.. 10
Контрольные вопросы и задачи. 10
РАБОТА № 5 РЕАКЦИИ ИОННОГО ОБМЕНА.. 12
Краткое теоретическое обоснование. 12
Экспериментальная часть. 14
Рекомендации по оформлению отчета: 15
Перечень вариантов лабораторной работы.. 16
Контрольные вопросы и задачи. 16
РАБОТА № 6. ИССЛЕДОВАНИЕ ГЕТЕРОГЕННОГО РАВНОВЕСИЯ В РАСТВОРАХ МАЛОРАСТВОРИМЫХ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ.. 18
Краткое теоретическое обоснование. 18
Экспериментальная часть. 19
Перечень вариантов лабораторной работы.. 21
Контрольные вопросы и задачи. 21
Литература. 22
Приложение №1
Рекомендуемая форма оформления титульного листа отчета по лабораторной работе
Кафедра ОФХ
Лабораторная работа № 4
Тема: Приготовление раствора заданной концентрации
Цель работы:
1) освоение методики приготовления раствора заданной концентрации методом разбавления;
2) определение концентрации приготовленного раствора по его плотности.
Вариант 1
Выполнил: ФИО обучающегося, группа
Работа выполнена: (дата выполнения работы)
Для заметок
Для заметок
Для заметок
Учебное издание
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Часть 1
Методические указания для лабораторных работ
Составители:
Севастьянова Галина Константиновна,
Карнаухова Тамара Михайловна
В авторской редакции
Подписано в печать_________ Формат 60х901/16. Печ. л. 1,75
Тираж 100 экз. Заказ №
Библиотечно-издательский комплекс
федерального государственного бюджетного образовательного
учреждения высшего образования
«Тюменский индустриальный университет»
625000, Тюмень, ул. Володарского, 38
Типография библиотечно-издательского комплекса
625039, Тюмень, ул. Киевская, 52



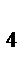 )3? Почему?
)3? Почему? начнется выпадение осадка РЬСгО4 из раствора Pb(NO3)2 концентрации 0,1 моль/л?
начнется выпадение осадка РЬСгО4 из раствора Pb(NO3)2 концентрации 0,1 моль/л? =1,6*10-10; б) карбоната кальция,
=1,6*10-10; б) карбоната кальция,  = 5*10-9; в)сульфида свинца (II),
= 5*10-9; в)сульфида свинца (II),  = 1*10-27; г) хромата серебра,
= 1*10-27; г) хромата серебра,  = 4* 10-12; д) фосфата кальция, ПР Саз(РО4)2 =1*10-26.
= 4* 10-12; д) фосфата кальция, ПР Саз(РО4)2 =1*10-26.

