Основы молекулярно-кинетической теории разработаны М.В. Ломоносовым, Л.Больцманом, Дж. Максвеллом и др. Эта теория основана на следующих положениях:
1.Все вещества состоят из мельчайших частиц – молекул. Молекулы у сложных веществ состоят из еще более мелких частиц – атомов. Различные комбинации атомов создают виды молекул. Атом состоит из положительно заряженного ядра, окруженного отрицательно заряженной электронной оболочкой. Массу молекул и атомов измеряют в атомных единицах массы (а. е. м.). Диаметр атомов и молекул имеет порядок 10 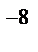 - 10
- 10  см. Количество вещества, в котором содержится число частиц (атомов или молекул) равное числу атомов в 0,012 кг изотопа углерода С
см. Количество вещества, в котором содержится число частиц (атомов или молекул) равное числу атомов в 0,012 кг изотопа углерода С  называется молем.
называется молем.
2.
Число частиц, содержащих в моле (киломоле) вещества, называется
числом Авогадро. N
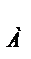
= 6.023*10

кмоль
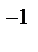
. Массу моля называет
молярной массой. Между атомами и молекулами действуют силы взаимного притяжения и отталкивания. По мере увеличения расстояния (r) между молекулами силы отталкивания убывают быстрее, чем силы притяжения. При некотором определенном расстоянии (r

) наступает равенство сил отталкивания и сил притяжения и молекулы находятся в состоянии устойчивого равновесия. Силы взаимодействия обратно пропорциональны n-й степени расстояния между молекулами (для f
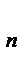
, n = 7; для f

, n принимает значение от 9 до 15).Расстояние r
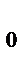
между молекулами соответствует минимуму их потенциальной энергии. Для изменения расстояния, отличного от r
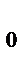
требуется затратить работу или против сил отталкивания или против сил притяжения; т.о. положение устойчивого равновесия молекул соответствует минимуму их потенциальной энергии.
Молекулы, образующие тело, находятся в состоянии непрерывного беспорядочного движения.
Молекулы сталкиваются друг с другом, изменяют скорость как по величине, так и по направлению. При этом происходит перераспределение их общей кинетической энергии. Состоящее из молекул тело рассматривается как система движущихся и взаимодействующих частиц. Такая система молекул обладает энергией, состоящей из потенциальной энергии взаимодействия частиц и из кинетической энергии движения частиц. Эту энергию и называют внутренней энергией тел. Количество внутренней энергии, передаваемой между телами при теплообмене, называется количеством теплоты (Джоуль, кал). Джоуль – СИ. 1 кал = 4,18 Дж. Атомы и молекулы находятся в непрерывном движении, которое называется тепловым. Основным свойством теплового движения является его бесперебойность (хаотичность). Для количественной характеристики интенсивности теплового движения вводится понятие температуры тела. Чем интенсивнее тепловое движение молекул в теле, тем выше его температура. При соприкосновении двух тел энергия переходит от более нагретого тела к менее нагретому и в конце концов устанавливается состояние теплового равновесия.
С точки зрения молекулярно-кинетических представлений температура есть величина, характеризующая среднюю кинетическую энергию поступательного движения молекул или атомов. За единицу измерения температуры тепла принят градус. (Сотая часть разности между температурами кипения и замерзания чистой воды при атмосферном давлении). В физику введена абсолютная температурная шкала Кельвина. Градус Цельсия равен градусу Кельвина. При температуре – 273 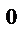 С должно прекратиться поступательное движение молекул газа (абсолютный нуль), т. е. система (тело) обладает наименьшей возможной энергией.
С должно прекратиться поступательное движение молекул газа (абсолютный нуль), т. е. система (тело) обладает наименьшей возможной энергией.
Основные положения молекулярно-кинетической теории строения вещества подтверждаются многочисленными опытами и явлениями (диффузия, броуновское движение, смешивание жидкостей, сжимаемость различных веществ, растворение в жидкостях твердых веществ и т. д.). Современные экспериментальные методы – рентгеноструктурный анализ, наблюдения с помощью электронного микроскопа и другие – обогатили наши представления о строении вещества. В газе между молекулами относительно большие расстояния, силы притяжения ничтожно малы. Молекулы газа стремятся всегда равномерно распределиться по всему занимаемому им объему. Газ оказывает давление на стенки сосуда, в котором он находится. Это давление обусловлено ударами движущихся молекул. При изучении кинетической теории газа рассматривают так называемый идеальный газ. Газ, в котором пренебрегаем силами межмолекулярного взаимодействия и объемом молекул газа. Считая, что при соударениях молекулы идеального газа представляют собой как абсолютно упругие шарики.
Основные газовые законы
Состояние некоторой массы m газа характеризуют основными параметрами: давлением P, температурой Т и объемом V. Эти термодинамические параметры тесно связаны. Процессы в газе, при которых меняются его параметры состояния, называются газовыми процессами. Газовые процессы, в которых один из параметров остается неизменным называются изопроцессами. Для идеальных газов справедливы следующие законы:
Закон Бойля-Мариотта. (Бойль – англ., 1662г.; Мариотт – франц., 1667г.)
Если Т = const данной массы газа (m = const), а давление P и V – объем изменяются. Процесс называется изотермическим. Для данной массы газа при постоянной температуре давление газа изменяется обратно пропорционально объему.PV = const Для двух состояний газа закон имеет вид: P1V1= P2V2, где P1иV1 - начальное состояние, P2иV2 - в конечном состоянии. Графически изотермический процесс представляется в виде гиперболы, называемой изотермой.
Р
Т = const
V, м 
Законы Гей-Люссака. (1802 г.)Давление Р = const и m = const. Процесс изобарический.
Для данной массы газа при постоянном давлении объем газа изменяется линейно с температурой.
V
Р = const
V 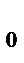
- 273 0 t,  С
С
V  = V
= V  (1 + dt),где V
(1 + dt),где V  - объем при t = 0
- объем при t = 0 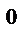 С;V
С;V  - объем газа при t;d – коэффициент объемного расширения; d = 1/273 град
- объем газа при t;d – коэффициент объемного расширения; d = 1/273 град  .Графически изобарический процесс представляет прямую.V/V0= T/T0При постоянном давлении объем газа пропорционален абсолютной температуре. ОбъемV = constиm = const. Процесс изохорический. Иногда этот закон называют закон Шарля. Для данной массы газа при постоянном объеме давление газа изменяется линейно с температурой.P
.Графически изобарический процесс представляет прямую.V/V0= T/T0При постоянном давлении объем газа пропорционален абсолютной температуре. ОбъемV = constиm = const. Процесс изохорический. Иногда этот закон называют закон Шарля. Для данной массы газа при постоянном объеме давление газа изменяется линейно с температурой.P 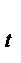 = P
= P  (1 + γt),где P
(1 + γt),где P  - давление при t = 0
- давление при t = 0 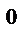 С;γ – термический коэффициент давления; γ = 1/273 град
С;γ – термический коэффициент давления; γ = 1/273 град  .Графически изохорический процесс представляет прямую.P/P0 =T/T0 «При постоянном объеме давление газа пропорционально абсолютной температуре».
.Графически изохорический процесс представляет прямую.P/P0 =T/T0 «При постоянном объеме давление газа пропорционально абсолютной температуре».
Закон Дальтона (1801 г., англ.) Парциальным давлением газа, входящего в газовую смесь, называется давление, которое имел бы этот газ, если бы он один занимал весь объем, представленной смеси. Давление газовой смеси равно сумме парциальных давлений входящих в нее газов.P = P1 + P2 + P3 + P4 + … + Pn
Закон Авогадро (итал., 1811 г.)При одинаковых температуре и давлении моли любых газов занимают одинаковые объемы. При нормальных условиях (температура 273,16 К и давлении 1,0133 Па) этот объем равен 22,41 м3/ моль.





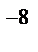 - 10
- 10  см. Количество вещества, в котором содержится число частиц (атомов или молекул) равное числу атомов в 0,012 кг изотопа углерода С
см. Количество вещества, в котором содержится число частиц (атомов или молекул) равное числу атомов в 0,012 кг изотопа углерода С  называется молем.
называется молем.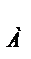 = 6.023*10
= 6.023*10  кмоль
кмоль 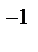 . Массу моля называет молярной массой. Между атомами и молекулами действуют силы взаимного притяжения и отталкивания. По мере увеличения расстояния (r) между молекулами силы отталкивания убывают быстрее, чем силы притяжения. При некотором определенном расстоянии (r
. Массу моля называет молярной массой. Между атомами и молекулами действуют силы взаимного притяжения и отталкивания. По мере увеличения расстояния (r) между молекулами силы отталкивания убывают быстрее, чем силы притяжения. При некотором определенном расстоянии (r  ) наступает равенство сил отталкивания и сил притяжения и молекулы находятся в состоянии устойчивого равновесия. Силы взаимодействия обратно пропорциональны n-й степени расстояния между молекулами (для f
) наступает равенство сил отталкивания и сил притяжения и молекулы находятся в состоянии устойчивого равновесия. Силы взаимодействия обратно пропорциональны n-й степени расстояния между молекулами (для f 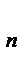 , n = 7; для f
, n = 7; для f  , n принимает значение от 9 до 15).Расстояние r
, n принимает значение от 9 до 15).Расстояние r 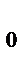 между молекулами соответствует минимуму их потенциальной энергии. Для изменения расстояния, отличного от r
между молекулами соответствует минимуму их потенциальной энергии. Для изменения расстояния, отличного от r 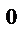 С должно прекратиться поступательное движение молекул газа (абсолютный нуль), т. е. система (тело) обладает наименьшей возможной энергией.
С должно прекратиться поступательное движение молекул газа (абсолютный нуль), т. е. система (тело) обладает наименьшей возможной энергией.
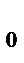
 С
С = V
= V  (1 + dt),где V
(1 + dt),где V  - объем при t = 0
- объем при t = 0 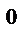 С;V
С;V  .Графически изобарический процесс представляет прямую.V/V0= T/T0При постоянном давлении объем газа пропорционален абсолютной температуре. ОбъемV = constиm = const. Процесс изохорический. Иногда этот закон называют закон Шарля. Для данной массы газа при постоянном объеме давление газа изменяется линейно с температурой.P
.Графически изобарический процесс представляет прямую.V/V0= T/T0При постоянном давлении объем газа пропорционален абсолютной температуре. ОбъемV = constиm = const. Процесс изохорический. Иногда этот закон называют закон Шарля. Для данной массы газа при постоянном объеме давление газа изменяется линейно с температурой.P 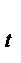 = P
= P  (1 + γt),где P
(1 + γt),где P 

