

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
Топ:
Особенности труда и отдыха в условиях низких температур: К работам при низких температурах на открытом воздухе и в не отапливаемых помещениях допускаются лица не моложе 18 лет, прошедшие...
Техника безопасности при работе на пароконвектомате: К обслуживанию пароконвектомата допускаются лица, прошедшие технический минимум по эксплуатации оборудования...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Интересное:
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Подходы к решению темы фильма: Существует три основных типа исторического фильма, имеющих между собой много общего...
Как мы говорим и как мы слушаем: общение можно сравнить с огромным зонтиком, под которым скрыто все...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Ход опыта
· Получить у преподавателя набор из трёх солей в пронумерованных пробирках. Цель опыта - определить, в какой из пробирок находится каждая из солей.
· В каждую из пробирок налить по 3 - 5 мл дистиллированной воды и взбалтыванием тщательно перемешать содержимое.
· Определить рН раствора в каждой пробирке с помощью универсальной индикаторной бумаги. Для этого полоску бумаги смочить исследуемым раствором и сравнить её окраску со шкалой окраски универсального индикатора.
Результаты и наблюдения
Значения рН водных растворов исследуемых солей:
| Номер пробирки | рН |
| 1 | |
| 2 | |
| 3 |
Обработка результатов
· Ионные и молекулярные уравнения реакции гидролиза исследуемых солей по первой ступени с указанием предполагаемого значения рН водных растворов (больше, меньше, примерно равно семи):
(если какая-либо из солей набора не подвергается гидролизу, вместо уравнений реакции следует написать: "гидролизу не подвергается")
 |
(формула соли и уравнение диссоциации)
 |
(ионное уравнение)
 |
(молекулярное уравнение)
 |
(предполагаемое значение рН >,<, » 7)
 |
(формула соли и уравнение диссоциации)
 |
(ионное уравнение)
 |
(молекулярное уравнение)
 |
(предполагаемое значение рН >,<, » 7)
 |
(формула соли и уравнение диссоциации)
 |
(ионное уравнение)
 |
(молекулярное уравнение)
 |
(предполагаемое значение рН >,<, » 7)
Вывод
На основании сравнения предполагаемых значений рН с полученными опытным путём распределение исследуемых солей по пробиркам:
| Номер пробирки | Формула соли |
| 1 | |
| 2 | |
| 3 |
Опыт 2. Совместный гидролиз двух солей
Цель опыта
· Провести совместный гидролиз двух солей, одна из которых гидролизуется по катоину, другая – по аниону.
· Установить состав продуктов совместного гидролиза двух солей.
· Установить обратима или необратима проводимая реакция.
|
|
Ход опыта
· Налейте в пробирку 1–2 мл раствора хлорида железа (III).
· Добавьте 0,5–1 мл раствора карбоната натрия.
Результаты и наблюдения
________________________________________________________________________________________________________________________________________________________________________________________
Обработка результатов
· _____________ – соль, образованная _______________ основанием ________
(формула соли) (сильным, слабым) (формула)
и _______________ кислотой ________ ; гидролизуется по __________________
(сильной, слабой) (формула) (катиону, аниону)
____________________________________________________________________
(уравнение диссоциации соли)
· _____________ – соль, образованная _______________ основанием ________
(формула соли) (сильным, слабым) (формула)
и _______________ кислотой ________ ; гидролизуется по __________________
(сильной, слабой) (формула) (катиону, аниону)
____________________________________________________________________
(уравнение диссоциации соли)
· Молекулярное и ионное уравнения реакции совместного гидролиза:
____________________________________________________________________
____________________________________________________________________
____________________________________________________________________
Выводы
· В реакцию совместного гидролиза вступают соли, образованные
___________________________________________________________________ и ____________________________________________________________________
· Совместный гидролиз является _______________________________________ реакцией, так как
(обратимой, необратимой)
приводит к образованию к образованию __________________________________
____________________________________________________________________
Лабораторная работа № 7
"Окислительно-восстановительные реакции"
Влияние среды на окислительные свойства перманганата калия
Ход опыта
· В три пробирки налить по 0,5 - 1 мл раствора перманганата калия (KMnO4).
|
|
· Добавить:
в первую пробирку – 5 - 10 капель раствора серной кислоты;
во вторую пробирку - 0,5 - 1 мл 10 - 20%-ного раствора гидроксида натрия.
· Во все три пробирки внести по одному микрошпателю кристаллического сульфита натрия.
Результаты и наблюдения
Исходная окраска раствора перманганата калия - .
В результате реакции в пробирках произошли следующие изменения:
| Номер пробирки | Среда | Наблюдения | |
| осадок или раствор | цвет | ||
| 1 | кислая | ||
| 2 | щелочная | ||
| 3 | нейтральная | ||
Обработка результатов
· В ходе опыта проходит окислительно-восстановительная реакция между перманганатом калия (окислителем) и сульфитом натрия (восстановителем).
· В кислой среде реакция проходит по схеме:
KMnO4 + Na2SO3 + H2SO4 ® Mn2+ + SO42-.
Уравнения полуреакций, ионное и молекулярное уравнения реакции:
 | |
 | |
 | |
 | |
 | |
 |
· В щелочной среде реакция проходит по схеме:
KMnO4 + Na2SO3 + NaOH ® MnO42- + SO42-.
Уравнения полуреакций, ионное и молекулярное уравнения реакции:
 | |
 | |
 | |
 | |
 | |
 |
· В нейтральной среде реакция проходит по схеме:
KMnO4 + Na2SO3 + H2O ® MnO2 + SO42-.
Уравнения полуреакций, ионное и молекулярное уравнения реакции:
 | |
 | |
 | |
 | |
 | |
 |
Вывод
При окислительно-восстановительных реакциях с участием перманганата калия в зависимости от среды могут быть получены различные продукты восстановления перманганат-иона:

 кислая среда
кислая среда
( )
щелочная среда

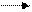 MnO4- + восстановитель ( )
MnO4- + восстановитель ( )
нейтральная среда
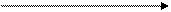 ( )
( )
цвет соединений
|
|
|

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Адаптации растений и животных к жизни в горах: Большое значение для жизни организмов в горах имеют степень расчленения, крутизна и экспозиционные различия склонов...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!